内皮祖细胞在早期急性肾缺血再灌注损伤中的抗凋亡作用观察
2012-12-25陈波薄成佳贾瑞鹏朱佳庚李文成吴然刘昊葛余正
陈波,薄成佳,贾瑞鹏,朱佳庚,李文成,吴然,刘昊,葛余正
(1.东南大学医学院,江苏南京 210009;2.南京医科大学附属南京第一医院泌尿外科,江苏南京 210006)
急性肾功能衰竭是临床上常见的急危重症,缺血再灌注损伤(ischemia reperfusion injury,IRI)是其主要原因之一,病死率可高达50% ~80%[1]。近年来,随着再生医学的蓬勃发展,干细胞在急、慢性肾脏疾病治疗中的应用正日益受到关注。内皮祖细胞(endothelial progenitor cell,EPC)作为一种具有定向归巢、增殖、分化为成熟内皮细胞特性的多能干细胞,在缺血性心脏病、急性肺损伤、高血压病等多种疾病的治疗领域发挥了重要作用[2-4]。Patschan 等[5]报道,由缺血性损伤动员的EPC可对肾脏缺血组织产生保护性作用,但其研究未涉及EPC在抗细胞凋亡方面的作用。因此,我们拟观察同种异体EPC移植对肾IRI急性期的治疗效果并探讨其可能机制。
1 材料和方法
1.1 材料
雄性SD大鼠[购自南京医科大学实验动物中心(SPF级)];EGM-MV培养基(Lonza公司);淋巴细胞分离液(上海华精生物高科技有限公司);胰酶/EDTA(Gibco公司);兔抗大鼠血管内皮生长因子(VEGF)多克隆抗体(Santa公司);TUNEL凋亡检测试剂盒(Roche公司);蛋白质印迹检测试剂盒(Bio-Rad);CM-Dil(氯甲基苯甲酰氨荧光染料V-228888)、二甲基亚砜(DMSO,Sigma公司)。
1.2 实验动物及分组
健康雄性SD大鼠30只,体重230~250 g,随机分为EPC移植组(EPC组)、缺血再灌注损伤组(IRI组)和假手术组,每组10只。EPC组:游离双侧肾蒂,夹闭双侧肾蒂45 min,恢复血流灌注后股静脉注入0.5 ml经CM-Dil标记的 EPC悬液(细胞密度1.0×106L-1);IRI组:游离双侧肾蒂,夹闭双侧肾蒂45 min,恢复血流灌注后股静脉注入0.5 ml生理盐水;假手术组:游离双侧肾蒂,暴露45 min后股静脉注入EPC悬液(剂量同EPC组)。分别于建模后72 h处死各组大鼠。
1.3 EPC的分离、培养、鉴定和标记
Ficoll密度梯度离心法获取SD大鼠骨髓源性单个核细胞。健康雄性SD大鼠,体重130~150 g,大鼠颈椎脱臼处死,于无菌条件下获取股骨和胫骨,PBS液冲出骨髓组织,将冲洗液轻置于淋巴细胞分离液上,2 500 r·min-1离心 30 min,取中间相细胞层,PBS 清洗2次,加入EGM-2MV培养基制成细胞悬液[6],细胞计数后加入25 cm2培养瓶(纤维连接蛋白包被),于37℃、体积分数为5%CO2细胞培养箱中培养,10 d后可进行免疫组织化学染色(CD31、CD34、Ⅷ因子)鉴定 EPC 及细胞活力[7]。
1.4 EPC的标记
DMSO 溶解CM-Dil,配成1 g·L-1的分装溶液。取CM-Dil分装溶液 1 μl,PBS 液稀释至2 mg·L-1,重悬于收集培养10 d的EPC沉淀(细胞密度为1.0×106L-1)中,细胞接种至25 cm2培养瓶中,37℃孵育5 min,4 ℃再孵育15 min[8],然后于荧光显微镜下观察标记后的EPC特征。
1.5 观察内容和检测指标
1.5.1 肾功能的测定 分别于肾IRI后24、48 h从大鼠尾静脉采血,分离血清后置于-20℃冰箱保存,使用日立全自动生化分析仪酶法测定大鼠尿素氮(BUN)和肌酐(Scr)浓度。
1.5.2 肾组织病理学检查及EPC示踪 左肾固定、脱水、透明、包埋、切片、HE染色,进行病理分析;右肾行冰冻切片,在荧光显微镜下观察EPC的归巢情况。肾小管损伤定义为肾小管坏死或刷状缘脱落、管型形成、管腔扩张,每张切片计算10个视野(×200)。按受损比例进行肾小管间质损伤程度评分(HSK):无病变为0分;<25%为1分;25%≤损伤比例<50%为2分;50%≤损伤比例<75%为3分;≥75%为4分。分值越高表示损伤越重。
1.5.3 细胞凋亡检测 采用脱氧核苷酸末端转移酶介导的缺口末端标记(TUNEL)法检测,按试剂盒说明书操作,凋亡指数(apoprotic index,AI)采用以下方法计算:每张切片至少计数500个细胞,以每100个细胞内的阳性细胞数作为凋亡指数,用百分数表示。
1.5.4 蛋白质印迹检测 提取组织蛋白,测定蛋白浓度,蛋白上样,行PAGE电泳。转膜,封闭,兔抗大鼠VEGF多克隆抗体4℃孵育过夜,加入辣根过氧化物酶标记的羊抗兔IgG二抗,曝光、显影、成像。应用Image J图像分析软件对特异性条带进行吸光度分析。
1.6 统计学处理
2 结 果
2.1 EPC分离、培养、鉴定、标记及其在IRI肾组织的分布
EPC的形态学特征:新获取的大鼠骨髓源性单个核细胞呈圆形,大小不一,胞质透亮,胞核清晰。培养2~3 d后即可良好贴壁,4~8 d时细胞呈三角形、梭形或不规则形,并出现细胞集落,14 d时呈现EPC特有的条索状或铺路石状,细胞形态规则,生长稳定。每代生长时间为4~6 d,待细胞融合到80%进行传代,可获得大量的、稳定的 EPC[7]。
采用倒置荧光显微镜观察培养的EPC,在绿色光的激发下,CM-Dil标记的EPC发出红色荧光,而未标记的EPC未发出红色荧光,提示已成功标记了EPC,标记率接近100%(图1A)。移植组肾组织冰冻切片示:EPC移植后72 h可见CM-Dil阳性细胞弥散分布在肾脏皮髓交界处,发出红色荧光,形态与培养的EPC符合(图1B)。而IRI组和假手术组组未见CM-Dil阳性细胞,提示细胞来源于经股静脉移植入大鼠体内的EPC。
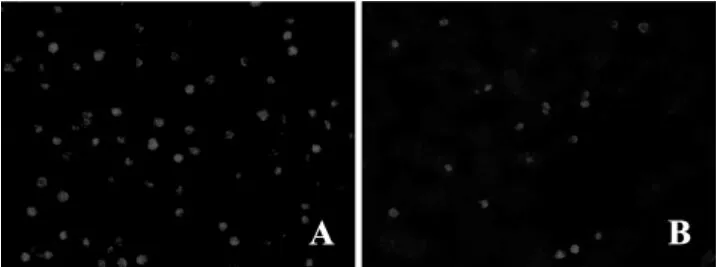
图1 EPC标记和示踪Fig 1 EPC labeling and trace
2.2 EPC对IRI后肾功能的影响
肾 IRI后24 h,EPC 组、IRI组大鼠 BUN、Scr水平较假手术组显著升高;肾IRI后48 h,EPC组、IRI组大鼠BUN、Scr水平仍高于假手术组;且 EPC组大鼠BUN、Scr水平较同一时间点的IRI组均有显著降低,差异均具有统计学意义(P<0.05)。
肾IRI后24 h,移植组与 IRI组比较,BUN:F=11.968,P <0.05;Scr:F=14.269,P <0.05。移植组与假手术组比较,BUN:F=101.128,P<0.01;Scr:F=17.142,P <0.05。肾 IRI后48 h,移植组与 IRI组比较,BUN:F=26.32,P <0.01;Scr:F=14.269,P <0.05。移植组与假手术组比较,BUN:F=15.366,P<0.05;Scr:F=16.651,P <0.05。
2.3 EPC对IRI后肾组织损伤的影响
肾IRI后72 h,HE染色示假手术组肾组织结构正常,IRI组大鼠肾脏病理损伤显著,主要集中于皮髓交界和外髓的近端小管,表现为小管上皮细胞坏死、脱落、空泡变性,刷状缘脱落明显,部分肾小管基膜裸露形成裸膜,管腔中可见脱落的小管上皮细胞,间质水肿,炎症细胞浸润。EPC组亦可见空泡变性,但肾组织损伤程度较对照组明显减轻(图2)。
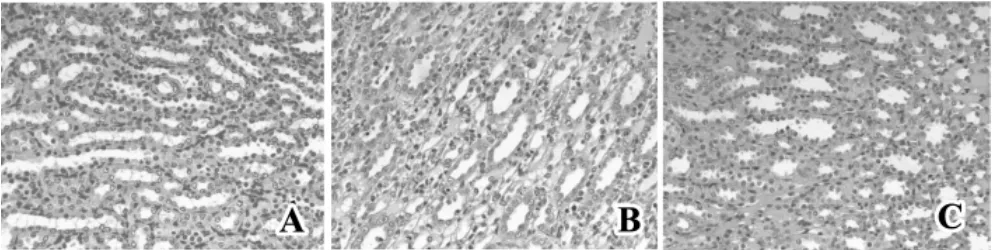
图2 肾组织HE染色Fig 2 HE staining of renal tissue
肾小管损间质伤程度评分:IRI后72 h,EPC组的HSK评分为2.0±0.1,低于 IRI组(3.0±0.2)(H=95.386,P <0.01),高于假手术组(0.5±0.2)(H=26.074,P <0.01)。
2.4 EPC对IRI后肾小管上皮细胞凋亡的影响
肾IRI后72 h,IRI组可见明显的肾小管上皮细胞凋亡(TUNEL阳性),凋亡细胞主要集中在皮髓交界和外髓质,肾小球内凋亡细胞较少。IRI组细胞凋亡指数(29.7±6.7)较IRI组(66±10.5)显著降低(P<0.01),而假手术组几乎未见凋亡细胞(图3、4)。

图3 肾组织凋亡细胞染色Fig 3 Staining of renal tubular epithelial cell apoptosis
2.5 EPC对IRI后VEGF蛋白表达的影响
与假手术组相比,再灌注后72 h EPC组和IRI组VEGF蛋白表达升高,但EPC组表达量显著高于IRI组,差异有统计学意义(P<0.05)(图4、5)。
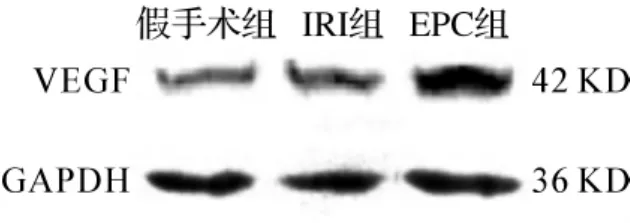
图4 各组大鼠VEGF蛋白表达的比较Fig 4 The effect of EPC transplantation on VEGF by Western blotting analysis
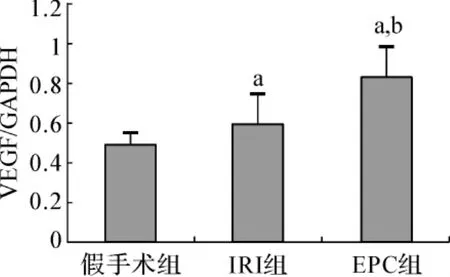
图5 各组大鼠VEGF蛋白表达的比较Fig 5 The effect of EPC transplantation on VEGF by Western blotting analysis
3 讨 论
EPC作为一种定向分化为内皮细胞的骨髓源性干细胞,可对多种器官缺血性损伤产生修复作用[2-3,9],逐渐引起了人们的重视。创伤、缺血、缺氧等因素均可刺激骨髓中EPC向外周血迁移、动员,对损伤的血管内皮产生修复作用[10]。但自身动员的EPC数量较少,不足以修复受损组织[11],因此,EPC的体外扩增和移植为EPC研究的重要手段。
本实验通过体外分离、诱导、纯化、培养EPC并进行外源性移植入肾IRI大鼠,在移植后的24和48 h,EPC组大鼠肾功能相关指标虽高于假手术组,但其损伤程度较IRI组有明显改善,提示EPC移植在肾IRI早期即可发挥保护作用。EPC移植后72 h,移植大鼠肾组织内可见CM-Dil阳性EPC,主要位于肾脏皮髓交界处,而假手术组和IRI组未见CM-Dil阳性细胞,说明EPC能感知肾组织损伤而向损伤部位归巢,对血管内皮产生修复作用,保护受损肾脏。同时,EPC组的HSK评分及病理损伤程度显著低于IRI组,表明移植的EPC可能会启动内源性再生,促进肾小管上皮细胞自身的增殖、分化从而发挥修复作用[12-13]。
本实验还发现,在肾IRI后72 h,损伤肾组织不但存在肾小管空泡变性和细胞坏死脱落,还存在大量的凋亡细胞。凋亡是细胞死亡的特殊类型,与细胞坏死比较,凋亡(尤其是病变的早期)更容易通过药理学途径的干预得到逆转。本实验结果显示,IRI组大鼠的肾小管上皮细胞核TUNEL阳性比例较高,给予EPC移植后,凋亡指数明显降低,提示EPC移植有助于减轻IRI大鼠肾小管上皮细胞的凋亡,阻止肾损害的进展。
细胞凋亡受多种因素的调控,而VEGF是被公认的内皮细胞和上皮细胞凋亡的抑制剂[14]。本实验结果提示,EPC组VEGF含量显著高于IRI组及假手术组,移植的EPC可能通过自分泌/旁分泌作用分泌VEGF等细胞因子,对抗凋亡,这可能是对抗肾小管上皮细胞凋亡的重要因素,但确切的机制尚需进一步探讨。
[1]SCHRIER R W,WANG W,POOLE B,et al.Acute renal failure:definitions,diagnosis,pathogenesis,and therapy[J].J Clin Invest,2004,114(1):5-14.
[2]范国峰,冯毅,童嘉毅.超声联合微泡对内皮祖细胞体外增殖、凋亡及细胞周期的影响[J].东南大学学报:医学版,2009,28(2):109-112.
[3]赵红杰,刘玲,杨毅.骨髓间充质干细胞/内皮祖细胞治疗急性肺损伤的研究进展[J].东南大学学报:医学版,2011,30(3):530-532.
[4]张铁须,周建中.内皮祖细胞与高血压病[J].现代医学,2008,36(2):141-143.
[5]PATSCHAN D,KRUPINCZA K,PATSCHAN S,et al.Dynamics of mobilization and homing of endothelial progenitor cells after acute renal ischemia:modulation by ischemic preconditioning[J].Am J Physiol Renal Physiol,2006,291(1):F176-185.
[6]YANG N,LI D,JIAO P,et al.The characteristics of endothelial progenitor cells derived from mononuclear cells of rat bone marrow in different culture conditions[J].Cytotechnology,2011,63(3):217-226.
[7]曹朴,薛建新,贾瑞鹏,等.内皮祖细胞对大鼠睾丸扭转复位后生精功能的影响[J].中华医学杂志,2011,91(30):2135-2138.
[8]EDALATMANESH M A,BAHRAMI A R,HOSSEINI E,et al.Neuroprotective effects of mesenchymal stem cell transplantation in animal model of cerebellar degeneration[J].Neurol Res,2011,33(9):913-920.
[9]LIU F,LIU Z D,WU N,et al.Transplanted endothelial progenitor cells ameliorate carbon tetrachloride-induced liver cirrhosis in rats[J].Liver Transpl,2009,15(9):1092-1100.
[10]HOHENSTEIN B,KUO M C,ADDABBO F,et al.Enhanced progenitor cell recruitment and endothelial repair after selective endothelial injury of the mouse kidney[J].Am J Physiol Renal Physiol,2010,298(6):F1504-1514.
[11]di MARCO G S,RUSTEMEYER P,BRAND M,et al.Circulating endothelial progenitor cells in kidney transplant patients[J].PLoS One,2011,6(9):e24046.
[12]BASILE D P.Challenges of targeting vascular stability in acute kidney injury[J].Kidney Int,2008,74(3):257-258.
[13]BECHERUCCI F,MAZZINGHI B,RONCONI E,et al.The role of endothelial progenitor cells in acute kidney injury[J].Blood Purif,2009,27(3):261-270.
[14]GALANI V,TATSAKI E,BAI M,et al.The role of apoptosis in the pathophysiology of Acute Respiratory Distress Syndrome(ARDS):an up-to-date cell-specific review[J].Pathol Res Pract,2010,206(3):145-150.
