TGF-β/TβR1通路通过上调MMP2表达促进头颈鳞状细胞癌侵袭
2012-12-25代炜姚远李彦姝张红艳李妍秦兴军
代炜,姚远,李彦姝,张红艳,李妍,秦兴军
(1.中国医科大学口腔医学院口腔颌面外科,口腔颌面-头颈肿瘤外科,辽宁沈阳 110002;2.辽宁省人民医院消化内科,辽宁沈阳 110016;3.中国医科大学细胞生物学教研室,细胞生物学卫生部重点实验室,辽宁沈阳 110001)
转化生长因子β(TGF-β)是诱导侵袭转移的因子,在肿瘤不同时期起到了双重的作用[1]。在肿瘤早期它可作为肿瘤抑制因子,但在肿瘤晚期它可促进肿瘤的形成。TGF-β信号转导的肿瘤抑制功能主要是通过抑制细胞增殖、诱导细胞凋亡和复制衰老[2]来完成。TGF-β信号抗增殖作用依赖于下调c-Myc和上调CDK 抑制剂,如 P15INK4B 和 p21 CIP/WAF1[3-4]。另外,TGF-β信号能够促进上皮间质化(EMT),在肿瘤运动、侵袭和转移过程中发挥重要作用。TGF-β也能够通过活化磷酸肌醇3激酶(PI3K)和Akt通路促进细胞生存[5]。TGF-β在肿瘤细胞中表达增高与预后不良和转移相关。通过结合异源受体复合物1(TβR1)和2(TβR2)来发挥生物学作用。TGF-β诱导异源二聚体的形成,TβR2磷酸化 TβR1。活化的 TβR1通过磷酸化Smads受体(R-Smads)如Smad2和Smad3来激起细胞内的典型的信号通路。这些活化的R-Smads与Smad4形成了异源复合物,Smad4在核内富集调节靶基因的转录[6-7]。
TGF-β的作用依赖于上下通路的激活,目前TGF-β/TβR1通路对人头颈鳞状细胞癌侵袭的影响还是不清楚。我们构建了稳定表达 TGF-β1受体 TβR1的UM-SCC-23鳞状细胞癌细胞系,发现基质金属蛋白酶2(MMP2)的表达明显上调。MMPs是细胞外基质降解酶,在炎症和血管生成中起到至关重要的作用。MMP2(也叫2型胶原酶或明胶酶A)是调节侵袭及肿瘤生长和转移的重要因子。
1 材料与方法
1.1 材料
1.1.1 细胞株与载体 UM-SCC-23细胞株为本实验室保存,pcDNA3.1-His-TβR1真核表达载体为本实验室构建,载体上含有Neomycin阻抗基因,能够被G418筛选。
1.1.2 试剂 RNA提取试剂Trizol(Invitrogen);逆转录和 Real-time PCR试剂盒(TaKaRa);引物合成(Invitrogen);TβR1抗体(cell signaling);二抗(北京中杉金桥生物技术有限公司);DMEM培养基和血清(Hyclone)。
1.2 方法
1.2.1 稳转细胞系构建 将pcDNA3.1对照载体和pcDNA3.1-TβR1融合载体用 Lipofectamine 2000TM瞬时转染UM-SCC-23,操作步骤按照Invitrogen公司说明书进行。转染48 h后,用G418筛选10 d,待细胞形成单克隆后,挑取单克隆细胞到24孔板中,继续用G418进行筛选。用蛋白质印迹法筛选稳定表达TβR1的细胞。
1.2.2 RNA提取和Real-time PCR检测 利用Trizol从稳定表达pcDNA3.1和pcDNA3.1-His-TβR1载体的UM-SCC-23细胞中提取总RNA,操作步骤按照Invitrogen公司Trizol说明书进行。Real-time PCR按照TaKaRa公司的SYBR green试剂操作说明进行。Primer Premier 5.0生物分析软件设计MMP2(BC002576.2)引物,MMP2引物序列为上游5'-TGGCAAGGAGTACA ACAGC-3';下 游 5'-TGGAAGCGGAATGGAAAC-3'。GAPDH(NM_001256799.1)作为内参校正组间误差。GAPDH上游5'-GACCTGACCTGCCGTCTA-3';下游5'-AGGAGTGGGTGTCGCTGT-3'。
1.2.3 蛋白质的提取与蛋白质印迹法检测MMP2表达 细胞中加入50 μl含有蛋白酶抑制剂的RIPA裂解液,冰上孵育20 min,将细胞裂解液13 000×g,4℃离心30 min。取上清液到新的离心管中,5 μl进行定量。将蛋白定量后,取 20 μg总蛋白经 10%SDSPAGE凝胶分离,4℃过夜恒压转移至PVDF膜上,5%脱脂奶粉封闭3 h,TBST洗膜15 min,3次。加入anti-MMP2抗体(1∶2 000稀释),TBST 洗膜15 min,3次。再用辣根过氧化物酶标记的山羊抗兔(1∶5 000稀释,北京中杉金桥生物技术有限公司)孵育2 h,TBST洗膜15 min,3次。ECL显色,压片。将膜上抗体脱掉后,重新封闭,加入内参抗体β-actin抗体(1∶6 000,北京中杉金桥生物技术有限公司)作为对照[8-9]。
1.2.4 细胞侵袭性实验 基质胶侵袭试验是在有聚碳酸酯核孔膜的改良boyden小室中进行。铺胶滤膜(直径6.5 mm,核孔为 8 μm,基底膜 100 μg·cm-2)用100 μl的培养基进行水化。在上层小室中加入100 μl含0.1%牛血清白蛋白的DMEM培养基,下层放入600 μl含有10%血清的DMEM培养基。在37℃培养箱中培养18 h,非侵袭细胞用棉签从上层表面移走。侵袭细胞在下层被固定,染色,照相,封片,并进行计数。
2 结 果
2.1 成功构建稳定表达TβR1的 UM-SCC-23细胞系
pcDNA3.1为稳定转染对照空载体,TβR1 1~3#为3个不同的稳转克隆,2#克隆表达TβR1蛋白明显升高,而1#和3#克隆TβR1蛋白略有增高表达。用GAPDH做为内参,检测上样总量一致。见图1。
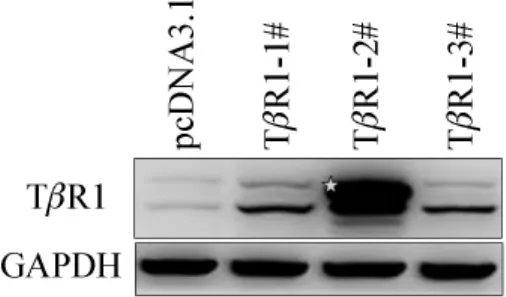
图1 蛋白质印迹法检测稳转细胞系TβR1蛋白表达Fig 1 Western blotting analysis shows the protein level of TβR1 in control vector(pcDNA3.1)and TβR1 stable cell lines
2.2 TβR1上调MMP2基因表达
将稳定表达pcDNA3.1空对照和稳定表达TβR1(1~3#)的UM-SCC-23细胞系提取总RNA、反转录,利用MMP2特异性引物进行Real-time PCR检测MMP2基因水平变化,当TβR1-2#过表达时,MMP2表达也明显增强(图2)。

图2 Real-time PCR检测稳转细胞系中MMP2基因表达Fig 2 Real-time PCR analysis shows the gene expression of MMP2 in control vector(pcDNA3.1)and TβR1 stable cell lines
2.3 TβR1上调MMP2蛋白表达
将稳定表达pcDNA3.1空对照和稳定表达TβR1(1~3#)的UM-SCC-23细胞系提取总蛋白,进行SDSPAGE和蛋白质印迹法检测MMP2蛋白水平变化,当TβR1-2#过表达 TβR1时,MMP2蛋白表达明显增强(图3)。

图3 蛋白质印迹法检测稳转细胞系中MMP2基因表达Fig 3 Western blotting analysis shows the protein level of MMP2 in control vector(pcDNA3.1)and TβR1 stable cell lines
2.4 TGF-β/TβR1通路促进头颈肿瘤细胞的侵袭
利用Boyden小室铺胶实验证实,稳定表达TβR1的UM-SCC-23细胞系与稳定表达空载体的细胞系相比较侵袭能力明显增强。
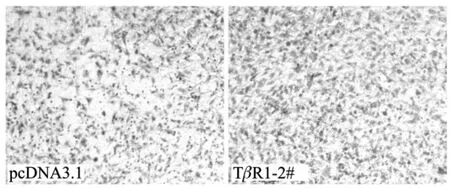
图4 TGF-β/TβR1通路促进头颈鳞状细胞癌的侵袭Fig 4 TGF-β/TβR1 promotes invasion of human head and neck squamous cell carcinoma cells
3 讨 论
TGF-β信号通路在发育和疾病中发挥了重要的作用。TGF-β能够启动细胞表面的受体TβR1和TβR2的信号通路。TβR1磷酸化R-Smad是作为Smad活化的重要步骤,需要受体与Smads之间发生直接的相互作用。TβR1在L45环区域与R-Smads的L3环区域特异性的结合区[10-11]。
MMPs是一类需要锌离子进行催化作用的分泌蛋白酶,能够分泌到细胞外基质作为酶原的催化物,能够被多种组织抑制物(TIMP)抑制活性[12]。根据它们的底物特异性和结构相似性可分为多种亚类:(1)间质胶原酶;(2)明胶;(3)基质降解酶;(4)MT-MMPs。MMPs能够通过多种机制调节侵袭,包括通过肿瘤细胞生产酶,在邻近基质、内皮细胞和炎症细胞中诱导MMPs生产,这些细胞之间的相互作用也能够诱导MMPs生产[13]。R-Smads 能够 被 MAPKs、CDK2/4、GSK-3β和ROCK等激酶所磷酸化。
本研究首先将TGF-β的受体TβR1稳定表达于UM-SCC-23头颈鳞状细胞癌中,利用蛋白质印迹法验证了TβR1-2#成功过表达了TβR1蛋白,这也为我们激活TGF-β/TβR1通路打下了基础。提取稳转了pcDNA3.1和TβR1-(1~3#)的UM-SCC-23细胞系的总RNA进行反转录,用特异引物扩增MMP2基因,结果显示在TβR1-2#细胞系中MMP2基因表达明显增高。另外,我们也检测了稳转细胞系的蛋白表达,在TβR1-2#细胞系中MMP2蛋白表达增高。由于MMP2在肿瘤细胞中能够促进侵袭[14],我们利用稳转细胞系进行了细胞侵袭实验,稳定转染了TβR1-2#细胞系与对照组相比侵袭性明显增强。
总之,TGF-β/TβR1通路能够上调MMP2表达,促进头颈鳞状细胞癌侵袭能力增强,导致肿瘤转移。我们的实验为进一步探索临床头颈肿瘤的转移侵袭机制提出了新的理论依据,为探索TGF-β/TβR1的信号转导通路及与肿瘤转移的关系奠定了理论基础。
[1]MASSAGUE J.TGFbeta in cancer[J].Cell,2008,134:215-230.
[2] JAKOWLEW S B.Transforming growth factor-beta in cancer and metastasis[J].Cancer Metastasis Rev,2006,25:435-457.
[3]WARNER B J,BLAIN S W,SEOANE J,et al.Myc downregulation by transforming growth factor beta required for activation of the p15(Ink4b)G(1)arrest pathway[J].Mol Cell Biol,1999,19:5913-5922.
[4]LI C Y,SUARDET L,LITTLE J B.Potential role of WAF1/Cip1/p21 as a mediator of TGF-beta cytoinhibitory effect[J].J Biol Chem,1995,270:4971-4974.
[5]MURAOKA-COOK R S,SHIN I,YI J Y,et al.Activated type I TGFbeta receptor kinase enhances the survival of mammary epithelial cells and accelerates tumor progression[J].Oncogene,2006,25:3408-3423.
[6]ten DIJKE P,HILL C S.New insights into TGF-beta-Smad signalling[J].Trends Biochem Sci,2004,29:265-273.
[7]MOUSTAKAS A,HELDIN C H.The regulation of TGFbeta signal transduction[J].Development,2009,136:3699-3714.
[8]姚远,李艳,赵鸿梅.MTA1在胃癌细胞系和胃癌组织中的表达定位以及临床意义[J].东南大学学报:医学版,2012,31(2):158-161.
[9]张红艳,李彦姝,姚远,等.pGEX-5X-1-hLMO4原核质粒构建及重组蛋白表达[J].东南大学学报:医学版,2012,31(2):139-143.
[10]SCHMIERER B,HILL C S.TGFbeta-SMAD signal transduction:molecular specificity and functional flexibility[J].Nat Rev Mol Cell Biol,2007,8:970-982.
[11]SHI Y,MASSAGUE J.Mechanisms of TGF-beta signaling from cell membrane to the nucleus[J].Cell,2003,113:685-700.
[12]BRINCKERHOFF C E,RUTTER J L,BENBOW U.Interstitial collagenases as markers of tumor progression[J].Clin Cancer Res,2000,6:4823-4830.
[13]DUNNE A A,SESTERHENN A,GERISCH A,et al.Expression of MMP-2,-9 and-13 in cell lines and fresh biopsies of squamous cell carcinomas of the upper aerodigestive tract[J].Anticancer Res,2003,23:2233-2239.
[14]张天彪,许丹,关一夫.RECK和MMP-2在口腔鳞癌中的表达及其与侵袭转移关系研究[J].中国实用口腔科杂志,2010,3(5):292-294.
