转录因子GATA-1 与人巨细胞病毒UL111A 基因5'上游序列结合的实验研究*
2012-12-23田可港郑晓群徐志伟宋建华吕建新
田可港, 浮 苗, 高 艳, 彭 颖, 李 祥, 郑晓群△, 徐志伟, 宋建华, 吕建新
(1温州医学院附属第二医院实验诊断中心,浙江 温州325027;2温州医学院浙江省医学遗传学重点实验室,浙江 温州325035;3俄克拉荷马医学研究中心,美国 俄克拉荷马73104)
人巨细胞病毒(human cytomegalovirus,HCMV)是疱疹病毒科属的DNA 病毒,具有严格的种属特异性。1960 年,Weller 等鉴于病毒感染细胞后所呈现细胞明显增大的特征及该病毒在巨细胞包涵体病中的作用,将该病毒命名为巨细胞病毒。1973 年,国际病毒命名委员会(ICNV)疱疹病毒组将此病毒正式命名为人类疱疹病毒5 型(human herpes virus 5,HHV- 5)。在免疫正常个体,HCMV 的初发感染常无症状,当宿主免疫功能不全或免疫功能减弱时,HCMV 的原发感染或潜伏再激活感染会引起严重的乃至威胁生命的疾病[1-2]。cmvIL - 10 是HCMV UL111A 基因编码的由175 个氨基酸组成的蛋白质,功能与人IL -10(hIL -10)类似。既往研究表明,HCMV 潜伏感染时,UL111A 基因不表达cmvIL -10,激活感染时表达cmvIL -10[3-6]。因此我们推测,cmvIL-10 可能参与HCMV 潜伏及再激活感染的过程。人转录因子GATA -1 由413 个氨基酸组成,含2 个锌指结构,即C -锌指和N -锌指,可通过与基因启动子中的(A/T)GATA(A/G)模序结合激活基因转录。本研究通过染色质免疫沉淀(chromatin immunoprecipitation,ChIP)方法研究转录因子GATA-1 与UL111A 基因5'上游DNA 序列的相互作用,探讨二者在HCMV 潜伏及再激活感染中可能发挥的作用。
材 料 和 方 法
1 主要材料
HCMV AD169 株购自中国典型培养物保藏中心,人白血病单核细胞(THP-1 细胞)购于中科院上海细胞库,GATA -1 兔抗人抗体购于Abcam,TaKa-Ra 公司合成PCR 引物,ChIP 试剂盒购自Upstate,细胞核蛋白提取试剂盒购自碧云天生物技术研究所。
2 HCMV 潜伏感染和激活感染细胞模型建立及分组
2.1 细胞感染模型建立 THP -1 细胞于Gibco 常规RPMI-1640 培养液,10%特级胎牛血清,1 ×105U/L 青霉素,100 mg/L 链霉素,置于37 ℃、5%CO2培养箱中培养。HCMV AD169 株以感染复数(multiplicity of infection,MOI)=1 感染THP -1 细胞(1 ×109/L)。100 μg/L 12 -肉豆蒄酸-13 -乙酸佛波酯(phorbol 12 -myristate 13 -acetate,PMA)刺激HCMV 潜伏感染的THP -1 细胞,细胞置于37 ℃、5%CO2饱和湿度培养箱中培养12 h、24 h、48 h、72 h 和96 h 后,分别提取细胞总RNA,RT -PCR 检测HCMV UL123 基因和UL82 基因的表达。UL123 基因表达调节蛋白IE,设计上游引物序列为5'-CAAGAG AAAGATGGACCCTG - 3',下游引物序列为5' -CGAGTTCTGCCAGGACATC - 3',目的扩增片段为242 bp;UL82 基因表达被膜蛋白pp65,设计上游引物序列为5'-TGCCCTGGATGCGATACTG -3',下游序列引物为5'-AGGACCTGACGATGACCCG -3',目的扩增片段为378 bp,委托上海捷瑞生物工程有限公司合成。PCR 扩增条件:94 ℃预变性5 min,94 ℃30 s,55 ℃30 s,72 ℃30 s,35 个循环后72 ℃10 min,扩增产物用1.5%的琼脂糖凝胶进行电泳。同时,实时荧光定量PCR 检测细胞内HCMV DNA 载量,透射电镜观察THP-1 细胞内病毒颗粒。根据上述指标,综合判断病毒感染状态。
2.2 实验分组 HCMV AD169 株以MOI =1 感染THP-1 细胞(1 ×109/L),37 ℃、5%CO2培养箱中培养96 h 后作为潜伏感染组;100 μg/L PMA 刺激HCMV 潜伏感染的THP -1 细胞,37 ℃、5%CO2培养箱中培养96 h 后作为激活感染组;对照组加入相同量的DMEM 培养液,37 ℃、5%CO2培养箱中培养96 h。
3 RT-PCR 分析HCMV 潜伏及再激活感染时cmvIL-10 的表达
Trizol 法提取HCMV 潜伏及再激活感染96 h 后细胞总RNA,并逆转录为cDNA。应用Primer Premier 5.0 软件设计cmvIL - 10 及内参照GAPDH 的PCR 引物,cmvIL - 10 上游引物5' - GGGGAATTCATGCTGTCGGTGATGGTCT - 3',下游引物5' -ACATTGCCGCATGTCTTTG-3',目的扩增片段为381 bp;GAPDH 上游引物5' - GAGTCAACGGATTTGGTCGT - 3',下游引物5' - GAGTCAACGGATTTGGTCGT-3',目的扩增片段为185 bp。PCR 扩增条件:94 ℃预变性5 min,94 ℃30 s,56 ℃30 s,72 ℃30 s,35 个循环后72 ℃10 min,扩增产物用1.5%的琼脂糖凝胶进行电泳。
4 Western blotting 检测转录因子GATA-1 的表达
利用细胞核蛋白提取试剂盒提取对照组,HCMV潜伏感染组和激活感染组核蛋白,然后进行Western blotting 检测,利用ImageJ 软件分析条带的灰度值,目的条带与内参照条带灰度值的比值表示GATA-1的相对表达量。
5 HCMV UL111A 5’上游序列GATA-1 结合部位的生物信息学预测分析
应用TRANSFAC 数据库中的MATCH 工具对HCMV UL111A 5’上游序列转录因子GATA-1 结合位点进行预测,采用TRANSFAC Professional 9.4 库中的单核苷酸加权模型集对每个位点进行打分,通过每个位点所得分数(0 ~1)来确定转录因子结合情况,从中选出转录因子GATA -1 对应的结合位点,见表1,并设计合成相应的ChIP-PCR 引物,见表2。GATA - 1 结合序列预测分析和引物设计时选用HCMV AD169 株全基因序列RefSeq FJ527563. 1,HCMV UL111A 5’上游序列碱基起止位为155 755 ~160 632。
6 ChIP-PCR 试验
采用Upstate 公司的ChIP 试剂盒处理HCMV 潜伏与激活感染组细胞,操作步骤如下:加入37%甲醛体外交联和裂解细胞DNA,超声处理(功率500W,超声7s,停10s,重复3 次)DNA,使交联的DNA/蛋白质共沉淀,洗脱DNA/蛋白质复合物,解交联,纯化DNA。在交联的DNA/蛋白质共沉淀过程中,分为input 和IP 组,input 组不加入GATA -1 抗体,IP 组加入GATA-1 抗体。严格按照ChIP 试剂盒说明书操作。

表1 转录因子GATA-1 结合位点的预测结果Table 1. The predicted results of binding sites of transcription factor GATA-1

表2 GATA-1 的预测结合位点设计的引物Table 2. The primers based on the predicted binding sites of transcription factor GATA-1
将各组得到的DNA 产物分别加入上述引物进行PCR 扩增,反应体系如下:10 ×Ex Taq buffer 2.5 μL,2. 5 mmol/L dNTP 2. 5 μL,25 mmol/L MgCl22 μL,20 μmol/L 上、下游引物各0.5 μL,DNA 2 μL,5 U/μL Taq 酶0.125 μL,加ddH2O 至25 μL。反应条件如下:94 ℃预变性5 min,继而94 ℃30 s,52 ℃30 s,72 ℃30 s,35 个循环后72 ℃10 min,扩增产物用1.5% 的琼脂糖凝胶进行电泳。实时荧光定量PCR 反应体系如下:SYBR Premix Ex TaqTM(2 ×)10 μL,20 μmol/L 上、下游引物0. 4 μL,DNA 2 μL,ROX Reference Dye 0.2 μL,加ddH2O 至20 μL。反应条件:94 ℃预变性5 min,继而94 ℃30 s,52 ℃30 s,72 ℃30 s,35 个循环后72 ℃10 min,AB7500荧光定量PCR 仪检测。以-ΔCt 值来表示HCMV 潜伏与激活感染时转录因子GATA-1 与UL111A 5’上游各位点的结合率,ΔCt 为IP 组与input 组的Ct 差值(CtIP-Ctinput)。
7 统计学处理
数据采用SPSS 18.0 统计学软件进行分析,计量资料以均数±标准差(±s)表示,两组间均数比较采用两样本t 检验,多组数据采用方差分析,以P <0. 05 为差异有统计学意义。
结 果
1 HCMV 潜伏及再激活感染细胞模型的建立
1.1 HCMV 潜伏感染细胞模型的建立 HCMV AD169 株感染THP -1 细胞96 h 后,透射电镜观察发现细胞内有病毒颗粒,见图1。HCMV UL123 基因PCR 扩增片段为242 bp,表达量随着时间的增加逐渐减少;未检测到HCMV UL82 基因的表达,见图2。

Figure 1. Electron micrographs of HCMV - infected THP - 1 cells (×50 000).The arrows indicate the viral particles.图1 HCMV 感染THP-1 细胞电镜图

Figure 2. The expression of HCMV UL82 and UL123 genes in HCMV-infected THP-1 cells.M:DL2000 marker.图2 HCMV 感染THP-1 细胞96、72、48、24 及12 h 后UL123 和UL82 基因的表达
1.2 HCMV 再激活感染细胞模型的建立 PMA 刺激HCMV 潜伏感染细胞96 h 后,悬浮生长的THP -1 细胞转为贴壁生长,电镜观察细胞内出现较多病毒颗粒,见图3。HCMV UL123 基因表达量先随着时间的增加而增加,后逐渐减少,UL82 基因PCR 扩增片段为378 bp,96 h 时检测到表达,见图4。

Figure 3. Electron micrograph of an HCMV -latently -infected cell stimulated by PMA(×30 000). The arrows indicate the viral particles.图3 PMA 刺激HCMV 潜伏感染细胞电镜图

Figure 4. The expression of HCMV UL123 and UL82 genes in HCMV - reactivatedly - infected cells. M:100 bp DNA ladder marker.图4 HCMV 再激活感染THP-1 细胞96、72、48、24 及12 h后UL123 和UL82 基因表达
2 HCMV 潜伏与再激活感染时UL111A 的表达
HCMV 潜伏感染时,RT-PCR 未扩增出UL111A基因表达的cmvIL-10,再激活感染时表达cmvIL -10,扩增片段为381 bp,见图5。
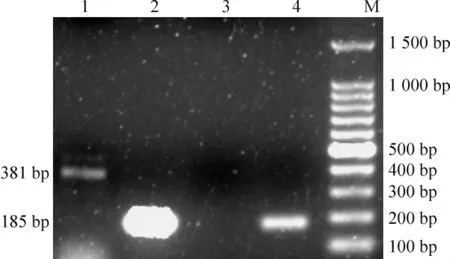
Figure 5. RT - PCR amplification results of cmvIL -10. 1,3:HCMV reactivated and latent infection,respectively;2,4:GAPDH;M:100 bp DNA ladder marker图5 cmvIL-10 mRNA RT-PCR 扩增结果
3 Western blotting 分析HCMV 潜伏及再激活感染时转录因子GATA-1 的表达
HCMV 潜伏及再激活感染后,分别提取感染的细胞核内蛋白进行Western blotting 检测,HCMV 潜伏与激活感染后均检测到转录因子GATA -1 表达,见图6。同时,HCMV 潜伏感染组转录因子GATA -1 的相对表达量(1. 13 ± 0. 08)高于激活感染组(0.51 ±0.11),差异有统计学意义(P <0.05)。
4 HCMV 潜伏及再激活感染时ChIP 结果分析
以input 组和IP 组DNA 为模板,用预测的结合位点所设计的9 对引物进行PCR 扩增,结果显示5对引物(GATA -12 引物、GATA -21 引物、GATA -22 引物、GATA-23 引物和GATA -26 引物)均扩增出目的条带,扩增片段分别为202 bp、208 bp、250 bp、245 bp 和198 bp,见图7、8,其对应的转录因子GATA-1 结合位点分别是1119(-3760)位点、107(-4772)位点、609(-4270)位点、849(-4030)位点和2047(-2832)位点,见图9。前面位点为分析获得,括号内位点为根据规定算得。

Figure 6. The expression of transcription factor GATA-1 in HCMV latent and reactivated infection.1:control group;2:HCMV latent infection group;3:HCMV reactivated infection group. ±s. n =3. * P <0.05 vs HCMV latent infection group.图6 Western blotting 分析HCMV 潜伏及再激活感染时转录因子GATA-1 表达
用上述5 对引物进行荧光定量PCR,结果显示HCMV 再激活感染组转录因子GATA -1 与UL111A基因5’端上游序列5 个位点的结合率(-1.13 ±0.07、-0.63 ±0.05、-1.10 ±0.07、-0.24 ±0.03和-0. 14 ± 0. 01)均高于潜伏感染组(- 4. 00 ±0.26、-4.50 ±0.33、-4.41 ±0.21、-3.61 ±0.20和-3.47 ±0.11)。经两样本t 检验,5 个结合位点转录因子GATA -1 的结合率差异均有统计学意义(P <0.05),见图10。
讨 论

Figure 7. PCR product electrophoresis of HCMV latent infection after ChIP.A and B was input group and antibody treatment group,respectively.1:negative control group;2 ~6:amplified products of 1119(-3760)site,107(-4772)site,609(-4270)site,849(-4030)site and 2047(-2832)site,respectively;M:100 bp DNA ladder marker.图7 HCMV 潜伏感染时ChIP 处理后PCR 产物电泳图

Figure 8. PCR product electrophoresis of HCMV reactivated infection after ChIP. A and B was input group and antibody treatment group,respectively.1:negative control group;2 ~6:amplified products of 1119(-3760)site,107(-4772)site,609(-4270)site,849(-4030)site and 2047(-2832)site,respectively;M:100 bp DNA ladder marker.图8 HCMV 激活感染时ChIP 处理后PCR 产物电泳图

Figure 9. The binding sites of transcription factor GATA-1 on 5 'upstream DNA sequence of UL111A gene.图9 HCMV UL111A 基因5’端上游核酸序列转录因子GATA-1 的结合位点

Figure 10. Comparison of transcription factor GATA -1 binding rates in latent and reactivated infection.1 ~5:1119(-3760)site,107(-4772)site,609(-4270)site,849(-4030)site and 2047(-2832)site,respectively. ±s.n=3. * P <0.05 vs HCMV latent infection.图10 HCMV 潜伏及再激活感染时转录因子GATA-1 结合率的比较
目前认为,单核细胞和髓系早期细胞是HCMV潜伏感染的主要细胞,一旦分化为巨噬细胞或树突状细胞,病毒的早期基因表达就会被激活,HCMV 可由潜伏感染向再激活转化[7-10]。然而,HCMV 病毒由潜伏状态向再激活转化的机制还缺乏更深入的研究。HCMV 具有高度种属特异性,不能用动物模型对其直接进行研究;在健康携带者的外周血和骨髓细胞中,被潜伏感染的细胞所占的比例很少,仅为0.004% ~0.010%,且在每个被潜伏感染的细胞中约含有2 ~13 个病毒基因组DNA,难以满足当前研究的需求。虽然有很多针对CMV 的模型,由于HCMV具有高度的种属特异性,针对CMV 的模型不能用于HCMV 的研究。因此,我们参考国内外的研究建立了HCMV 潜伏及再激活感染的THP-1 细胞模型。
HCMV 潜伏感染时,UL111A 基因不表达cmvIL-10,激活感染时表达cmvIL -10。我们对UL111A 5’端上游约5.0 kb 的序列进行了生物信息学分析,发现其中交错分布着转录因子GATA -1 的结合位点,由此推测转录因子GATA -1 可能参与了HCMV潜伏及再激活感染过程。本研究中,我们证实了HCMV 潜伏感染时,UL111A 基因不表达cmvIL -10,激活感染时表达。同时,Western blotting 分析结果表明HCMV 潜伏感染时转录因子GATA -1 的表达量高于再激活感染时,这可能与GATA -1 抑制单核细胞的分化有关。
染色质免疫沉淀[11]是体内研究蛋白质与DNA相互作用强有力的方法,此方法不需要分别提取核酸或蛋白,在天然的染色质环境下进行,基本保持了二者在细胞内的真实结合状态。本实验中,通过GATA-1 抗体,特异性将超声打断的DNA -GATA-1 复合物小片段免疫沉淀,并纯化解交联,获得GATA-1 结合的DNA 片段,对纯化获得的DNA 片段进行PCR 扩增鉴定。结果表明,转录因子GATA-1 可与UL111A 5’端上游序列107(-4772)位点、609 (- 4270)位点、849 (- 4030)位点、1119(-3760)位点和2047(-2832)位点共5 个位点结合,且激活感染时转录因子GATA-1 的结合率高于潜伏感染。我们推测HCMV 激活感染后转录因子GATA-1 可能通过与UL111A 基因5’上游序列结合位点的结合,启动cmvIL-10 的转录,参与HCMV 再激活感染的过程。本文研究结果仅是初步的探索性结果,应做进一步的验证性研究,如用报告基因技术等。更深入地研究GATA -1 如何与UL111A 基因5’上游序列潜在结合位点作用,不同位点的缺失是否影响GATA-1 的调控功能,哪个位点是GATA-1的关键结合区域,是否存在其它的核转录因子或共调控蛋白作用这些区域?相信随着这些问题的逐步阐明,将有利于更全面地理解在转录水平HCMV 潜伏及再激活感染的调控机制。
[1] Rawlinson W,Scott G. Cytomegalovirus:a common virus causing serious disease[J]. Aust Fam Physician,2003,32(10):789 -793.
[2] 季育华. 移植领域中人巨细胞病毒感染的关注点与对策[J]. 中华器官移植杂志,2008,29(3):188 -189.
[3] Jenkins C,Garcia W,Abendroth A,et al. Expression of a human cytomegalovirus latency - associated homolog of interleukin -10 during the productive phase of infection[J].Virology,2008,370(2):285 -294.
[4] Chang WL,Baumgarth N,Yu D,et al. Human cytomegalovirus -encoded interleukin-10 homolog inhibits maturation of dendritic cells and alters their functionality[J]. J Virol,2004,78(16):8720 -8731.
[5] Jenkins C,Garcial W,Godwin MJ,et al. Immunomodulatory properties of a viral homolog of human interleukin-10 expressed by human cytomegalovirus during the latent phase of infection[J]. J Virol,2008,82(7):3736-3750.
[6] Spencer JV,Cadaoas J,Castillo PR,et al. Stimulation of B lymphocytes by cmvIL-10 but not LAcmvIL -10[J].Virology,2008,374(1):164 -169.
[7] Sinclair J,Sissons P. Latency and reactivation of human cytomegalovirus[J].J Gen Virol,2006,87(Pt 7):1763-1779.
[8] Ioudinkova E,Arcangeletti MC,Rynditch A,et al. Control of human cytomegalovirus gene expression by differential histone modifications during lytic and latent infection of a monocytic cell line[J]. Gene,2006,384(1):120 -128.
[9] Reeves M,Murphy J,Greaves R,et al. Autorepression of the human cytomegalovirus major immediate - early promoter/enhancer at late times of infection is mediated by the recruitment of chromatin remodeling enzymes by IE86[J]. J Virol,2006,80(20):9998 -10009.
[10] Sinclair J. Human cytomegalovirus:latency and reactivation in the myeloid lineage[J]. J Clin Virol,2008,41(3):180 -185.
[11] Wyrick JJ,Young RA. Deciphering gene expression regulatory networks[J]. Curr Opin Genet Dev,2002,12(2):130 -136.
