靶向COL1A1 基因的shRNA 对人乳腺癌MDA-MB-231 细胞增殖与凋亡的影响*
2012-12-23余海浪刘安玲周珏宇郑文岭马文丽
余海浪, 刘安玲, 周珏宇, 孟 伟, 郑文岭, 马文丽△
(1南方医科大学基因工程研究所,广东 广州510515;2华南基因组研究中心,广东 广州510800)
乳腺癌是女性最常见的恶性肿瘤,远处转移已 成为乳腺癌患者死亡的主要原因。Ⅰ型胶原α1 链(collagen type I alpha 1,COL1A1)是细胞外基质(extracellular matrix,ECM)的重要组成成分,对细胞的黏附和分化有重要作用,研究发现,COL1A1 基因在乳腺导管癌和乳腺小叶癌中均有不同程度的高表达,并且可能与乳腺癌的发生和转移存在一定相关性[1-2]。RNA 干扰(RNA interference,RNAi)是一种由双链RNA(dsRNA)介导的基因表达抑制途径,具有高效性、高稳定性和高特异性的优点[3-4],近来已经在功能基因组学研究和基因治疗方面取得了巨大进展[5-7]。本研究利用靶向COL1A1 的特异性siRNA 真核表达载体pshRNA-COL1A1,瞬时转染人乳腺癌细胞MDA -MB -231,探讨pshRNA -COL1A1重组质粒对细胞体外增殖及凋亡的影响。
材 料 和 方 法
1 材料
人乳腺癌细胞系MDA -MB -231 由本研究所保存;pSilencer2.1 - U6 - COL1A1(以下简称pshRNA-COL1A1)重组质粒由本实验室前期构建;LipofectamineTM2000 购自Invitrogen;胎牛血清购自杭州四季青公司;RPMI -1640 培养基购自Gibco;MTT、Hoechst 33258 和PI 均购自Sigma;PrimeScript RT reagent Kit 购自TaKaRa;COL1A1 鼠抗人多克隆抗体、兔抗人β-actin 单克隆抗体购自Santa Cruz;HRP 标记的羊抗鼠IgG 和HRP 标记的羊抗兔IgG 购自北京中山公司;Annexin V-FITC 细胞凋亡检测试剂盒购自南京凯基生物技术有限公司。
2 方法
2.1 细胞培养 MDA-MB-231 细胞用含10%胎牛血清、无抗生素的RPMI -1640 培养基、37 ℃、5%CO2条件下培养。观察细胞生长情况,每2 ~3 d 用胰酶消化,传代培养。
2.2 重组质粒转染 当贴壁细胞汇合达90% ~95%,用无血清培养基洗3 次,将细胞分为脂质体对照组(mock)、空载体组(empty vector)、阴性对照组(scrambled)及重组质粒处理组(pshRNA -COL1A1)。参照LipofectamineTM2000 转染试剂说明书操作,72 h 后收集细胞分别用蛋白裂解液及Trizol试剂提取总蛋白及总RNA 备用。
2.3 半定量RT -PCR 检测COL1A1 mRNA 表达水平 取上述总RNA 进行逆转录,PCR 扩增COL1A1和内参照β-actin。COL1A1 引物序列:正义链5’-CGATGGATTCCAGTTCGAGT - 3’,反义链5’-TTTTGAGGGGGTTCAGTTTG-3’,扩增片段长度496 bp;反应条件:94 ℃30 s,60 ℃30 s,72 ℃60 s,30个循环后,72 ℃5 min。
2.4 Western blotting 检测COL1A1 蛋白表达水平
取上述总蛋白进行SDS - PAGE 凝胶电泳,转膜后NC 膜依 次 与COL1A1 Ⅰ抗(1 ∶200)、β - actin(1∶1 000)、羊抗鼠IgG/HRP 及羊抗兔IgG/HRP 孵育,常规曝光,显影定影,直至显示出电泳带,用凝胶扫描成像系统进行半定量分析。
2.5 MTT 检测细胞增殖 取对数生长期的各组细胞,用含10%胎牛血清的RPMI -1640 制成细胞悬液,以每孔1 ×104个细胞接种于96 孔培养板中培养,分别在24 h、48 h、72 h、96 h、120 h、144 h 和168 h 后,每孔加入5 g/L MTT 溶液20 μL,振荡混匀,避光状态下37 ℃、5%CO2培养箱中继续孵育4 h,终止培养;弃孔内培养上清液后,每孔加入150 μL DMSO,振荡10 min 溶解结晶。酶标仪检测570 nm 波长吸光度A 值,每组5 个复孔,实验重复3 次。
2.6 流式细胞术检测细胞周期 取对数生长期的各组细胞,用PBS 制成单个细胞悬液;加预冷的75%乙醇,快速混匀,4 ℃固定1 h;PBS 洗涤3 次,每次加PBS 2.5 mL,1 000 r/min 离心5 min;调整细胞浓度,每份样品细胞数目约为5 ×105;加入50 μL RNase(10 mg/L)和200 μL PI(5 mg/L),室温下避光染色30 min;检测前,细胞经300 目滤网过滤;流式细胞仪进行细胞周期检测,用Cell Quest 软件收取细胞(每份样品至少取1 ×104个细胞),并分析细胞周期,结果以细胞周期各时相细胞的百分率表示。
2.7 细胞凋亡的形态学观察( Hoechst 33258 染色)
收集处理组细胞及对照组细胞(1 ×109/L),均匀滴至载波片上并用滤纸吸去多余液体,干燥。滴加50%固定液(3∶1 甲醇/乙酸)固定15 min,用PBS 洗2 次,室温下再用1 mg/L Hoechst 33258 染液避光染色10 min,再用PBS 洗2 次。染色后的细胞在激发波长348 nm/发射波长480 nm 的紫外荧光显微镜下观察。
2.8 流式细胞术检测细胞凋亡( Annexin V -FITC/PI 染色法) 取对数生长期的各组细胞,用PBS 制成单个细胞悬液;PBS 洗涤3 次,每次加PBS 2. 5 mL,1 000 r/min 离心5 min;调整细胞浓度,约取5 ×105个细胞重悬于1 mL 1 ×binding buffer;取100 μL悬液,加5 μL Annexin V-FITC 和5 μL PI,室温反应15 min;加400 μL 1 ×binding buffer,上流式细胞仪测定荧光含量。
3 统计学处理
采用SPSS 13.0 软件进行统计处理,数据用均数±标准差(±s)表示,组间差异用单因素方差分析,组间多重比较用LSD 检验,以P <0.05 为差异有统计学意义。
结 果
1 特异性pshRNA-COL1A1 抑制MDA-MB-231 细胞COL1A1 mRNA 表达
RT-PCR 结果显示,转染pshRNA -COL1A1 重组质粒的细胞COL1A1 mRNA 显著低于阴性对照组(P <0.05),抑制率为63.05% ±3.13%,而阴性对照与脂质体组比较无显著差异(P >0.05),见图1。
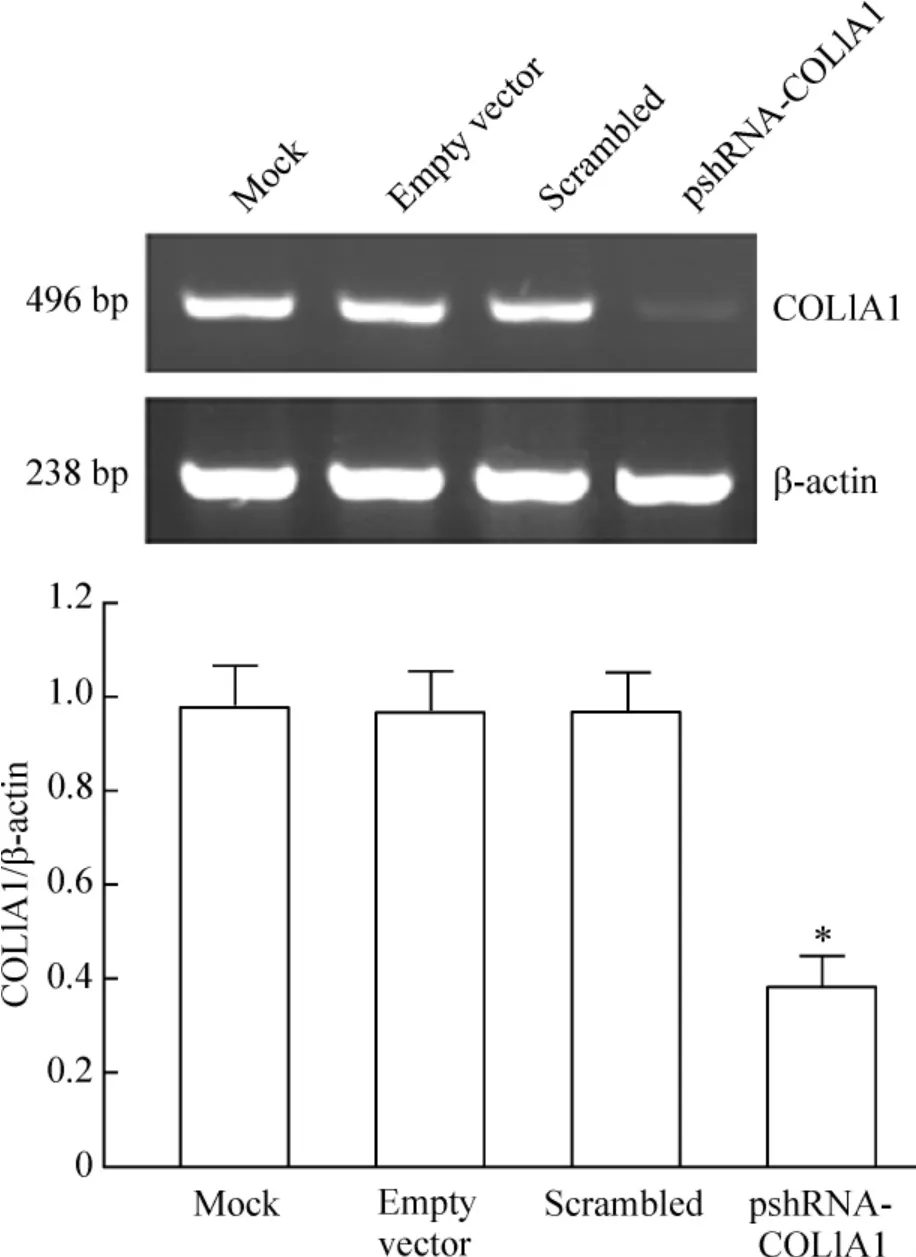
Figure 1. The results of RT -PCR analysis of COL1A1 mRNA expression in MDA-MB -231 cells. ±s. n =3. * P<0.05 vs mock or scrambled group.图1 RT-PCR 检测pshRNA-COL1A1 转染后乳腺癌MDA-MB-231 细胞COL1A1 mRNA 的表达
2 特异性pshRNA-COL1A1 抑制MDA-MB-231 细胞COL1A1 蛋白表达
Western blotting 结果显示,转染 pshRNA -COL1A1 重组质粒的细胞中COL1A1 蛋白抑制率为66.98% ±2.08%,显著高于脂质体对照组和阴性对照组(P <0.05),见图2。
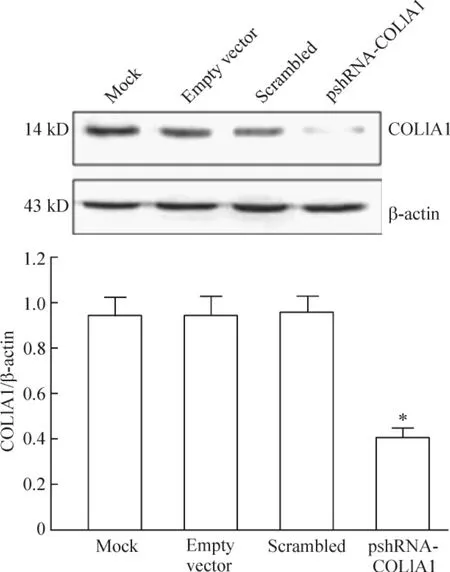
Figure 2. The results of Western blotting analysis of COL1A1 protein expression in MDA -MB -231 cells. ±s. n=3. * P <0.05 vs mock or scrambled group.图2 Western blotting 检测pshRNA-COL1A1 转染后乳腺癌MDA-MB-231 细胞COL1A1 蛋白的表达
3 特异性pshRNA-COL1A1 抑制MDA-MB-231 细胞的生长
用MTT 法检测24 h ~168 h 细胞的生长状况,发现pshRNA-COL1A1 转染组细胞增殖减慢,除24 h外,其余各时点A 值均显著低于阴性对照及脂质体对照(P <0.05),并呈时间依赖性,见表1。而阴性对照与脂质体对照组细胞体外增殖活性无明显差异(P >0.05)。
表1 MTT 法检测pshRNA-COL1A1 对MDA-MB-231 细胞增殖的影响Table 1. The effect of pshRNA-COL1A1 on the proliferation of MDA-MB-231 cells detected by MTT assay (A570. ±s.n=5)
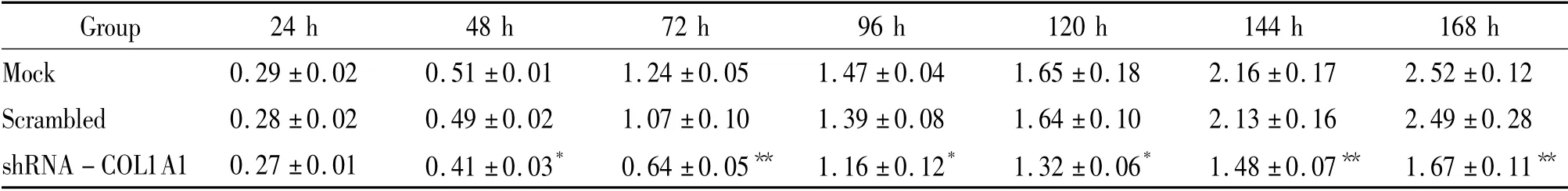
表1 MTT 法检测pshRNA-COL1A1 对MDA-MB-231 细胞增殖的影响Table 1. The effect of pshRNA-COL1A1 on the proliferation of MDA-MB-231 cells detected by MTT assay (A570. ±s.n=5)
* P <0.05,**P <0.01 vs mock or scrambled group.
Group 24 h 48 h 72 h 96 h 120 h 144 h 168 h Mock 0.29±0.02 0.51±0.01 1.24±0.05 1.47±0.0 4 1.65±0.18 2.16±0.17 2.52±0.12 Scrambled 0.28±0.02 0.49±0.02 1.07±0.10 1.39±0.08 1.64±0.10 2.13±0.16 2.49±0.28 shRNA-COL1A1 0.27±0.01 0.41±0.03* 0.64±0.05** 1.16±0.12* 1.32±0.06* 1.48±0.07** 1.67±0.11**
4 特异性shRNA-COL1A1 对MDA-MB-231细胞周期的影响
流式细胞术检测各组细胞周期的变化,见图3、表2。与脂质体组和阴性对照组细胞比较,pshRNA -COL1A1 转染组G0/G1期细胞数显著增多,S 期细胞数显著减少(P <0.05),细胞明显阻滞于G0/G1期。
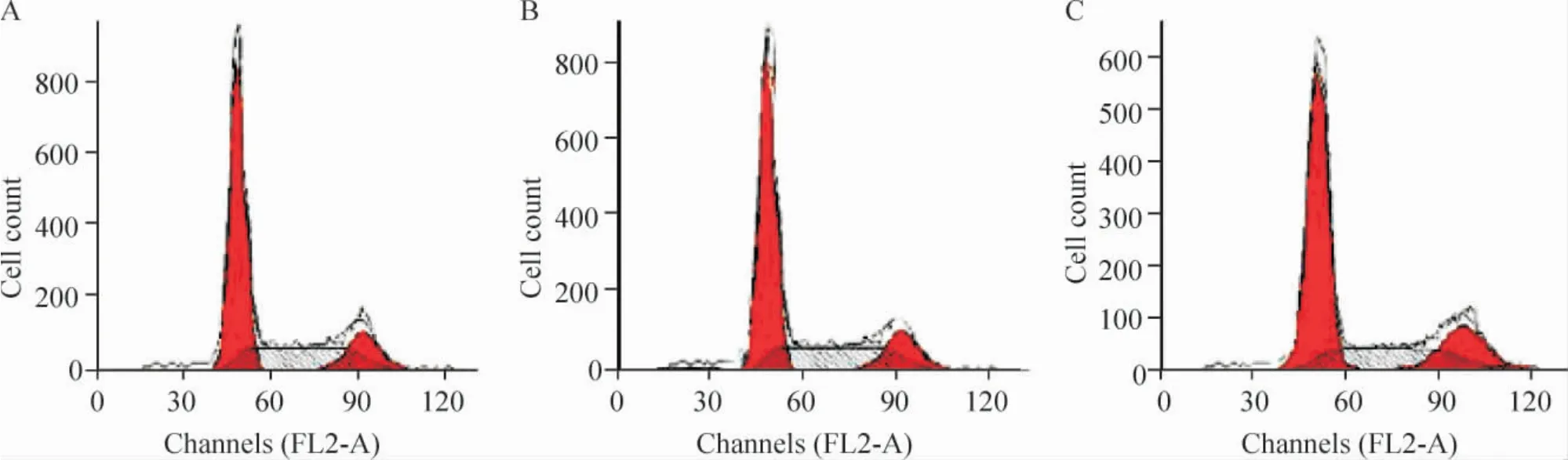
Figure 3. Detection of cell cycle of cells of each grounp by flow cytometry. A:mock;B:scrambled;C:pshRNA-COL1A1.图3 流式细胞术检测各组细胞的细胞周期
表2 流式细胞术检测各组细胞的细胞周期和凋亡Table 2. The flow cytometry detection results of MDA - MB -231 cell cycle and apoptosis (±s.n=3)
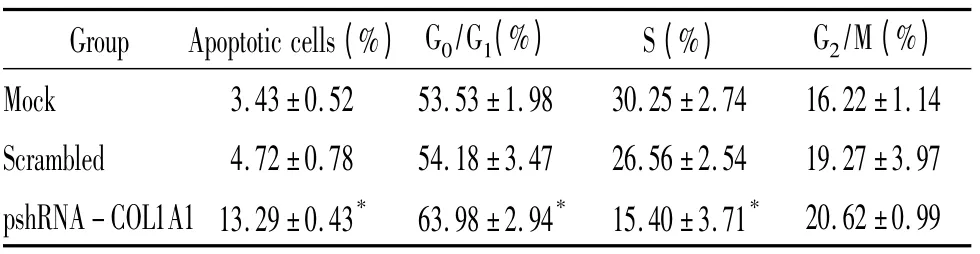
表2 流式细胞术检测各组细胞的细胞周期和凋亡Table 2. The flow cytometry detection results of MDA - MB -231 cell cycle and apoptosis (±s.n=3)
* P <0.05 vs mock or scrambled group.
Group Apoptotic cells(%) G0/G1(%) S(%) G2/M(%)1.14 Scrambled 4.72±0.78 54.18±3.47 26.56±2.54 19.27±3.97 pshRNA-COL1A1 13.29±0.43* 63.98±2.94* 15.40±3.71*Mock 3.43±0.52 53.53±1.98 30.25±2.74 16.22±20.62±0.99
5 细胞凋亡的形态学观察
用Hoechst 33258 对MDA -MB -231 细胞进行活细胞荧光染色,结果如图4 所示。脂质体组和阴性对照组细胞呈圆形或椭圆形,染色质均匀分布,细胞核荧光较弱,且着色均匀。pshRNA -COL1A1 组细胞核固缩、核染色质浓缩,箭头所示细胞在形态学上出现明显的凋亡特点,表现为核浓染致密的颗粒块状荧光或碎片样荧光。
6 特异性shRNA-COL1A1 对MDA-MB-231细胞凋亡的影响
各组转染72 h 后,流式细胞术检测结果表明,重组质粒pshRNA-COL1A1 组的细胞凋亡率显著高于脂质体对照组和阴性对照组(P <0. 05),见表2、图5。
讨 论
ECM 是肿瘤细胞侵袭、转移的天然屏障,肿瘤细胞发生侵袭、转移,必须以运动功能为动力,穿透ECM。COL1A1 基因全长17 537 bp,含有51 个外显子,位于染色体17q21.33,编码I 型胶原纤维的前α1链,COL1A2 基因编码α2 链。I 型胶原纤维前体是由2 条α1 链和1 条α2 链形成的三聚体结构,是ECM的重要组成成分,对细胞的黏附、分化有重要作用。I 型胶原纤维主要存在于人体的结缔组织中,在骨组织、皮肤中含量较多[8]。近年来有报道称,在乳腺癌的发生发展过程中存在COL1A1 基因的异常表达,并且可能与肿瘤细胞的增殖和迁移及肿瘤的预后相关[1-2,9-11]。
本研究通过shRNA 抑制COL1A1 基因的表达后,对体外培养的MDA -MB -231 细胞增殖、细胞周期和细胞凋亡的影响。RT -PCR、Western boltting等证实上述质粒可在mRNA 及蛋白质水平显著抑制COL1A1 表达,肿瘤细胞生长受到抑制。细胞周期和细胞的生长密切相关,细胞周期过程为G0/G1→S→G2/M 期,G0/G1期为DNA 合成前期,标志细胞进入增殖态,增殖旺盛的细胞G0/G1期持续时间短,S期为DNA 合成、复制期,G2/M 期分别为DNA 合成后期及有丝分裂期。采用流式细胞术分析RNAi 对人乳腺癌细胞系MDA -MB -231 的生长抑制作用与细胞周期的关系,结果显示pshRNA -COL1A1 组转染72 h 后G0/G1期细胞比率明显高于其它2 组。提示肿瘤细胞中COL1A1 基因被抑制后,影响细胞的细胞周期正常移行,阻止G0/G1期细胞进入S 期,造成pshRNA -COL1A1 组G0/G1期细胞聚集,S 期细胞减少,从而影响细胞的正常生长。同时,利用Hoechst 33258 染色和Annxeni V -FITC 检测细胞的凋亡情况。结果显示pshRNA - COL1A1 组细胞核固缩、核染色质浓缩,细胞核呈浓染致密的颗粒块状荧光和核裂解块状荧光,细胞形态呈现出凋亡的典型变化。而且,与mock 组和scrambled 组相比,pshRNA-COL1A1 组细胞凋亡明显增多,凋亡率达13.29%±0.43%,提示shRNA -COL1A1 转染介导COL1A1表达沉默可以显著促进乳腺癌MDA -MB -231 细胞发生早期凋亡。
综上所述,利用RNAi 技术沉默COL1A1 基因表达后,能有效抑制MDA -MB -231 细胞的生长,并诱导其凋亡,为后续研究COL1A1 基因在乳腺癌MDA-MB-231 细胞中的功能提供一定的实验依据,但COL1A1 基因对乳腺癌细胞的生长和凋亡作用的具体分子机制还有待进一步实验探索。
[1] Turashvilil G,Bouchal J,Baumforth K,et al. Novel markers for differentiation of lobular and ductal invasive breast carcinomas by laser microdissection and microarray analysis[J]. BMC Cancer,2007,7:55.
[2] Murabito JM,Rosenberg CL,Finger D,et al. A genome-wide association study of breast and prostate cancer in the NHLBI's Framingham Heart Study[J]. BMC Med Genet,2007,8(Supp 1):S6.
[3] Paddison PJ,Caudy AA,Bernstein E,et al. Short hairpin RNAs(shRNAs)induce sequence -specific silencing in mammalian cells[J]. Genes Dev,2002,16(8):948 -958.
[4] Sui G,Soohoo C,Affarel B,et al. A DNA vector-based RNAi technology to suppress gene expression in mammalian cells[J]. Proc Natl Acad Sci U S A,2002,99(8):5515 -5520.
[5] Duxbury MS,Whang EE. RNA interference:a practical approach[J].J Surg Res,2004,117(2):339 -344.
[6] Scherr M,Morgan MA,Eder M. Gene silencing mediated by small interfering RNAs in mammalian cells[J]. Curr Med Chem,2003,10(3):245 -256.
[7] 孙 莹,于 浩,张 灵,等. STAT3 -siRNA 对胃癌细胞株SGC-7901 增殖与凋亡的影响[J]. 中国病理生理杂志,2010,26(2):393 -395.
[8] Reis FC,Alexandrino F,Steiner CE,et al. Molecular findings in Brazilian patients with osteogenesis imperfecta[J]. J Appl Genet,2005,46(1):105 -108.
[9] Stull RA,Tavassoli R,Kennedy S,et al. Expression analysis of secreted and cell surface genes of five transformed human cell lines and derivative xenograft tumors[J]. BMC Genomics,2005,6:55.
[10] Harada Y,Ohuchi N,Ishida T,et al. Tumor markers in breast cancer[J]. Gan To Kagaku Ryoho,2001,28(7):1035 -1040.
[11] Perou CM,Sorlie T,Eisen MB,et al. Molecular portraits of human breast tumours[J]. Nature,2000,406(6797):747 -752.
