PMA 特异性抑制K562 细胞BCR/ABL 和Fyn mRNA 的表达*
2012-12-23王冠明陈小华陈少华杨力建王鹏程李扬秋
王冠明, 陈小华, 林 晨△, 陈少华, 杨力建, 王鹏程, 李扬秋
(暨南大学1医学院微生物与免疫学系,2血液研究所,广东 广州510632)
分子靶向药物伊马替尼能抑制BCR/ABL 激酶的活性,在慢性粒细胞白血病(chronic myeloid leukemia,CML)慢性期的治疗中十分有效,但易出现耐药致使加速期和急变期效果不佳[1-2]。12-肉豆蔻酸-13-乙酸佛波酯(phorbol 12-myristate 13-acetate,PMA)是蛋白激酶C(protein kinase C,PKC)的激活剂,临床研究显示:PMA 能明显改善伊马替尼耐药的CML 患者生存期[3-5],但其作用机制尚不是很清楚。近年发现Src 激酶家族成员Fyn 参与了伊马替尼耐受机制[6]。本实验利用PMA 作用于源自CML的K562 细胞株,实时荧光定量PCR 测定BCR/ABL与Fyn 基因的转录水平变化,通过分析PMA 对BCR/ABL 与Fyn 基因的影响,探讨两个基因之间的相互关系及意义。
材 料 和 方 法
1 材料
K562 细胞和Molt-4 细胞由暨南大学血液研究所保存;RPMI-1640 培养基、小牛血清购自健阳生物公司;台盼蓝和PMA 购自Sigma;植物血凝素(phytohemagglutinin,PHA)购自广州白云试剂公司;TRIzol 购自康为世纪公司;逆转录和实时荧光定量PCR 试剂盒购自东洋纺公司;CCK-8 试剂盒购自上海碧云天生物技术有限公司;DNA marker (DL2000)购自广州东盛生物科技有限公司;引物由上海英骏公司合成。
2 细胞培养
将K562 细胞和Molt-4 细胞置于含10%小牛血清的RPMI-1640 培养基中(青霉素1 ×105U/L,链霉素100 mg/L),于37 ℃、5%CO2培养箱中培养。取对数期的K562 细胞和Molt 4 细胞离心去除上清液,用PBS 洗涤2 次,细胞计数后分别接种于24 孔板中,每孔2 mL,含3 ×106个细胞。K562 细胞株反应体系:PMA 刺激组:浓度分别为1 μg/L、10 μg/L、100 μg/L 和250 μg/L;阳性对照组:PHA 浓度为25 mg/L;空白组。Molt-4 细胞株反应体系:PMA 刺激组:浓度为100 μg/L;阳性对照组:PHA 浓度为25 mg/L;空白组。各组复孔。持续刺激24 h 后,采用异硫氰酸胍-苯酚-氯仿一步提取法提取RNA,并参照试剂盒说明书,用随机引物进行cDNA 第1 链合成。
3 计算细胞存活率
用PBS 配制成0. 4% 台盼蓝,向培养24 h 的K562 各组细胞悬液滴加台盼蓝,使其终浓度为0.04%,3 min 内在显微镜下计数。细胞存活率=不染色细胞/细胞总数。
4 细胞增殖活性测定
将各实验组K562 细胞悬液滴入96 孔板中,每孔100 μL,同时设不加药的阴性对照与只加培养基无细胞和药的空白对照。37 ℃培养箱中培养24 h、36 h、48 h 后,各孔加入10 μL CCK-8,温箱中继续孵育2 h 后,用酶标仪检测450 nm 处吸光度(A),每组实验重复3 次。
5 实时荧光定量PCR
用NCBI 数据库及Primer Premier 5.0 软件设计引物,见表1。反应体系20 μL,其中含cDNA 1 μL,上、下游引物浓度为0. 3 μmol/L,RNAfree 水12.8 μL,MasterMix 10 μL。反应条件为预变性95 ℃2 min,扩增40 个循环,每循环包括95 ℃1 min,60 ℃30 s,72 ℃30 s,于68 ℃读板1 次,最后以0.15 ℃/s的速度从55 ℃~95 ℃每隔1 s 记录1 次荧光值,得到融解曲线。所有反应在Bio-Rad MiniOpticon 实时荧光定量PCR 仪上进行。
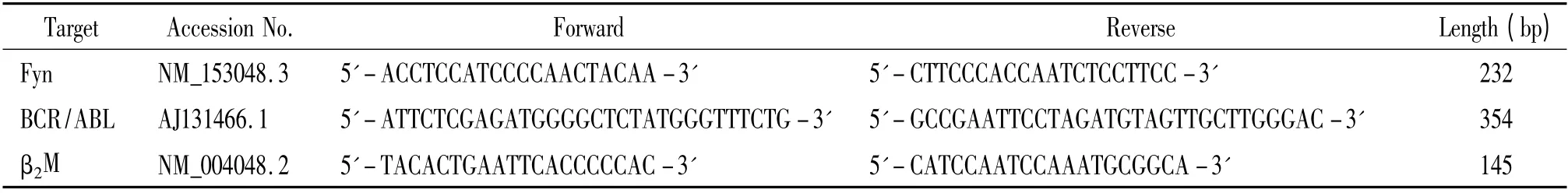
表1 实时荧光定量PCR 引物Table 1. Primers for real-time fluorescence quantitative PCR
6 相对定量分析
用2-ΔΔCt公式计算基因的相对表达量,Ct 值为扩增曲线达到荧光阈值所需循环数,ΔCt 为组内目的基因与内参照Ct 值之差,ΔΔCt 为组间ΔCt 之差。2-ΔΔCt值小于1 表示基因转录下调,大于1 则表示上调[7]。
7 PCR 产物鉴定
取PCR 产物置于2%脂糖凝胶中,以10 V/cm的电压电泳。
8 统计学处理
结 果
1 细胞存活率和增殖活性
台盼蓝拒染法检测空白组及1 μg/L、10 μg/L、100 μg/L、250 μg/L PMA 刺激组在培养24 h 后的细胞存活率分别为99.5%、99.2%、98.7%、96.5%和68.7%。CCK-8 结果显示250 μg/L PMA 对K562细胞增殖有明显抑制作用,而100 μg/L 浓度下48 h后才出现明显的抑制作用,见图1。
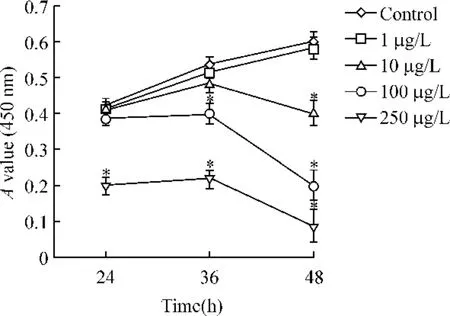
Figure 1. The growth curves of the K562 cells treated with different concentrations of PMA. ±s. n =3. * P <0.05 vs control group.图1 不同浓度PMA 作用下K562 细胞的生长曲线
2 PCR 产物鉴定
实时荧光定量PCR 扩增曲线平滑完好,各基因熔解曲线均只有单一峰,显示出良好的特异性,见图2。琼脂糖电泳显示目的基因大小与预期一致,说明PCR 结果准确无误,见图3。
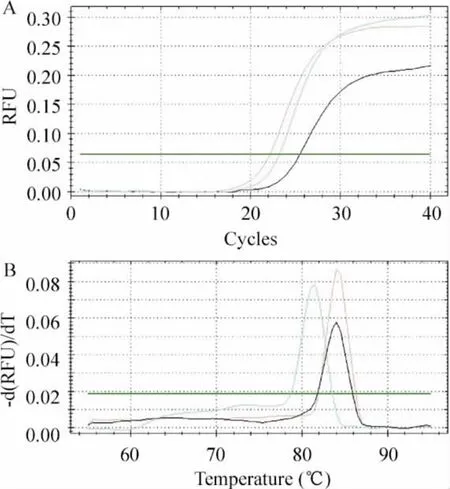
Figure 2. Real-time fluorescence quantitative PCR amplification curves (A)and melting curves (B).图2 实时荧光定量PCR 扩增曲线和熔解曲线
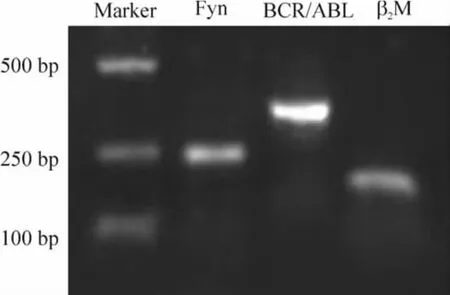
Figure 3. Identification of PCR products.图3 PCR 产物的鉴定
3 不同剂量PMA 对K562 细胞BCR/ABL 和Fyn mRNA 表达的影响
不同浓度PMA 作用K562 细胞株24 h 后,BCR/ABL 和Fyn mRNA 表达水平明显下调。PMA 在1 ~250 μg/L 范围内,抑制BCR/ABL mRNA 表达具有明显的量效关系(P <0.01)。同样,在1 ~100 μg/L 的范围内,抑制Fyn mRNA 表达具有量效关系(P <0.01)。PMA 在1 ~100 μg/L 的范围内,Fyn 和BCR/ABL mRNA 水平的下调具有明显相关性(r =0.929,P <0.01),见图4。
4 PMA 特异性下调K562 细胞Fyn 转录水平
以100 μg/L PMA 作用于K562 细胞株24 h,Fyn转录水平下调约55%,与空白对照组有明显差异(P <0.01);而PMA 作用于Molt-4 细胞株后Fyn 转录水平基本没有变化,均值为0.92,接近1,与空白对照组比较无明显差异(P >0.05),见图5。
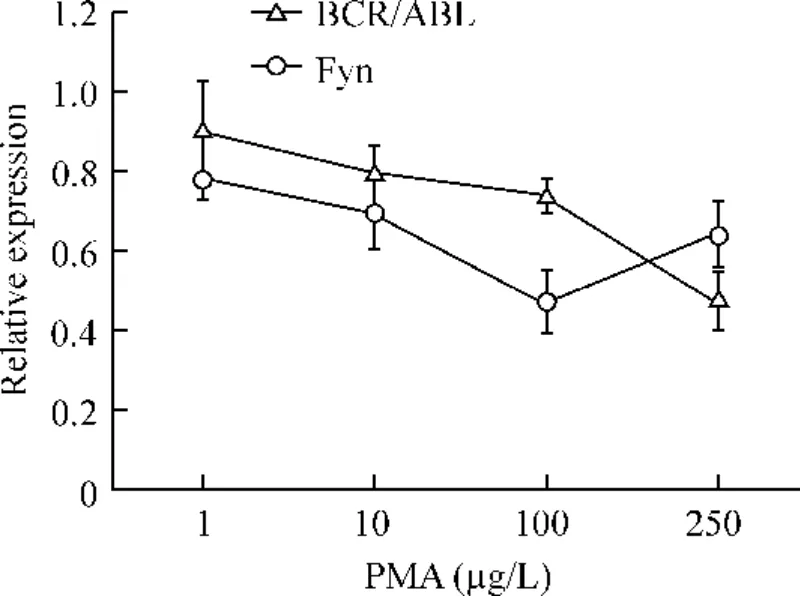
Figure 4. The changes of BCR/ABL and Fyn mRNA expression in K562 cells stimulated by the different concentrations of PMA. ±s.n=4.图4 不同浓度的PMA 作用下K562 细胞BCR/ABL 和Fyn mRNA 的表达变化
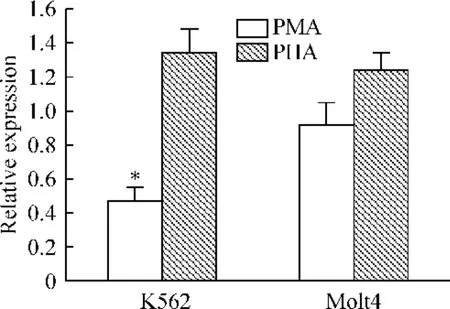
Figure 5. Comparison of the effects of PMA on Fyn mRNA expression in K562 and Molt-4 cell lines. ± s.n=4. * P <0.05 vs control group.图5 比较PMA 作用于K562 和Molt-4 细胞对Fyn 改变的影响
5 PMA 刺激K562 细胞的形态变化
100 μg/L PMA 刺激36 h 后,部分K562 细胞呈现贴壁生长,胞体梭形或多角形,见图6。
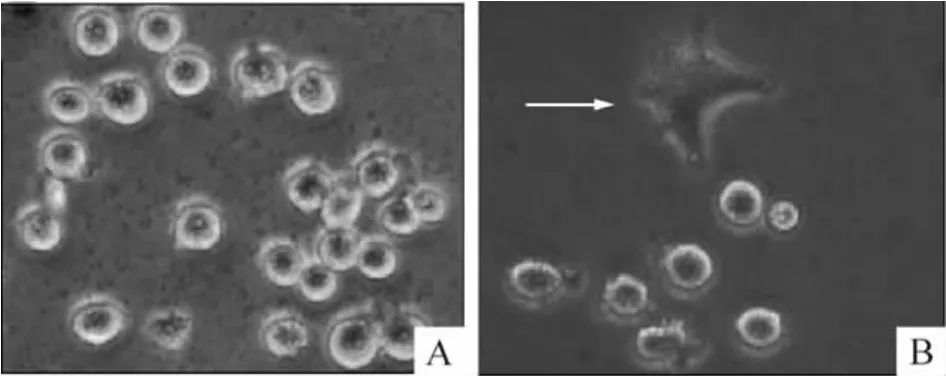
Figure 6. The differentiation of K562 cells induced by PMA for 36 h. A:0 h;B:36 h.图6 PMA 诱导K562 细胞分化情况
讨 论
CML 是由于第9 号染色体上的ABL 基因易位到第22 号染色体BCR 断裂点处形成特异性的BCR/ABL 融合基因[5],其产物BCR/ABL 融合蛋白中ABL激酶活性高表达,最终导致CML 的发生。目前,分子靶向药物是临床治疗CML 的一线药物,其作用靶点就是特异性抑制融合蛋白中的ABL 激酶。
临床最常用的分子靶向药物伊马替尼治疗CML的耐药机制大致可以分为BCR/ABL 依赖型和非BCR/ABL 依赖型[8]。前者最常见的原因是ABL 激酶点突变,而非BCR/ABL 依赖型的耐药机制则与Src 家族激酶有关[8]。Src 家族在调节细胞增殖、分化、黏附及运动方面起非常重要的作用[9],其9 个家族成员分别是Src、Yes、Fyn、Yrk、Fgr、Hck、Lyn、Lck和Blk,其中Src、Fyn 和Yes 表达广泛,而其它成员的表达具有细胞选择性[10]。近来研究逐渐发现Fyn 在耐药机制中起到较为重要的作用。Fyn 同BCR/ABL的关系非常密切,Src 激酶抑制剂PP2 能使伊马替尼耐药的K562 细胞恢复药物敏感性[5]。Fyn 通过磷酸化BCR/ABL 的SH3-SH2 区域,稳定其活化构象从而增强其活性[11]。Ban 等[12]报道,在CML 急变期,BCR/ABL 能上调Fyn 蛋白表达水平。这提示在急变期耐药机制中,Fyn 可能扮演了重要角色。
PMA 是一种强诱导剂,本实验结果显示,PMA能够下调BCR/ABL 基因转录水平,而且细胞形态上出现巨噬细胞样改变,这与文献报道相符[5,13]。同时,PMA 还能导致Fyn 基因的转录水平下调。而且,PMA 在一定浓度范围内,降低两者mRNA 表达水平呈现明显相关性。高浓度的PMA 对细胞有一定毒性作用,本实验结果表明,250 μg/L 浓度的PMA 有明显细胞毒作用,但在100 μg/L 浓度以下范围内,24 h 时点上对K562 细胞的毒性作用不明显。由于Fyn 激酶在机体较多种类细胞中普遍表达[10],分布没有十分严格的细胞特异性,为进一步探讨Fyn 下调与BCR/ABL 的关联性,我们选取了T 细胞系来源的无BCR/ABL 融合基因的Molt-4 细胞株作比较,结果发现PMA 对Molt-4 细胞Fyn 基因转录表达影响不大。该结果给我们很重要的提示:异常的BCR/ABL 融合基因参与或者介导Fyn 基因的表达,两者存在一定程度的因果关系。因此,深入研究两者之间的相互作用机制,对于阐明CML 的发病机制,克服治疗过程中的耐药性,具有十分重要的意义。
综上所述,PMA 通过抑制白血病K562 细胞株中BCR/ABL 融合基因下调Fyn 基因的转录。该作用具有CML 的细胞选择性。PMA 改善伊马替尼耐药性可能是通过诱导白血病细胞分化成熟的途径。
[1] Martinelli G,Soverini S,Rosti G,et al. New tyrosine kinase inhibitors in chronic myeloid leukemia[J]. Haematologica,2005,90(4):534-541.
[2] Valent P. Imatinib-resistant chronic myeloid leukemia(CML):Current concepts on pathogenesis and new emerging pharmacologic approaches[J]. Biologics,2007,1(4):433-448.
[3] 刘真真,房佰俊,宋永平,等. TPA 联合伊马替尼治疗伊马替尼耐药的慢性粒细胞白血病急变期患者的临床疗效[J].西安交通大学学报,2009,30(2):257-258.
[4] Han ZT,Zhu XX,Yang RY,et al. Effect of intravenous infusions of 12-O-tetradecanoylphorbol-13-acetate(TPA)in patients with myelocytic leukemia:preliminary studies on therapeutic efficacy and toxicity[J]. Proc Natl Acad Sci U S A,1998,95(9):5357-5361.
[5] Bártová E,Harnicarová A,Pacherník J,et al. Nuclear topography and expression of the BCR/ABL fusion gene and its protein level influenced by cell differentiation and RNA interference[J]. Leuk Res,2005,29(8):901-913.
[6] Grosso S,Puissant A,Dufies M,et al. Gene expression profiling of imatinib and PD166326-resistant CML cell lines identifies Fyn as a gene associated with resistance to BCR-ABL inhibitors[J]. Mol Cancer Ther,2009,8(7):1924-1933.
[7] 陈 思,李扬秋,陈少华,等. 慢性粒细胞白血病病人TCRζ 链表达特点[J]. 中国病理生理杂志,2008,24(6):1111-1113.
[8] Ramirez P,DiPersio JF. Therapy options in imatinib failures[J]. Oncologist,2008,13(4):424-434.
[9] 张丽景,金成艳,王果元,等. 蛋白酪氨酸磷酸酶SHP-2 对Ang Ⅱ刺激的心肌成纤维细胞增殖的影响[J].中国病理生理杂志,2012,28(2):244-248.
[10] Jeschke M,Brandi ML,Susa M. Expression of Src family kinases and their putative substrates in the human preosteoclastic cell line FLG 29.1[J]. J Bone Miner Res,1998,13(12):1880-1889.
[11] Meyn MA 3rd,Wilson MB,Abdi FA,et al. Src family kinases phosphorylate the Bcr-Abl SH3-SH2 region and modulate Bcr-Abl transforming activity[J]. J Biol Chem,2006,281(41):30907-30916.
[12] Ban K,Gao Y,Amin HM,et al. BCR-ABL1 mediates up-regulation of Fyn in chronic myelogenous leukemia[J]. Blood,2008,111(5):2904-2908.
[13] Lindner I,Kharfan-Dabaja MA,Ayala E,et al. Induced dendritic cell differentiation of chronic myeloid leukemia blasts is associated with down-regulation of BCR-ABL[J].J Immunol,2003,171(4):1780-1791.
