液质联用技术测定茶叶中多菌灵残留
2012-12-03田艳铃王浩
田艳铃,王浩
(国家食品质量安全监督检验中心,北京 100094)
多菌灵又名棉萎灵,是一种高效、低毒、广谱、内吸性杀菌剂,对多种作物由真菌(如半知菌、多子囊菌)引起的病害有防治效果。其作用机理是通过干扰菌体细胞纺锤体的形成,干扰细胞分裂,对植物具有良好的保护和治疗作用。在茶树上,主要用于防治茶芽枯病、茶白星病、茶轮斑病、茶褐色叶斑病等叶部病害和茶枝梢黑点病等。多菌灵的化学性质稳定,残效期长,人们长期饮用含有多菌灵残留的茶水可能引起慢性中毒。目前,我国对茶叶设定的限量为5.0mg/kg,日本的肯定列表制度对茶叶设定的限量为0.1 mg/kg,而我国茶叶中多菌灵残留国家标准检测方法检出限为0.2mg/kg,这无疑增加了我国茶叶对日出口的风险。
目前,茶叶中多菌灵残留的分析方法主要有荧光分析法、红外光谱法、气相色谱法、薄层扫描法、高效液相色谱法等。其中,薄层扫描法灵敏度较低;荧光法操作较繁琐且易受干扰;气相色谱法需要对样品进行衍生化处理,易造成多菌灵损失;高效液相色谱法前处理或者毒性较大(如用苯做提取液)[1],或者仪器要求较高(如需要用凝胶渗透色谱仪或溶剂快速提取仪等前处理仪器)[2-3],直接影响方法的适用范围。
本文确定了用0.2 moL/L盐酸甲醇溶液(1∶1,体积比)超声提取样品,OASIS MCX固相萃取柱净化富集,采用高效液相色谱-串联三重四极杆质谱法进行定性定量分析,取得满意效果。
1 材料与方法
1.1 仪器与设备
1.1.1 仪器
液相色谱-串联质谱仪:Agilent 6410型串联三重四极杆质谱,配Agilent1200型液相色谱仪(Agilent公司,美国;KQ-5200型超声清洗仪:昆山市超声仪器有限公司;Milli-Q去离子水发生器:Milli-Q公司,美国;RE-2000型旋转蒸发仪:上海市亚荣生化仪器厂;NEVADTM 111型氮气吹干仪:Organomation Association公司,美国;TGL-16M型高速台式冷冻离心机:湘仪离心机仪器有限公司。
1.1.2 试剂和材料
乙腈(色谱纯);甲醇(色谱纯);甲酸(色谱纯);盐酸(分析纯);氨水(分析纯);多菌灵购自国家标物中心,纯度为98%~99%;OASIS MCX固相萃取柱(美国waters公司,3cc,60 mg);实验所选用材料为本单位所检验样品。
1.2 分析条件
1.2.1 色谱条件
色谱柱:ZORBAX Eclipse XDB-C18柱:3.0 mm×50 mm,1.8 μm;流速:0.25 mL/min;柱温:30 ℃;进样量:10 μL;流动相0.1%甲酸的水溶液+乙腈,洗脱梯度见表1。

表1 分离多菌灵的较佳洗脱梯度Table 1 Optimal elution condition for separation of Carbendazim
1.2.2 质谱条件
离子源:电喷雾离子源(ESI);扫描方式:正离子扫描;检测方式:多反应检测;干燥气:N2;雾化气压力:275.8 kPa;干燥气温度:340 ℃;干燥气流速:8 L/min。多菌灵质谱分析的条件参数见表2。

表2 多菌灵的质谱参数Table 2 Parameter of Mass spectra of Carbendazim
1.3 样品处理
准确称取1.25 g样品,精确至0.01 g,置于25 mL具塞比色管中,用0.2 moL/L盐酸甲醇溶液(1∶1,体积比)定容至刻度,超声提取40 min,8000 r/min离心10 min,准确移取上清液10 mL至50mL烧杯中,将溶液以1 mL/min左右的流速通过固相萃取柱,待溶液完全流出后,先用3 mL 0.2 mol/L盐酸甲醇溶液(1∶1,体积比)冲洗烧杯合并过柱,然后再用3 mL甲醇淋洗萃取柱,最后用4 mL含4%氨水的甲醇溶液洗脱萃取柱,氮气吹干,再加入1 mL 50%甲醇水溶液,混合摇匀,进样10 μL进行液相色谱-串联质谱分析。
2 结果与讨论
2.1 样品提取条件的的优化
茶叶中成分复杂,色素含量较高,而多菌灵属于碱化合物,在酸性条件下易于溶解,因此本方法通过0.2 mol/L盐酸甲醇溶液(1∶1,体积比)提取样品中的多菌灵。超声波促使样品中的多菌灵更充分地溶于提取溶液中,简化了处理过程。通过对比实验证明,超声提取40 min能使样品中多菌灵充分溶出(加标回收率>85.0%),因此,选择此溶液作为样品提取液。
2.2 固相萃取柱的选择
固相萃取柱是利用固体吸附剂将样品中的目标化合物吸附,使目标化合物与基体干扰物分离,再用洗脱液淋洗达到净化和富集的目的。因为多菌灵是碱性化合物,所以本方法选择阳离子交换-反相萃取柱。实验发现:OasisMCX(美国 waters公司,3cc,60mg)萃取柱能提供对多菌灵的较强保留能力,分别通过0.2 mol/L盐酸甲醇溶液(1∶1,体积比)和甲醇淋洗萃取柱,能有效地消除样品中天然色素及非碱性化合物的干扰,净化效果比较理想。
2.3 质谱条件的优化
首先采用100 ng/mL的多菌灵标准溶液在正离子模式下进行母离子全扫描,确定多菌灵的分子离子为m/z192.1。按照欧盟委员会指令2002/657/EC对定性分析的要求,选取1个母离子及其2个子离子或2个母离子及其各1个子离子,并依据子离子相对丰度比即离子比(定性离子/定量离子)和化合物的保留时间来定性。因此,本方法以m/z192.1为母离子,对母离子进行轰击以获得二次碎裂产生的子离子,选择丰度较高、干扰较小的离子对m/z 192.1>160.0,192.1>132.0作定性离子对(如图1所示),选择离子丰度最高的离子对m/192.1>160.0作定量离子对;在此基础上重点优化了对灵敏度影响较大的碰撞能量,使选定的子离子组成的特征离子的丰度和比例达到最佳,从而得到多菌灵的最佳质谱参数(如表2所示)。
2.4 色谱条件的优化
多菌灵属于中等极性化合物,因此本方法采用梯度洗脱的方法提高分离效果,测试开始时,流动相中乙腈和0.1%甲酸的水溶液的比例为5∶95,保持二者的比例至3 min,然后在3 min~5 min内将二者的比例调整为95∶5,这一部分主要是洗脱样品中极性较强的杂质,5 min~10 min内将保持二者的比例为95∶5,这一部分主要是洗脱样品中目标化合物。通过上述两步梯度,在10 min内,可以较好的分离样品中多菌灵。图1为加标样品提取离子流图,从图1中可以看出多菌灵得到较好的分离。
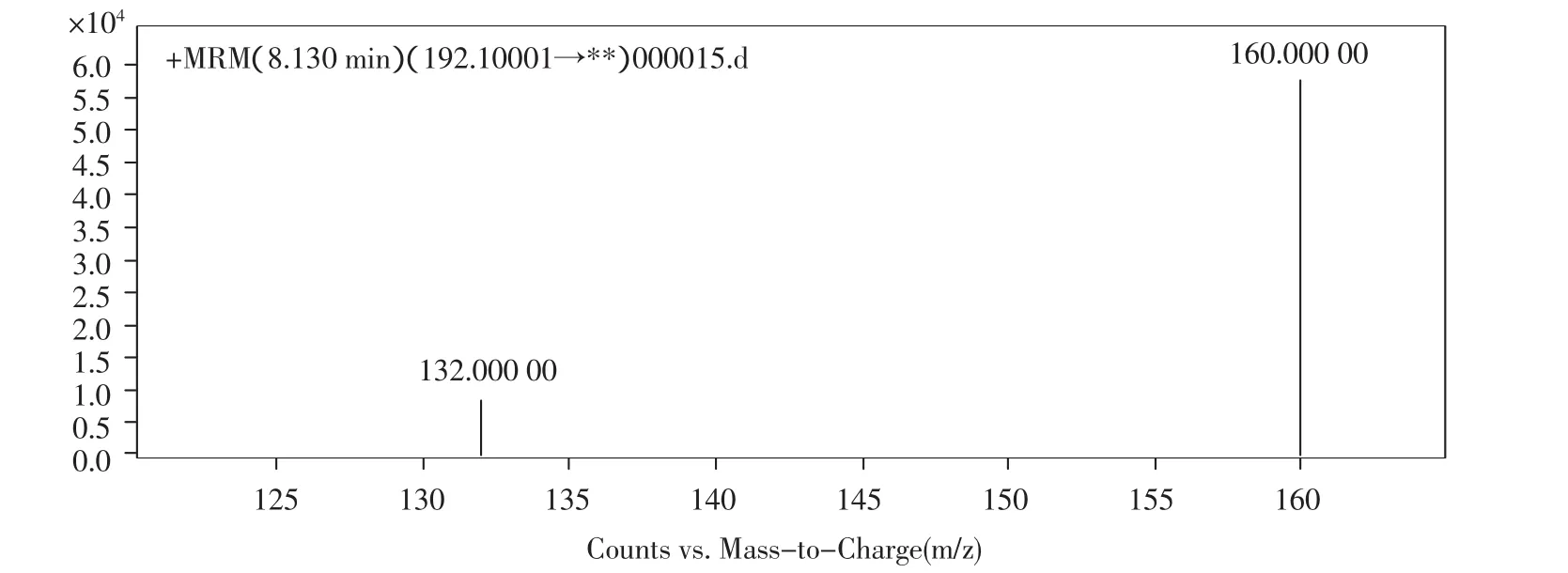
图1 碰撞能量为20 eV时多菌灵的质谱图Fig.1 Mass spectrum of Carbendazim at the collision energy of 20 eV
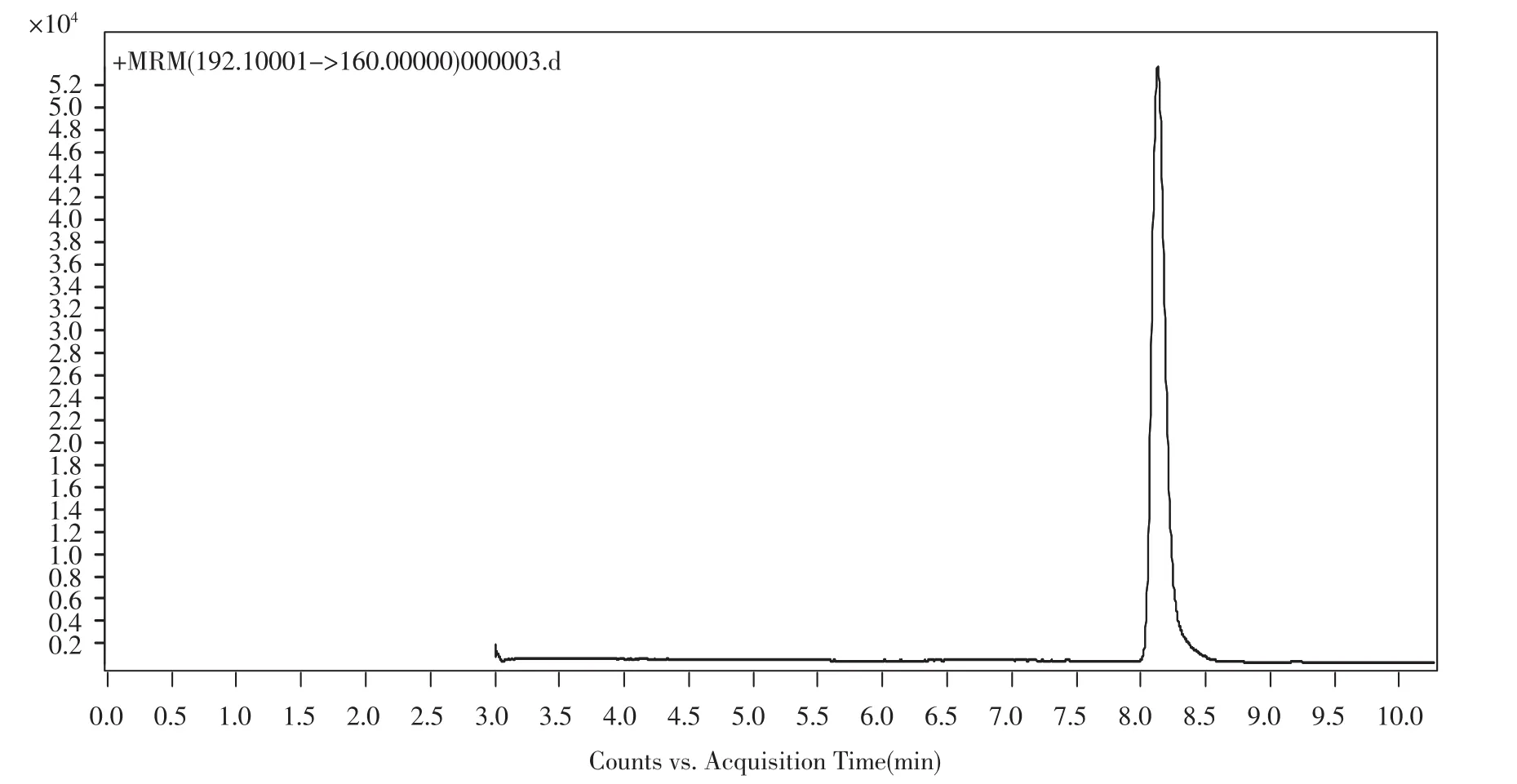
图2 加标样品的抽取离子流图Fig.2 Extraction spectrum of Carbendazim of spiled sample
2.5 线性范围与检出限
将逐级稀释的标准工作液分别进样10 μL,测定结果经线性回归,线性范围:0.5μg/L~4000μg/L。回归方程(y为峰面积,Counts;x为浓度,ng/mL)y=414879.96x+40894.66;线性相关系数:0.9990。进空白样,以基线3倍噪声值在标准曲线查得结果计算,测得方法检出限为1.0μg/kg。
2.6 方法的回收率和精密度
每组准确称取空白样品4份,每份1.25 g,共2组,分别定量加入标准品,添加水平分别为0.2、1.0 mg/kg,按供试品溶液制备方法制备后进行测定,结果见表3。可以看出,不同浓度加标回收率85.0%~96.0%,相对标准偏差为3.71%。(n=8),满足试验要求。
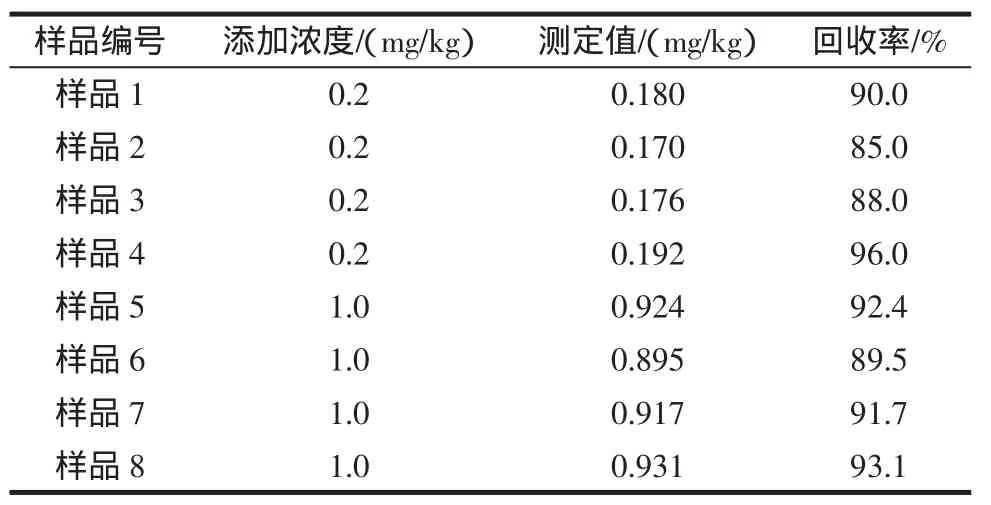
表3 样品中加标回收率Table 3 Recovery of Carbendazim in spiled sample
3 结论
本文建立了茶叶中多菌灵残留的高效液相色谱-串联四极杆质谱联用测定方法。该法用0.2 mol/L盐酸甲醇溶液(1∶1,体积比)超声提取样品,OASIS MCX 固相萃取柱净化富集,C18反相色谱柱对样品中多菌灵进行有效分离,电喷雾离子化,串联质谱检测。实验表明:本法检出1.0μg/kg,加标回收率高于85.0%,达到了国内先进水平,完全满足国内外对茶叶中多菌灵残留检测限量要求。
[1]段云龙.NY 660-2003茶叶中甲萘威、丁硫克百威、多菌灵、残杀威和抗蚜威的最大残留限量[S].北京:中国标准出版社,2003:2-3
[2]吴刚,吴俭俭,赵珊红,等.加速溶剂萃取-固相萃取结合液相色谱分析茶叶中多菌灵残留量[J].中国食品学报,2008,8(4):165-168
[3]杨秀敏,陈永艳,胡彦学,等.固相微萃取-高效液相色谱-荧光检测法分析苹果汁中的多菌灵和噻菌灵[J].中国食品学报,2007,7(5):122-126
