注射硫酸软骨素酶对大鼠脊髓损伤后腓肠肌乙酰胆碱酯酶的变化及运动功能的影响①
2012-11-27李洪鹏白旭东高杰巴方刘宁
李洪鹏,白旭东,高杰,巴方,刘宁
脊髓损伤后神经再生和功能修复是当今医学领域中的一大难题。脊髓损伤后,损伤周边反应性胶质细胞增殖并分泌硫酸软骨素蛋白聚糖(chondroitin sulfate proteoglycans,CSPGs)[1-2],CSPGs的糖链可以明显抑制轴突再生,而硫酸软骨素酶ABC可以通过降解其糖链而促进中枢神经的再生,进而促进大鼠脊髓损伤后神经元的修复,提高肢体的运动功能[3-4]。本实验通过制作Wistar大鼠T10脊髓损伤模型,探讨硫酸软骨素酶ABC对脊髓损伤后肢功能的恢复及肌肉组织内乙酰胆碱酯酶的影响。
1 材料与方法
1.1 材料 硫酸软骨素酶ChABC:美国SIGMA公司;GENMED冰冻切片乙酰胆碱酯酶活性染色试剂盒:迈新公司。成年Wistar大鼠40只,雄性,清洁级,体重250~300 g,由中国医科大学实验动物部提供。
1.2 动物模型制作 6%水合氯醛6 ml/kg腹腔内注射麻醉(30 mg/kg),背部剃毛,常规消毒,以第8~10胸椎棘突为中心行背部正中切口,纵行切开皮肤及皮下组织,剥离椎旁肌肉,暴露棘突及椎板,显微咬骨钳咬除第8~10胸椎棘突和椎板,暴露脊髓,约长4~5 mm,在T10节段将脊髓右侧半横断。以大鼠的健侧下肢作为对照组(A组),患侧下肢随机分为单纯脊髓损伤组(B组,n=20)及术后注射硫酸软骨素酶ABC组(C组,n=20)。B组在脊髓横断后,向脊髓损伤处注入0.1 mol/L PBS 3µl;C组在脊髓横断后,向脊髓损伤处注入0.5 U/µl硫酸软骨素酶ABC 3µl。缝合伤口,术后每天2次给予青霉素2×105U肌肉注射,并按摩膀胱直至排尿反射建立。动物饲养室温维持在25℃~30℃。
1.3 后肢运动功能评分 各组大鼠分别于术后3 d、7 d、14 d和28 d(各5只)采用BBB评分法进行后肢运动功能评分:将动物置于面积1 m2的平面场地,自由活动4 min,由2名熟悉BBB评分标准的非本组实验人员观察,记录动物后肢运动情况,取平均值。
1.4 取材与标本制作 各组大鼠分别于BBB评分后取材。6%水合氯醛6 ml/kg腹腔内注射麻醉(30 mg/kg),生理盐水及4%多聚甲醛300 ml灌注固定30 min,游离并切取大鼠腓肠肌。4%多聚甲醛固定12 h,放入30%蔗糖磷酸缓冲液1~2 d,OTC包埋后在-20℃恒温箱内行冠状连续冰冻切片。切片厚10 μm。
1.5 AChE染色 应用GENMED冰冻切片乙酰胆碱酯酶活性染色试剂盒对标本进行染色:冰冻切片用清理液略洗,加工作液,入37℃培养箱孵育2 h,避免光照,再用清理液清洗1次,GENMED苏木素复染试剂盒-GMS80067进行复染,中性树脂封片,即刻在光学显微镜下观察。
1.6 AchE活性分析 应用MetaMorph/OP10/BX41图像分析系统采集图像并分析AchE染色阳性光密度值(OD值)。
2 结果
2.1 BBB评分 所有动物在术前评分均为21分;术后即刻各组动物健侧运动功能短暂降低后,很快恢复到21分,患侧损伤后BBB评分为0。B组和C组均与A组有显著性差异(P<0.01)。随着时间的延长,B组与C组大鼠的BBB评分有增高的趋势,总的评分有非常高度显著性差异(F=531.275,P=0.000)。术后14 d、28 d,C组BBB评分均优于B组(P<0.05)。见表1。
2.2 腓肠肌内AChE的表达 各组大鼠健侧腓肠肌运动终板区AchE为棕黑色、细颗粒状亚铁氰化铜沉淀,在冠状切面上呈椭圆形或卵圆形,大小20~40µm,边缘清晰(图1)。而B组(图2)和C组(图3)腓肠肌运动终板区AchE阳性颗粒形状多不规则,且面积较小,尤以7 d、14 d、28 d下降显著。

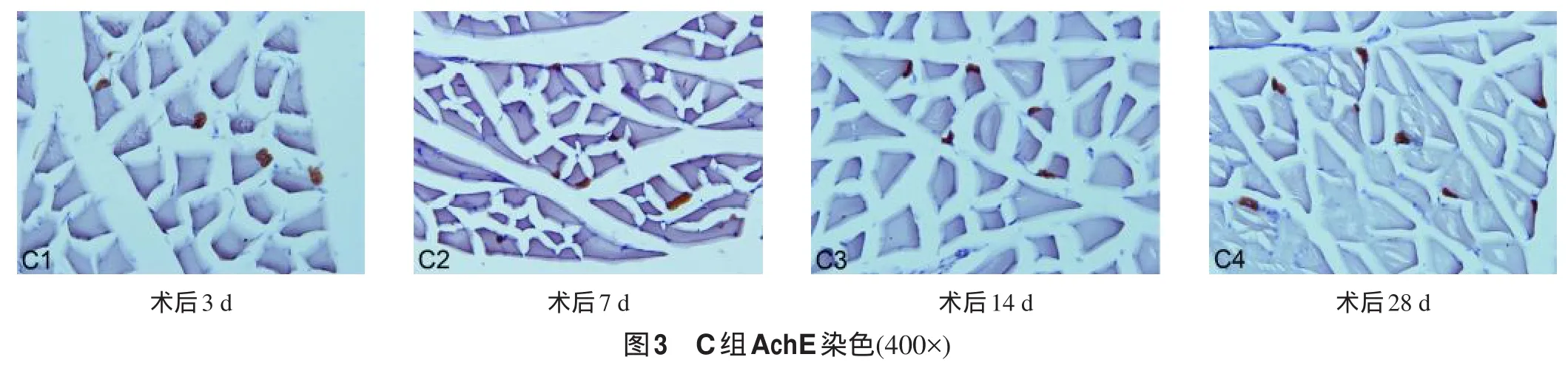
图像分析显示:A组(健侧)各时间段AChE的OD值无显著性差异。而B组及C组OD值在损伤后与健侧比较均明显下降(P<0.01),以B组下降更明显。C组在损伤后14 d及28 d较B组有显著性差异(P<0.05)。见表2。

表2 各组术后不同时间AChE的平均光密度
3 讨论
脊髓损伤的病理生理机制非常复杂,近年来对脊髓损伤后微环境中的抑制因子研究较多。CSPGs在中枢神经发育过程中可调节神经细胞增生、迁徙、分化,轴突的生长和路径选择,以及突触的形成和成熟[4]。脊髓损伤后,CSPGs的堆积可抑制神经细胞轴突的再生修复[5]。CSPGs是带有多种糖链的蛋白聚糖,而对神经再生起抑制作用的主要因素是其糖链,因此本研究采用可以消化CSPGs葡胺聚糖链的ChABC。
BBB评分是由Basso等提出的一种脊髓运动功能评定法,用于评价大鼠脊髓损伤后肢体运动功能的恢复情况[6]。该评分标准包括许多动物行为细节和特征说明,分级较细致(0~21分),评分与脊髓功能恢复有良好的一致性。
AChE主要存在于突触间隙及运动终板,它可催化乙酰胆碱,使其水解为胆碱和乙酸。各种形式的AChE都能在脊髓运动神经元和骨骼肌细胞中找到[7]。AChE活性不仅可反映运动神经元的功能状态[8],而且终板区AChE对于神经肌肉接头突触功能和结构的维持也是必需的,所以终板区AChE含量能够反映终板退变及再生情况[9-10]。
本研究显示,脊髓损伤后,大鼠运动功能的恢复与乙酰胆碱酯酶表达一致,提示ChABC治疗可以提高脊髓损伤后大鼠的后肢功能恢复,其机制可能是促进神经再生并修复运动终板。
ChABC治疗不仅可以促进脊髓本身的神经再生和修复,阻止神经肌肉接头以上的退行性改变,而且可以加强肌肉与脊髓神经的联系,使远端肢体进行形态与功能重塑。但ChABC裂解CSPGs促进神经再生的机制目前仍然未完全清楚。
目前还没有一种方法能够使脊髓损伤完全康复,脊髓损伤治疗的研究不应只局限于损伤局部神经再生,更要重视远端肌肉组织内运动终板的研究。综合应用多种治疗方法对恢复运动功能具有广大的研究前景和应用价值。
[1]McKeon RJ,Schreiber RC,Rudge JS,et al.Reduction of neurite outgrowth in a model of glial scarring following CNS injury is correlated with the expression of inhibitory molecules on reactive astrocytes[J].J Neurosci,1991,11(11):3398-3411.
[2]Fawcett JW,Asher RA.The glial scar and central nervous system repair[J].Brain Res Bull,1999,49(6):377-391.
[3]Bradbury EJ,Moon LD,Popat RJ,et al.Chondroitinase ABC promotes functional recovery after spinal cord injury[J].Nature,2002,416(6881):636-640.
[4]Fouad K,Dietz V,Schwab ME.Improving axonal growth and functional recovery after experimental spinal cord injury by neutralizing myelin associated inhibitors[J].Brain Res Rev,2001,36(23):204-212.
[5]Lemons ML,Howland DR,Anderson DK.Chondroitin sulfate proteoglycan immunoreactivity increases following spinal cord injury and transplantation[J].Exp Neurol,1999,160(1):51-65.
[6]Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J].Neurotrauma,1995,12(11):1-21.
[7]Legay C.Why so many forms of acetylcholinesterase?[J].Microsc Res Tech,2000,49(1):56-72.
[8]Arikawa-Hirasawa E,Rossi SG,Rotundo RL,et al.Absence of acetylcholinesterase at the neuromuscular junctions of perlecan-null mice[J].Nature Neurosci,2002,5(2):119-123.
[9]Martinez-Penay Valenzuela I,Hume RI,Krejci E,et al.In vivo regulation of acetylcholinesterase insertion at the neuromuscular junction[J].J Biol Chem,2005,280(36):31801-31808.
[10]Martinez I,Valenzuela P,Akaaboune M.Acetylcholinesterase mobility and stability at the neuromuscular junction of living mice[J].Molecu Biol Cell,2007,18:2904-2911.
