早期干预及康复训练对宫内感染脑损伤仔鼠脑白质髓鞘相关糖蛋白表达的影响②
2012-11-27张明达李晓捷
张明达,李晓捷
脑性瘫痪(cerebral palsy,CP)是由于发育中胎儿或婴儿脑的非进行性损伤所致持续性运动和姿势发育异常、活动受限的一组综合征[1]。常并发感觉、知觉、认知、交流、行为紊乱、癫痫、继发性肌肉与骨骼问题。近年来,由于感染/炎症与脑瘫关系的研究取得很大的进展,临床与流行病学资料都证实脑室周围白质软化(perivetricular leukomalacia,PVL)是脑瘫的一个重要危险因素,而感染是导致PVL发生的原因[2]。大量研究证实,早期干预可通过一系列的机制促进脑损伤鼠的神经行为学改变。髓鞘相关糖蛋白(myelin-associated glycoprotein,MAG)是免疫球蛋白超家族成员,是中枢神经系统和外周神经系统中的一种髓鞘成分,并与中枢神经系统的损伤关系密切[3]。它参与髓鞘的形成和维持并且在轴突生长方面起到重要作用。本研究应用免疫组化技术对早期干预后脑组织中MAG含量变化和运动功能改善情况进行相关性研究,从形态学、分子生物学和行为学方面揭示先天性脑损伤及功能恢复机制。
1 材料与方法
1.1 实验材料 清洁级雌性Wistar大鼠40只,体重220~250 g,雄性10只,体重250~300 g:大连医科大学动物实验中心;脂多糖(lipopolysaccharides,LPS),血清型055:B5:美国SIGMA公司;细胞免疫组化法(SABC法)试剂盒、兔抗鼠MAG多克隆抗体:北京博奥森生物工程有限公司。
1.2 动物模型制备与分组 Wistar大鼠室温(21±1)℃下常规饲养,自由饮食,适应环境2周后于17:00分两批,每批雌鼠20只,按雌∶雄=2∶1合笼,第2天8:00查阴道涂片,如果查到精子记为妊娠0 d。孕鼠另笼饲养,分别在孕17 d、18 d对30只雌鼠(脂多糖组)腹腔注射脂多糖420µg/kg·d,另10只注射等量无菌生理盐水。仔鼠出生后去除孕22 d前出生的仔鼠,取脂多糖组胎盘行HE染色,观察宫内感染情况,判断标准为组织中含有大量中性粒细胞浸润。随机抽取脂多糖组仔鼠100只分为干预组和非干预组各50只;选取生理盐水组仔鼠(对照组)50只。
1.3 干预方法 干预组从出生后第1天开始进行早期干预,2周后康复训练,非干预组和对照组常规饲养。
1.3.1 早期干预 将1日龄干预组仔鼠托至掌心,给予不同强度和频率的声音和灯光刺激,同时用毛刷从前到后均匀有力的刷动,不能用力过大,防止产生疼痛。每天1次,每次20 min,持续至2周龄。
1.3.2 康复训练 对15日龄干预组小鼠进行丰富环境刺激和康复训练。每次30 min,每天1次。丰富环境包括转盘、阶梯、管道、秋千、斜坡和不同颜色和大小的球类等,每周改变环境两次,持续至28日龄结束。康复训练包括平衡木训练、转棒训练和转笼训练等。
非干预组和对照组饲养于同样大小的笼内,但不给予干预。
1.4 运动功能评定 分别用悬吊实验[4]和改良BBB测试[5]于14 d、21 d、28 d对每组仔鼠进行运动功能评定。
1.5 取材 分别于出生后第1、7、14、21、28天对3组仔鼠各取6只行麻醉下心脏灌洗后断头,迅速取脑组织,甲醛溶液中固定。
1.6 MAG测定 各组石蜡包埋组织切片6张,片厚5µm,其中5张行MAG免疫组化染色,1张用磷酸缓冲盐溶液代替一抗作阴性对照。
用Image Pro Plus 4.5图像分析软件计数MAG表达积分光密度(IOD)。每张切片随机选取6个位置相应但不重复的视野均值作为该片IOD;每组选取6张切片。
1.7 统计学分析 采用SPSS 17.0统计软件进行统计。多组间比较采用单因素方差分析;组间均数比较采用t检验,方差不齐时组间均数比较采用t'检验。显著性水平α=0.05。
2 结果
2.1 孕鼠分娩及仔鼠一般情况 脂多糖组孕鼠注射脂多糖后,进食及活动均明显减少,精神状态较生理盐水组明显萎靡,其中5只死亡,4只提前分娩,其余21只顺利生产,共娩出仔鼠128只,死产13只。脂多糖组仔鼠身体颜色青紫,体重低,进食减少且精神萎靡,活动减少。生理盐水组注射生理盐水后无明显异常,共娩出仔鼠103只,均为足月活产鼠,反应灵敏,颜色淡红,体重正常。
2.2 子宫及胎盘检测 脂多糖组孕鼠胎盘病理切片观察见大量中性粒细胞浸润,血管充血、水肿;生理盐水组孕鼠胎盘未见异常。
2.3 神经行为学检测
2.3.1 悬吊试验 与对照组比较,干预组和非干预组悬吊时间短(P<0.01);但干预组测试得分明显高于非干预组(P<0.01)。见表1。
2.3.2 改良BBB测试 14与21日龄干预组和非干预组得分明显低于对照组(P<0.01);干预组评分明显高于非干预组(P<0.01);28日龄干预组与对照组评分无显著性差异(P>0.05),非干预组评分明显低于对照组(P<0.01)。见表2。
2.4 MAG 干预组和非干预组MAG表达IOD值均明显高于对照组(P<0.01);7日龄以后,非干预组明显高于干预组(P<0.01)。见表3。
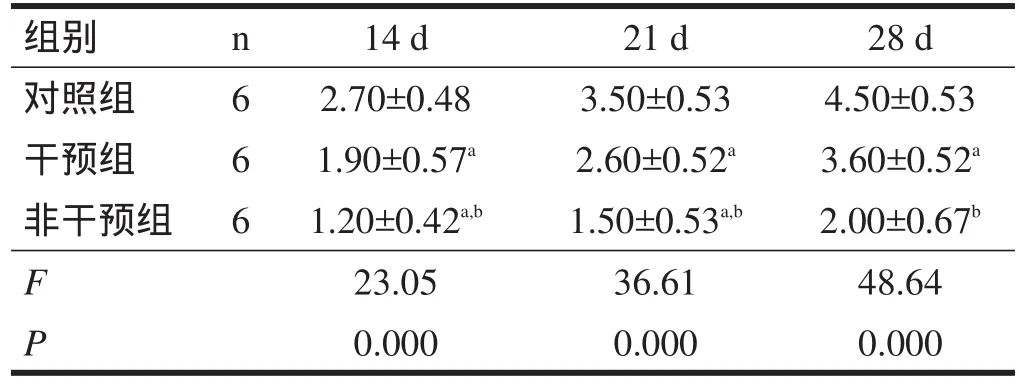
表1 不同日龄仔鼠悬吊实验评分
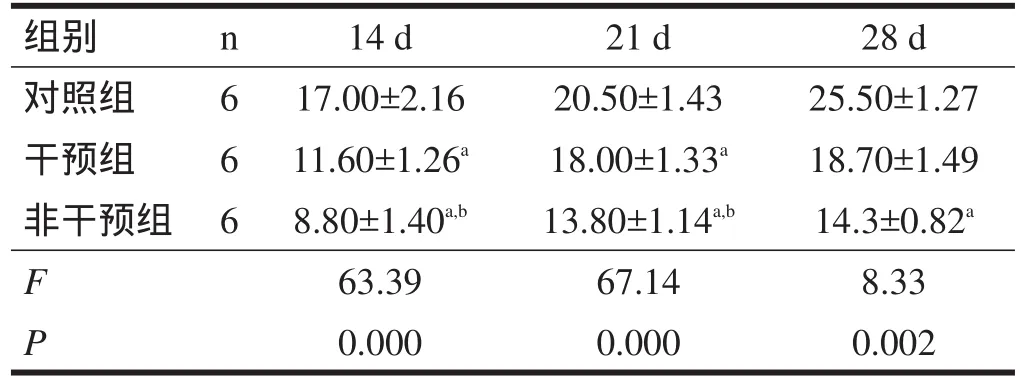
表2 不同日龄仔鼠改良BBB评分
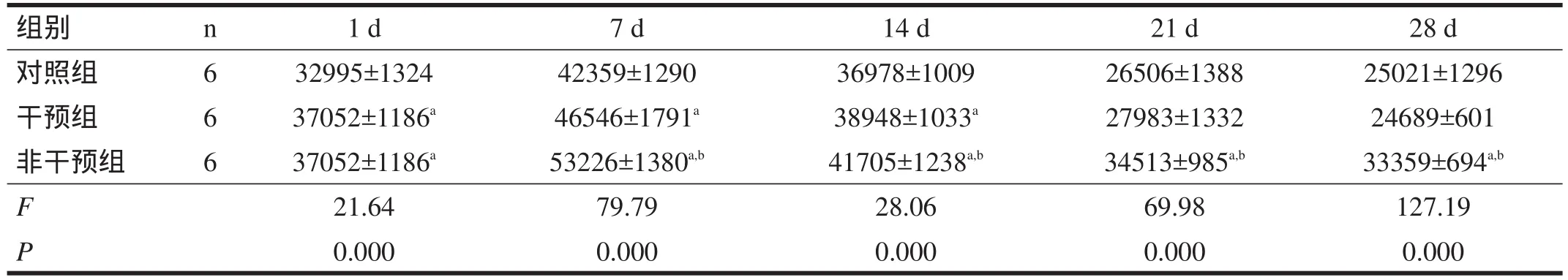
表3 不同日龄各组仔鼠脑白质MAG表达情况(IOD)
3 讨论
中枢神经系统在受到损伤后具有一定可塑性,即残留部分脑组织结构和功能重建的能力,其中关键是轴突的再生。目前认为中枢神经系统轴突再生障碍主要有两个原因:①损伤神经元存在再生能力缺陷;②中枢神经系统内微环境不适合其再生。其中抑制性因素被认为可能起更重要的作用。目前发现的神经再生抑制性髓鞘蛋白主要有MAG、Nogo和少突胶质细胞糖蛋白(OMGP),还包括很多有胶质细胞神经元本身产生的蛋白多糖和生长锥抑制因子以及细胞外分子等[6]。
表1、表2显示,生理盐水组的运动功能明显好于脑损伤组,经过早期干预和康复训练的损伤组仔鼠运动功能提高显著,而未经训练的损伤组仔鼠运动功能提高不明显。但是随着各组仔鼠日龄增加,其运动功能均有提高,这说明宫内感染所致仔鼠脑损伤为非进行性脑损伤;干预组仔鼠经过早期干预和康复训练后运动功能比非干预组提高明显,也说明康复训练这种形式对中枢神经系统损伤后可塑性的提高起到了明显促进作用。
表3显示,在生理盐水组中MAG的表达量要明显低于损伤组,说明MAG在仔鼠出生时即有表达,在脑损伤后表达上调。干预组仔鼠表达量要低于非干预组,说明早期干预和康复训练能抑制MAG的表达,从而促进脑损伤仔鼠脑组织结构和功能的恢复。在各组中MAG表达均是先增多后降低然后趋于稳定,MAG在各组中均是在第7天表达达高峰,在21 d、28 d时逐渐降低。这与袁普卫等[7]研究的MAG在急性脊髓损伤后的表达规律相一致。早期干预和康复训练后MAG表达减少,提示运动功能的提高与脑组织中MAG的表达可能具有一定的相关性。
MAG作为一种髓鞘相关抑制蛋白,能够抑制神经元突起的生长和轴突的生长而且还可能影响轴突的结构,从而影响神经元的功能[8]。通过以上实验研究,我们可以初步推论,脑损伤后,MAG在短时间内的表达增高,阻碍了轴突和髓鞘的再生,这解释了中枢神经系统损伤后难以再生的部分原因,而采取干预措施后,MAG表达水平出现下降,这与临床上早期干预及康复训练的效果相符,这表明早期干预及康复训练可能通过某种机制降低中枢神经系统微环境中抑制因子的表达,从而改善神经修复和再生的微环境,促进轴突和髓鞘的形成,增强了中枢神经的可塑性,这很好的解释了临床上通过早期干预和康复训练能够改善脑瘫及其中枢神经系统损伤相关疾病症状的原因。
近年来对MAG的抑制作用机制的研究发现,神经营养因子p75NTR在转导其抑制性效应中起到重要作用。Domeniconi等发现,MAG通过受控的膜内蛋白水解作用(RIP)先后经过α和γ分泌酶两次对p75NTR进行剪切,使其能释放出胞内区(ICD)[9],后者正是蛋白激酶PKC和小GTP酶Rho激活所必须的,由此启动下游的信号来抑制轴突的生长,因此如果能阻断该分泌酶的活性就很有可能阻断NgR与MAG结合所导致的轴突生长抑制,这为中枢神经系统损伤的治疗提供了一个有效的靶点。另外,还有很多已经被提出来的关于MAG的抑制作用的机制,但是目前仍缺少定论,所以对MAG的抑制效应和相应的作用机制及其信号转导通路等方面还需要更深入的研究。
早期干预可使新生鼠皮层重量和厚度增加,神经胶质细胞增生、突触和树突枝增多等,使受损伤脑通过产生非常规神经突触、树突出现不寻常分叉、轴突绕道投射等途径进行功能代偿[10]可以提高新生鼠GABA受体的水平,增加突触的饱和度[11],可以提高脑内新环路调控的可塑性[12]。康复训练不但能够促进脑损伤功能区恢复,还可以促进树突发芽,技巧平衡训练可刺激突触的增生,促进大脑皮质血管生成增多,同时能增加神经冲动,减轻损伤周围区的功能障碍,有利于脑室周围白质损伤的修复[13],对脑的可塑性有重要意义。
本实验结果说明,早期干预和康复训练可以明显改善脑损伤仔鼠的运动功能,并且能够减少MAG的表达。MAG蛋白的测定不但能够为临床早期诊断脑损伤提供重要的客观依据,而且能为临床确定最佳的检查时间窗提供必要的依据。这也正是研究MAG在脑损伤中表达变化的意义所在[14]。
[1]李晓捷.实用小儿脑性瘫痪康复治疗技术[M].北京:人民卫生出版社,2009:2-3.
[2]Svigos JM.The fetal inflammatory response syndrome and cerebral palsy:yet another challenge and dilemma for the obstetrician[J].Aust N Z J Obstet Gynaecol,2001,41(2):170-176.
[3]顾文莉,陆佩华.髓鞘相关糖蛋白与神经系统的髓鞘发育和轴突生长[J].生理科学进展,2006,37(3):243-245.
[4]庞伟,李晓捷,张士岭,等.早期干预对宫内感染致脑损伤子鼠脑S-100蛋白及行为学的影响[J].实用儿科临床杂志,2010,25(2):96-98.
[5]郭岚敏,李晓捷,庞伟.宫内感染致脑瘫大鼠运动功能不同评定方法的比较[J].中国康复理论与实践,2010,16(3):225-226.
[6]罗其中,包映晖,董斌.中枢神经损伤后的神经再生与修复策略[J].中国微侵袭神经外科杂志,2004,9(2):49-52.
[7]袁普卫,贺西京.MAG蛋白在大鼠急性脊髓损伤中的表达及意义[J].陕西中医学院学报,2006,29(4):43-47.
[8]李欣,廖新学.髓鞘结合糖蛋白抑制神经干细胞向神经元分化和轴突生长[J].中国病理生理杂志,2009,25(5):919-923.
[9]Domeniconi M,Zampieri N,Spencer T,et al.MAG induces regulated intramembrane proteolysis of the p75 neurotrophin receptor to inhibit neurite outgrowth[J].Neuron,2005,(46):849-855.
[10]李晓捷,吕智海,孙忠人,等.早期丰富环境刺激对脑瘫大鼠脑发育的影响[J].中国康复医学杂志,2006,21(12):1061-1064.
[11]He S,Ma J.Early enriched environment promotes neonatal GABAergic neuro-transmission and accelerates synapse maturation[J].Neuroscience,2010,30(23):7910-7916.
[12]Akashimal AS,Dyck RH.Enhanced plasticity in zincergic,cortical circuits after exposure to enriched environments[J].Neuroscience,2008,28(51):13995-13999.
[13]廖伟,赵聪敏,温恩懿,等.早期丰富环境干预对未成熟大鼠脑室周围白质软化脑功能的影响[J].实用儿科临床杂志,2007,22(20):1570-1572.
[14]刘曼玲,李占魁.新生鼠缺氧缺血性脑损伤海马皮层MAG表达变化研究[J].中国儿童保健杂志,2011,19(4):334-337.
