硫酸软骨素螯合锌的制备、表征及体外生物活性
2022-04-26陈俊德郑美华
高 然,苏 贇,陈俊德, ,郑美华
(1.自然资源部第三海洋研究所,自然资源部海洋生物资源开发利用工程技术创新中心,福建 厦门 361001;2.集美大学水产学院,福建 厦门 361021)
锌是人体必需微量元素之一,以二价阳离子形式存在于皮肤、肌肉和骨骼中。锌作为人体抗氧化酶、DNA聚合酶和其他基质金属蛋白酶等体内多种酶的主要组成成分和酶促因子,可人体调节碳水化合物、脂肪及蛋白质的代谢活动,对人体的维生素代谢、细胞免疫及生长发育等方面具有重要作用[1−2]。缺锌易引发人体多种生物学功能降低,如生长功能下降、免疫系统受损、内分泌系统失衡等[3−4]。目前,市面上常见的补锌剂多为硫酸锌和葡萄糖酸锌,此类产品以锌离子形式进入人体后,一方面胃酸的分泌影响锌离子的吸收,一方面在消化道中,锌离子几乎不能穿过肠道粘膜[5],导致人体对锌离子的吸收率和利用度较低[6]。
硫酸软骨素(Chondroitin Sulfate,CS)是一种以蛋白聚糖形式存在的线性糖胺聚糖,分子结构中主要的活性基团为羧基和磺酸基团[7−9],可与锌离子发生络合反应形成硫酸软骨素锌螯合物[10−12]。硫酸软骨素锌螯合物以有机结合态穿过小肠粘膜屏障,可有效降低游离锌离子对胃肠道粘膜的刺激[13]。当释放锌离子后,CS配体还可继续发挥其生物活性。
市场上现有的以CS和锌为主要成分的补锌剂产品,只是将CS和无机锌盐进行简单混合,并没有形成真正意义上的硫酸软骨素锌配位化合物,无法避免胃肠环境对锌离子的干扰。本研究以硫酸软骨素和硫酸锌为原料,采用生物螯合技术,将游离锌离子以共价键形式结合到硫酸软骨素上,形成结构更稳定的硫酸软骨素螯合锌制品。硫酸软骨素螯合锌作为一种既可补充锌离子,同时又具有多种生物活性的新型多糖补锌剂,市场上未见相关产品。本论文采用正交试验法优化硫酸软骨素螯合锌的制备工艺,并分析其结构特征和体外消化吸收特性,为新型补锌剂的开发提供研究思路。
1 材料与方法
1.1 材料与仪器
鲨鱼源硫酸软骨素(含量90%) 实验室自制;七水合硫酸锌、氢氧化钠 均为分析纯,国药集团化学试剂有限公司;浓硫酸、浓硝酸、浓盐酸、无水乙醇、溴化钾 均为分析纯,西陇科学股份有限公司;高氯酸 优级纯,天津政成化学制品有限公司;锌单元素标准液(1000 Ug/mL) 国家有色金属及电子材料分析测试中心;人工胃液(无菌)、人工肠液(无菌)
福州飞净生物科技有限公司;透析袋(3500 Da)苏州达麦迪生物医学科技有限回公司。
Neofuge 15R高速冷冻离心机 上海力申科学仪器有限公司;SG2便携式pH计 梅特勒-托利多仪器(上海)有限公司;DSHZ-300A水浴恒温振荡器
苏州培英实验设备有限公司;LyoBeta 25冷冻干燥机 泰事达机电设备(上海)有限公司;UV1780紫外可见分光光度计、AA-6880原子分光光度计 日本岛津仪器公司;Tensor27 &Tensor37红外光谱仪
布鲁克光谱仪器公司;TGA2(SF)热重分析仪 梅特勒-托利多中国;Nano ZS90 Zeta电位分析仪 英国马尔文仪器有限公司;PA Nalytical X射线衍射仪荷兰帕纳科公司。
1.2 实验方法
1.2.1 硫酸软骨素螯合锌的制备 将硫酸软骨素溶于50 mL蒸馏水中,调节螯合反应温度、pH,条件稳定后加入5 g七水合硫酸锌进行螯合,10000 r/min,4 ℃下离心10 min去除沉淀,取上清液。在4 ℃条件下,向上清液中加入3倍体积的无水乙醇进行醇沉处理,醇沉时间为2 h,取醇沉样将其冷冻干燥即得硫酸软骨素螯合锌样品[14]。
1.2.2 单因素实验
1.2.2.1 pH对锌螯合率的影响 称取硫酸软骨素、七水合硫酸锌,使反应体系中七水合硫酸锌的质量分数为10%,硫酸软骨素与七水合硫酸锌的质量比1:1,设定反应温度50 ℃,调节pH(3、4、5、6、7),反应时间2 h,得硫酸软骨素螯合锌溶液,经乙醇醇沉、冷冻干燥,制得硫酸软骨素螯合锌固体样品,并测定样品锌螯合率。
1.2.2.2 反应时间对锌螯合率的影响 称取硫酸软骨素、七水合硫酸锌,使反应体系中七水合硫酸锌的质量分数10%,硫酸软骨素与七水合硫酸锌的质量比1:1,设定反应温度50 ℃,pH4,分别反应0.5、1、2、4和6 h,得硫酸软骨素螯合锌溶液,经乙醇醇沉、冷冻干燥,制得硫酸软骨素螯合锌固体样品,测定样品锌螯合率。
1.2.2.3 硫酸软骨素与七水合硫酸锌质量比对锌螯合率的影响 称取硫酸软骨素、七水合硫酸锌,使反应体系中七水合硫酸锌的质量分数10%,硫酸软骨素(m1)与七水合硫酸锌(m2)的质量比分别为0.1:1、0.5:1、1:1、2:1和5:1,设定反应温度50 ℃,pH4,反应时间2 h,得硫酸软骨素螯合锌溶液,经乙醇醇沉、冷冻干燥,制得硫酸软骨素螯合锌固体样品,测定样品锌螯合率。
1.2.2.4 反应温度对锌螯合率的影响 称取硫酸软骨素、七水合硫酸锌,使反应体系中七水合硫酸锌的质量分数10%,硫酸软骨素与七水合硫酸锌的质量比1:1,设定反应温度(20、30、40、50、60 ℃),pH4,反应时间2 h,得硫酸软骨素螯合锌溶液,经乙醇醇沉、冷冻干燥,制得硫酸软骨素螯合锌固体样品,测定样品锌螯合率。
1.2.3 正交试验 根据单因素实验结果,设定七水合硫酸锌质量分数10%,选取pH、反应时间(h)、硫酸软骨素与七水合硫酸锌的质量比(m1:m2)、反应温度(℃)为试验考察因素,锌的螯合率为考察指标,设计4因素3水平L9(34)的正交试验确定硫酸软骨素螯合锌的最佳螯合工艺。试验因素及水平见表1。

表1 正交试验因素及水平Table 1 Factors and levels of orthogonal experiment
1.2.4 锌螯合率的测定 参照GB 5009.14-2017《食品中锌的测定》中火焰原子吸收法测定单因素实验及正交试验中硫酸软骨素螯合锌样品中锌的含量。按照公式(1)计算锌的螯合率。

式中:X为锌螯合率(%),M为螯合物中锌的含量(g),M0为反应体系中锌的总含量(g)。
1.2.5 硫酸软骨素螯合锌结构表征
1.2.5.1 紫外光谱分析 分别称取硫酸软骨素螯合锌冻干样品、硫酸软骨素样品和硫酸锌样品溶于蒸馏水中,配成1 mg/mL溶液,用紫外-可见光分光光度计在200~600 nm波长范围内进行紫外光谱扫描[15]。
1.2.5.2 红外光谱分析 采用溴化钾压片法,按照1:100比例分别将硫酸软骨素螯合锌冻干样品、硫酸软骨素样品和硫酸锌样品与溴化钾研磨均匀,制成半透明状薄片,溴化钾做测试对照,在400~4000 cm−1范围内进行红外光谱扫描[16]。
1.2.5.3 扫描电镜分析 分别将硫酸软骨素螯合锌冻干样品和硫酸软骨素样品用导电胶粘结在铝制样品座上,放置于真空镀膜机内,样品表面喷金镀膜,在扫描电镜下观察样品微观形态并照相。放大倍数为3000倍和24000倍[16]。
1.2.5.4 热重分析 分别称取硫酸软骨素样品和硫酸软骨素螯合锌样品,温度由30 ℃升至600 ℃,以10 ℃/min的速率升温,在氮气通量为50 mL/min环境下进行热重分析。以温度为X轴,以质量损失率(某一温度下质量损失后样品的实测质量与样品总质量的比值)为Y轴,绘制热重变化曲线[17]。
1.2.5.5 X射线衍射分析 将硫酸软骨素螯合锌样品、硫酸软骨素样品和硫酸锌样品分别用玛瑙研钵研至无颗粒感为佳,装入制样框,插入样品台,设置CuKα射线,在5~80°衍射角度范围内进行连续扫描,确定结构信息[18]。
1.2.6 硫酸软骨素螯合锌生物利用率
1.2.6.1 体外模拟胃肠道消化吸收 模拟胃消化:分别取10 mg/mL的硫酸软骨素螯合锌和硫酸锌溶液,用1 mol/L盐酸调节溶液pH到2,向溶液中加入5 mL模拟胃液,放置于37 ℃水浴中振荡2 h,反应结束后,将溶液置于100 ℃水浴中10 min灭酶。模拟肠吸收:取胃消化液,用0.1 mol/L氢氧化钠调节pH到7,向溶液中加入5 mL模拟肠液,将混合溶液装入透析袋中(3500 Da),放置于37 ℃水浴中震荡2 h,反应结束后,将溶液置于100 ℃水浴中10 min灭酶[19]。
1.2.6.2 锌离子溶解率的测定 分别测定模拟胃消化溶液和模拟肠吸收溶液中锌离子的溶解率。取两种溶液10000 r/min离心10 min,采用1.2.4中锌含量测定方法,分别测定上清液中锌离子的含量和溶液中总锌离子的含量。按照公式(2)计算锌离子溶解率。

式中:C1为上清液中锌离子的浓度(mg/mL),C2为溶液中锌离子的浓度(mg/mL)。
1.2.6.3 锌离子透过率的测定 测定模拟肠吸收溶液中锌离子的透过率。模拟膜吸收结束后,分别测定透析袋外的溶液中锌离子的含量和溶液中总锌离子的含量。按照公式(3)计算锌离子透过率。

式中:C1为透析袋外锌离子的浓度(mg/mL),C2为溶液中锌离子的浓度(mg/mL)。
1.3 数据处理
文中单因素实验数据及正交试验数据均进行三次平行实验(n=3),取平均值,数据表示为±S(S:标准差)。采用SPSS软件进行方差分析(ANOVA),不同字母代表差异显著(P<0.05),用Origin 9.1软件完成作图。
2 结果与分析
2.1 单因素实验结果
2.1.1 pH对锌螯合率的影响 由图1可知,随着pH增大,锌螯合率先上升后下降,pH4时锌螯合率最高(78.68%±1.04%)。pH小于4时,体系中存在大量氢离子,氢离子与锌离子争夺供电基团[20],不利于螯合反应进行;pH大于4时,锌离子的螯合能力减弱,优先与体系中的氢氧根离子形成氢氧化锌沉淀,使得锌离子不能充分与硫酸软骨素进行螯合反应[21]。测定硫酸软骨素螯合锌在不同pH时的电位值,pH3(ζ=20.5 mV)>pH4(ζ=15.8 mV)>pH5(ζ=−7.3 mV)>pH6(ζ=−16.7 mV)>pH7(ζ=−23.6 mV),推测螯合物的等电点(PI)[22]位于4附近,此时,锌离子与硫酸软骨素形成螯合物后更有利于聚集反应发生。因此,在后续实验中选择反应pH为4。

图1 pH对锌螯合率的影响Fig.1 Effect of pH on the chelation rate of zinc
2.1.2 反应时间对锌螯合率的影响 由图2可知,在0.5~2 h范围,随着反应时间增加,硫酸软骨素与锌离子的结合更为充分,锌螯合率显著上升(P<0.05),反应时间为2 h时,锌螯合率达到最高(71.39%±0.81%),当反应时间继续增加时,锌螯合率呈现下降态势。其主要原因是,在酸性的反应体系中,若反应时间过长,反应体系稳定性降低,极易引起螯合物中的糖苷结构断裂[23]或硫酸基水解[24],影响螯合物的结构稳定性,导致锌螯合率降低[25−26]。因此,在后续实验中选择反应时间为2 h。

图2 反应时间对锌螯合率的影响Fig.2 Effect of reaction time on the chelation rate of zinc
2.1.3 硫酸软骨素与七水合硫酸锌质量比对锌螯合率的影响 由图3可知,硫酸软骨素与七水合硫酸锌质量比在0.1:1~1:1范围内时,锌螯合率呈现增大趋势,在比值为1:1时,锌螯合率最高(78.73%±1.55%),在比值大于1:1时,锌螯合率呈现下降趋势。增加硫酸软骨素在体系中的占比,可以增加反应物的接触几率,更易形成环状螯合结构,提高螯合率,但硫酸软骨素与锌离子结合的位点有限[27],加入过多硫酸软骨素不仅使螯合液过于黏稠,不利于反应进行,同时也会影响螯合物形成环状结构,降低螯合率[28]。在质量比为1:1时,与锌离子作用的硫酸软骨素结合位点达到饱和状态。因此,在后续实验中选择硫酸软骨素与七水合硫酸锌质量比为1:1。

图3 质量比对锌螯合率的影响Fig.3 Effect of mass ratio on the chelation rate of zinc
2.1.4 反应温度对锌螯合率的影响 由图4可知,反应温度对锌螯合率的影响较为显著。锌螯合率随着反应温度的升高呈现先升后降的趋势。反应体系在较低温度范围(20~30 ℃)时,锌螯合率呈现升高态势。其主要原因可能是,从动力学角度分析,升高温度有利于分子间运动,增加硫酸软骨素与锌离子的结合几率,有利于螯合反应的进行[29]。从空间结构角度讲,在相对适宜的温度范围内,糖链结构较为舒展,与锌离子的结合位点暴露的较多[30]。反应温度为30 ℃时,锌螯合率最高(75.74%±3.71%)。由于螯合反应为放热反应,当反应温度继续升高时,阻碍了螯合反应的进行。同时温度过高,致使硫酸软骨素结构稳定性变差,分子间易发生聚团现象,导致与锌离子的结合位点减少[31],锌螯合率降低。因此,在后续实验中选择反应温度为30 ℃。
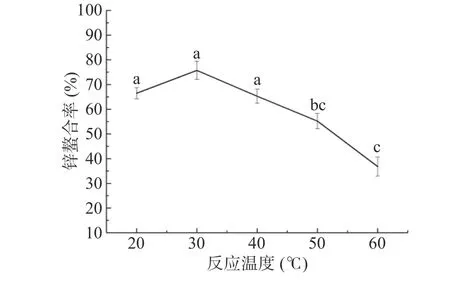
图4 反应温度对锌螯合率的影响Fig.4 Effect of reaction temperature on the chelation rate of zinc
2.2 正交试验设计
正交试验结果和方差分析结果如表2和表3所示。由表2可知,4因素对锌螯合率的影响大小的顺序依次为C>D>A>B,即硫酸软骨素与七水合硫酸锌质量比影响最大,其次是反应温度,pH次之,反应时间的影响最小[32]。通过比较各因素的均值大小确定最佳反应组合A2B1C2D2,即pH4,反应时间1 h,硫酸软骨素与七水合硫酸锌质量比1:1,反应温度30 ℃。由表3可知,4因素中质量比对锌螯合率的影响显著(P<0.05),而pH、时间及温度对锌螯合率的影响不显著(P>0.05)。选取正交试验最佳工艺A2B1C2D2,在此实验条件下开展验证实验,所得锌螯合率为(80.6%±1.31%),优于所有正交试验及单因素实验结果,验证实验成功。

表2 正交实验设计及结果Table 2 Orthogonal design and results

表3 正交试验方差分析结果Table 3 Orthogonal test results of variance analysis
2.3 硫酸软骨素螯合锌结构表征
2.3.1 紫外光谱分析 如图5所示,硫酸软骨素的最强吸收峰在204 nm,该峰为多糖的特征吸收峰,是多糖中的发色基团发生电子跃迁引起[33],硫酸软骨素螯合锌的多糖特征吸收峰出现在212 nm。吸收峰蓝移是由于锌离子结合在氧原子和氮原子上导致了n→π﹡跃迁[34]。同时,硫酸软骨素在255 nm处出现一弱吸收峰,与锌离子螯合之后,吸收峰蓝移至260 nm。这是锌离子与多糖分子中的发色基团结合后,基团偏振的结果[35]。此外,硫酸软骨素螯合锌的吸光度明显强于硫酸软骨素,原因可能是锌离子结合后导致的电荷转移[36]。硫酸锌在200~600 nm近紫外-可见光区未显示特征吸收。紫外光谱表明锌离子与硫酸软骨素结合形成了螯合物,吸收峰的蓝移及强度变化表明发色基团与锌离子螯合过程中发生了极化变化。

图5 硫酸软骨素螯合锌及硫酸软骨素和硫酸锌的紫外光谱图Fig.5 UV spectra of chondroitin sulfate chelated zinc,chondroitin sulfate and zinc sulfate
2.3.2 红外光谱分析 为进一步研究分子结构的变化,采用红外光谱研究了分子振动和不同原子间的极性键,如图6所示。硫酸软骨素螯合锌的红外光谱在参数和形状上与硫酸软骨素类似。3591.08 cm−1处为硫酸软骨素羟基的伸缩振动峰,与锌螯合后,该峰红移至3556.30 cm−1,这是由于感应效应或偶极场效应改变了羟基的电子云密度[37],与Wang等[38]的报道一致。1658.35和1425.74 cm−1处为硫酸软骨素羧基中羰基的特征伸缩振动峰,与锌螯合后,该峰分别红移至1647.04和1418.18 cm−1,说明羧基参与了螯合物的形成[39];1256.78和1043.61 cm−1处为硫酸软骨素磺酸基的非对称拉伸振动峰和对称拉伸振动峰,与锌螯合后,该峰分别移动至1239.53和1114.16 cm−1,说明磺酸基参与了螯合反应[40]。硫酸软骨素螯合锌图谱的指纹区617.02 cm−1处有一弱吸收峰,推测为Zn-O的弯曲振动峰。红外光谱结果表明,锌离子与硫酸软骨素成功配位,这种吸收峰的位移和强度变化,可能是Zn-O键形成和配合物物理吸附的结果[41]。
2.3.3 扫描电镜分析 采用扫描电镜观察硫酸软骨素及硫酸软骨素螯合锌的微观形貌结构差异,如图7所示。放大3000倍可以看到,如图7A、图7B所示。二者都为不规则颗粒体,硫酸软骨素表面光滑,呈现层状结构;硫酸软骨素螯合锌表面较粗糙,呈现颗粒的凹凸状态。放大24000倍可看到,如图7C、图7D所示。硫酸软骨素的结构松散,有许多不规则尺寸空腔,与报道的多糖表面形态一致[42];硫酸软骨素螯合锌则呈现颗粒状的紧密结构,主要原因可能是锌与硫酸软骨素之间形成配位键改变了内部结构,导致结构致密[43]。由此推测,硫酸软骨素螯合锌与硫酸软骨素的形貌区别是由于锌离子与硫酸软骨素发生了螯合反应,形成了硫酸软骨素螯合锌的微颗粒导致的。

图7 硫酸软骨素螯合锌及硫酸软骨素的扫描电镜图Fig.7 SEM spectra of chondroitin sulfate chelated zinc and chondroitin sulfate
2.3.4 热重分析 利用热重分析法分析热稳定性差异,如图8A、图8B所示。根据热重分析的结果,硫酸软骨素及硫酸软骨素螯合锌的失重均分为三个阶段。第一阶段30~150 ℃,质量损失是失水所致。硫酸软骨素质量损失率15.39%;相比之下,硫酸软骨素螯合锌质量损失率18.69%,说明硫酸软骨素螯合锌分子中的结晶水散失率大于硫酸软骨素。第二阶段

图8 硫酸软骨素(A)及硫酸软骨素螯合锌(B)的热重曲线图Fig.8 Thermogravimetric curve of chondroitin sulfate(A) and chondroitin sulfate chelated zinc(B)
150~300 ℃,主要是由样品化学键和基本结构的热降解[44]引发的。此阶段,硫酸软骨素质量损失率29.55%;相比之下,硫酸软骨素螯合锌质量损失率18.26%,原因可能是硫酸软骨素与锌离子形成了配位键,破坏化学键需要更多能量[45]。第三阶段300~600 ℃,硫酸软骨素质量损失率15.59%,推测是多糖已经碳化,从而导致失重缓慢[46];相比之下,硫酸软骨素螯合锌质量损失率20.68%,并在504.17 ℃时失重迅速,可能是由于硫酸软骨素螯合锌出现结晶度,熔点向更高温度移动[47]。以上结果表明,硫酸软骨素和硫酸软骨素螯合锌的热力学性能有很大不同,与硫酸软骨素相比,硫酸软骨素螯合锌是一种更稳定的物质,这与Zhang等[48]对多糖锌螯合物的热稳定性研究结果一致。
2.3.5 X射线衍射分析 通过X射线衍射分析反映物质的晶体结构信息,如图9所示。硫酸锌有明显的结晶衍射峰,分别在17.92°、20.22°、22.09°等三处有强衍射峰,并且出现多个小峰。硫酸软骨素为非晶态结构,不具有周期性结构,只能观察到衍射值最大所对应的漫反射区[49],呈现“馒头”状。硫酸软骨素螯合锌与硫酸软骨素有着显著差别,在“馒头”峰区域19.56°、27.11°等两处出现明显的尖峰,说明硫酸软骨素与锌螯合后,在空间结构上产生新的相互作用力,形成了有序晶体结构[39]。硫酸软骨素螯合锌并不包含硫酸锌的特征衍射峰,说明锌与硫酸软骨素螯合后广泛分布于糖链中。
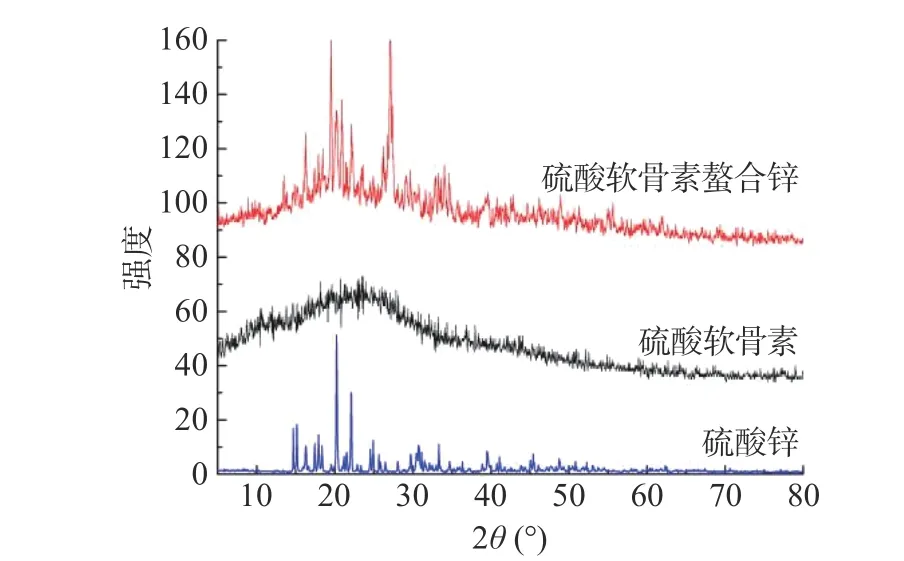
图9 硫酸软骨素、硫酸锌及硫酸软骨素螯合锌的X射线衍射图Fig.9 X-ray diffraction pattern of chondroitin sulfate,zinc sulfate and chondroitin sulfate chelated zinc
2.4 硫酸软骨素螯合锌生物利用率分析
以硫酸锌作为参照,评价硫酸软骨素螯合锌在胃肠道环境中的生物利用率,如图10所示。硫酸软骨素螯合锌和硫酸锌在胃消化阶段的锌溶解率分别为(94.86%±1.02%)、(91.53%±0.87%)。当转移至肠消化阶段时,二者的锌溶解率分别为(63.01%±2.56%)、(39.83%±1.41%),锌透过率分别为(33.86%±1.68%)、(16.39%±2.42%)。在胃消化阶段,酸性环境有利于锌离子的释放和溶解[50],硫酸软骨素螯合锌和硫酸锌均有较好的溶解性。在肠消化阶段,硫酸锌的锌溶解率及锌透过率均不及硫酸软骨素螯合锌,这是由于在肠液较高的pH环境中,硫酸锌易形成不溶性的锌化合物[51],而肠道无法吸收。硫酸软骨素螯合锌因其较稳定的配位键,在胃肠环境中的溶解性和稳定性比硫酸锌有明显优势,并能以螯合物分子的形式透过肠道屏障[13],比硫酸锌更易被胃肠消化吸收,生物利用率更高,与Yonekura等[52]研究壳聚糖可提高体内锌生物利用度的结果一致。

图10 体外模拟实验中硫酸软骨素螯合锌与硫酸锌的生物利用率Fig.10 Comparison of bioavailability between chondroitin sulfate chelated zinc and zinc sulfate in vitro simulation experiment
3 结论
本研究以硫酸软骨素和硫酸锌为原料,利用螯合反应制备了一种新型补锌剂硫酸软骨素螯合锌。通过单因素实验及正交试验确定硫酸软骨素螯合锌的最佳制备条件为:pH4,反应时间1 h,硫酸软骨素与七水合硫酸锌质量比1:1,反应温度30 ℃,此条件下锌螯合率为80.6%±1.31%,硫酸软骨素表现出良好的锌螯合能力。紫外光谱证实锌离子可以有效地与硫酸软骨素结合,红外光谱进一步证明锌离子与硫酸软骨素螯合形成了Zn-O,螯合位点为羟基氧、羧基氧、磺酸基氧。扫描电镜、热重分析及X射线衍射分析结果表明,与锌离子螯合,导致硫酸软骨素的结构发生变化,形成了更为稳定的晶体结构和微颗粒的聚集。体外模拟消化吸收实验证明,硫酸软骨素螯合锌在胃肠中的溶解率与透过率均优于硫酸锌,具有良好的生物利用率。硫酸软骨素与锌离子的有效结合,不仅保留了硫酸软骨素所具有的生物学功能,又有补锌功效,有望开发成一种具有多种保健功能的生物多糖型补锌剂。
