碘化丙啶染色流式细胞术分析肿瘤细胞凋亡的方法学探讨
2012-11-23曹慧玲
李 妍,王 海,张 铎,李 瑶,曹慧玲
(1.吉林医药学院检验学院,吉林 吉林132013;2.吉林大学中日联谊医院检验科,吉林 长春130033;3.吉林医药学院科研处,吉林 吉林132013)
针对凋亡细胞的生物化学改变[1],已经建立了多种基于FCM来检测凋亡的方法。其中,碘化丙啶单染(propidium iodide,PI)单染法和 PI/AnnecxinⅤ 双染法应用最为广泛[2]。双染法可精确区分早期凋亡、晚期凋亡和坏死细胞。虽然PI单染法仅能检测到晚期凋亡和坏死细胞,但因操作简单、试剂廉价,更适合样本量大的预实验或新药筛选。实践中发现,细胞培养、收集和染色等环节,存在多处影响检测结果的因素。本文以贴壁生长的Hela为例,从样品制备的角度出发,讨论影响PI染色检测凋亡的因素。
1 材料与方法
1.1 材料
人宫颈癌细胞Hela引自美国典型物种保藏中心,去甲斑蝥素(norcantharidin,NCTD)购自国家标准物质中心,胰蛋白酶(trypsin)、乙二胺四乙酸(EDTA)二钠、PI和 Triton X-100和台盼蓝购自Sigma公司(美国)。RNase A购自碧云天生物技术研究所(上海)。1640培养液购自GBICO公司(美国),小牛血清购自浙江黄岩四季青生物技术公司。
1.2 试剂配制
1.2.1 Trypsin-EDTA 消化液 分别用pH7.4的0.01mol/L PBS配制5mg/ml trypsin溶液和2 mg/ml的 EDTA 溶液(用0.05mol/L NaOH 调pH为7.4),0.22μm 的滤器过率除菌后-20℃储存。取两种储存液各1ml,加入无菌的8ml PBS配制为含0.5mg/ml trypsin和0.2mg/ml EDTA的消化液,该消化液中胰酶含量为通用消化的1/5。
1.2.2 PI染色液 用 PBS配制储存液:10mg/ml PI,2%的 Triton X-100和20×10-3mol/L 的RNase A。使用PBS稀释储存液配制PI染色液:0.05mg/ml PI,0.2%Triton X-100和20×10-6mol/L的RNase A。
1.2.3 固定液配制 用去离子水配制80%的甲醇溶液,-20℃储存备用。
1.3 细胞培养与药物处理
用含10%小牛血清的1640培养液,在5%CO2、37℃和饱和湿度条件下培养Hela细胞,取对数生长期细胞用于实验。调细胞密度为5×104/ml,药物处理前16h接于培养瓶(底面积25cm2),每瓶液体量为10ml,细胞数为5×105个。取PBS配制NCTD储存液(20mmol/L),分别按终浓度为0,5,10和20μmol/L加入培养瓶,继续培养24h。
1.4 样品制备
按照如下步骤收集细胞。①将培养液转移到50ml离心管。②5ml PBS冲洗培养瓶2次,液体转入相同的50ml离心管。③加入1ml trypsin-EDTA消化液(室温或37℃),摇动培养瓶,使其均匀分布。④倒置显微镜下观察,待细胞边缘开始卷缩,立即吸取适量离心管液体,加入培养瓶来终止消化,弯头吸管轻柔吹打后将液体转到离心管。⑤离心收集细胞,并用10ml PBS洗涤细胞1次。⑥适当体积PBS重悬细胞,取50μl细胞悬液,加入等量台盼蓝染液(0.4%),染色2min后以血细胞计数板计数细胞,计算细胞活力(活细胞白分率)。⑦取1×106个细胞,通过离心弃去PBS,边震摇边加入5ml 80%冷甲醇溶液固定细胞,-20℃保存,16h后可用进行染色分析,保存时间为2~4周。⑧离心弃去固定液,5ml PBS洗涤细胞2次。⑨末次离心弃去PBS后(残液量约为100μl),边震摇边加入500μl PI染色液,室温、避光处理30min。⑩300目尼龙网过滤细胞后,上流式细胞仪分析。
1.6 统计学分析
2 实验结果
采用CXP 2.1软件分析细胞周期和凋亡:前向散射光(FSC)和侧向散射光(SSC)散点图中设A门(图1A);AUX(颗粒相对面积)和FL3(PI荧光)散点图中设多边型门B(图1B);FL1(PI)直方图中分析细胞周期和凋亡,与对照组比较20μmol/L NCTD导致Hela细胞G2/M期比例增加,同时诱导细胞凋亡(图1C和图1D)。Hela细胞凋亡和G2/M期细胞百分率均随NCTD浓度增加而增加(表1)。
3 讨论

图1 PI染色流式细胞术分析Hela细胞凋亡
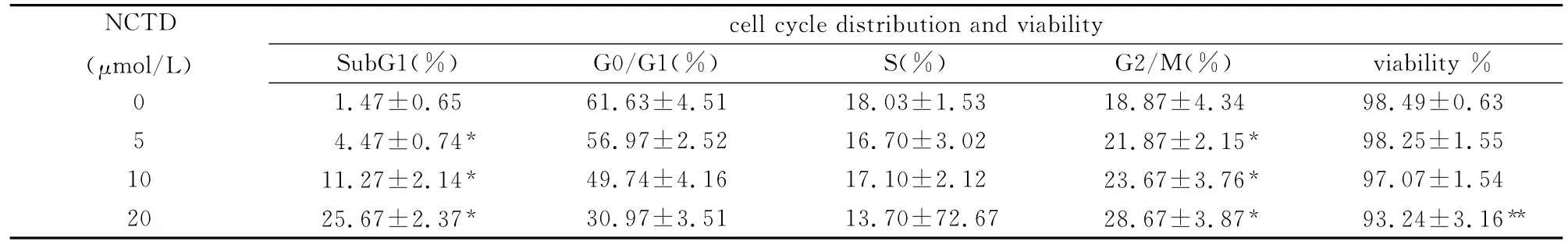
表1 NCTD对Hela细胞凋亡和周期的影响
细胞凋亡是生命科学研究的热点之一,针对凋亡细胞形态学和生化化学改变已建立多种检测细胞凋亡的方法。凋亡细胞PS翻转,活细胞和早期凋亡时细胞膜通透性未改变,晚期凋亡和坏死时细胞通透性增加;AnnecxinⅤ-FITC可结合PS,PI不能进入活细胞和早期凋亡细胞。PI/AnnecxinⅤ 双染法利用上述原理,可精确区分早期凋亡、晚期凋亡和坏死细胞,但试剂成本高,不适合新药筛选等工作。除血液来源肿瘤为悬浮生长,更多的实体肿瘤为贴壁生长。贴壁生长细胞或实体瘤在分析前需经消化、刮取或剪切处理过程,膜表面的PS等分子可部分脱落,从而影响凋亡分析[3]。处理过程也可能导致细胞膜通透性增加,改变早期凋亡、晚期凋亡和坏死细胞的比例,但PI染色法不受影响上述因素影响。目前,部分流式细胞仪配备了自动上样装置,PI单染法可做为药学研究的高通量筛选方法。
本研究以Hela细胞,对样品制备和PI染色关键环节加以优化,主要包括如下几方面。①选用低浓度PI来降低染色液的黏度,防止待检过程中细胞间的黏附和沉降。②根据细胞生长特点,合理设定接种细胞的密度,过高的密度下细胞间“接触抑制”影响周期,或因营养因子缺乏而导致细胞凋亡、坏死[4]。③避免残留培养液对消化液的灭活,温和、快速消化收集细胞。④收集培养上清中非贴壁的细胞,避免丢失处于分裂期或部分凋亡、坏死的细胞。⑤精确控制标本中细胞数目,使样本间PI分子与DNA结合效率一致。⑥综合分析凋亡率和细胞活力,判断药物对细胞的效应。改进方法清晰、稳定地检测到NCTD诱导细胞凋亡,与双染法分析结果具有一致的趋势[5]。本研究从制备样品的角度出发,优化了PI单染检测凋亡的方法。
[1]陈朱波,曹雪涛.流式细胞术:原理、操作及应用[M].北京:科学出版社,2010.
[2]Li Y,Wang R,Ma E,et al.The induction of G2/M cell-cycle arrest and apoptosis by cucurbitacin E is associated with increased phosphorylation of eIF2alpha in leukemia cells[J].Anticancer Drugs.2010,21(4):389.
[3]贾永蕊.曹雪涛.流式细胞术[M].北京:化学工业出版社,2010.
[4]Meshram M,Naderi S,McConkey B,et al.Population-based modeling of the progression of apoptosis in mammalian cellculture[J].Biotechnol Bioeng,2010,109(5):1193.
[5]An WW,Gong XF,Wang MW,et al.Norcantharidin induces apoptosis in HeLa cells through caspase,MAPK,and mitochondrial pathways[J].Acta Pharmacol Sin,2004 ,25(11):1502.
