PTTG基因沉默对人胰腺癌细胞PANC-1细胞增殖的影响
2012-11-23姜海容
王 宁,姜海容,刘 洁,阎 英
(1.沈阳军区总医院 放疗科,沈阳110015;2.长春市中心医院 肿瘤科,长春130051;3.中国医科大学实验技术中心,沈阳110001)
垂体瘤转化基因(pituitary tumor transforminggene,PTTG)与多种肿瘤的发生发展关系密切[1]。近来有研究证实人胰腺癌中PTTG也存在高表达[2],但PTTG对胰腺癌细胞增殖及调控机制的研究未见报道。本研究利用小干扰RNA下调PTTG基因表达,观察其对细胞增殖的影响。
1 实验材料
1.1 材料
人胰腺癌PANC-1由中科院上海细胞生物研究所提供。siRNA-PTTG和阴性对照siRNA由Qiagen公司设计合成。
1.2 方法
1.2.1 实验分组及基因沉默效应检查 将PANC-1细胞分为3组(①.未转染PANC-1细胞、②.转染阴性对照siRNA、③转染siRNA-PTTG)。基因沉默效应检查详见另文[3]。
1.2.2 形态观察及细胞增殖测定 倒置显微镜观察不同转染组细胞形态学变化。胰酶消化对数生长期细胞制备单细胞悬液,浓度为1×105个/ml,96孔板每孔接种100μl细胞悬液,5%CO2,37℃孵育24 h后,吸去培养上清,用无血清opti-MEM轻洗两次后进行基因沉默,6h后换上新鲜细胞培养液100 μl/孔,分别收集转染后24h、48h、72h和96h的细胞,距离时间点结束4h时小心吸去上清,加入80μl无血清培养液,再加入2 0μl MTT溶液(5mg/ml)继续培养4h,然后吸掉上清,每孔加入150μl二甲基亚砜,摇床低速振荡10min,充分溶解结晶物,混匀后于酶标仪于570nm处读取各孔吸光度(A570值),每组设定5个复孔。
1.2.33H-TdR测定DNA合成 胰酶消化对数生长期细胞制备单细胞悬液,浓度为1×105个/ml,96孔板每孔接种100μl细胞悬液,5%CO2,37℃孵育24h后,吸去培养上清,用无血清opti-MEM轻洗两次后进行基因沉默,48h后加入1.0μCi/孔3HTdR,继续培养6h,然后收获细胞于玻璃纤维滤膜上,抽洗至少2次,60℃-80℃烤干后,将滤膜放入装有4ml闪烁液的闪烁瓶中,暗处放置15min,MicroBeta Trilux 1450液闪和化学发光检测仪测定各管每分钟脉冲计数(Count percent minute,cpm)计算抑制率。抑制率(%)=(对照组CPM值-实验组CPM值)/对照组CPM值×100
1.2.4 细胞周期分析 转染后48h,收集细胞,用70%乙醇4℃固定24h,加入RNA酶(终浓度50 μg/ml),37℃反应1h,加入碘化丙啶 (PI,100μg/ml)溶液染色20-30min后,在BD流式细胞仪上进行检测分析。
1.3 统计学处理
实验数据用均数±标准差(±s)表示,采用SPSS 11.5统计软件对数据进行处理,多样本均数比较采用单因素方差分析,多样本均数间两两比较用q检验,取P<0.05认为差异有统计学意义。
2 结果
2.1 siRNA-PTTG 对 PANC-1细胞增殖能力的影响
倒置显微镜下可见未转染和转染阴性对照siRNA的PANC-1细胞生长旺盛,形态未见差别,皆为致密贴壁生长多角形,细胞轮廓清晰,伸展良好,折光性强胞浆内未见颗粒和空泡。经siRNA-PTTG处理的PANC-1细胞形态不规则,体积减小,贴壁细胞数量减少,脱落和悬浮细胞增多,细胞质回缩,折光率下降。
转染siRNA-PTTG后各时间点细胞吸光度低于未转染和转染阴性对照siRNA组,差异具有统计学意义(P<0.05);未转染和阴性对照组细胞吸光度值无统计学差异(P>0.05),结果见表1。
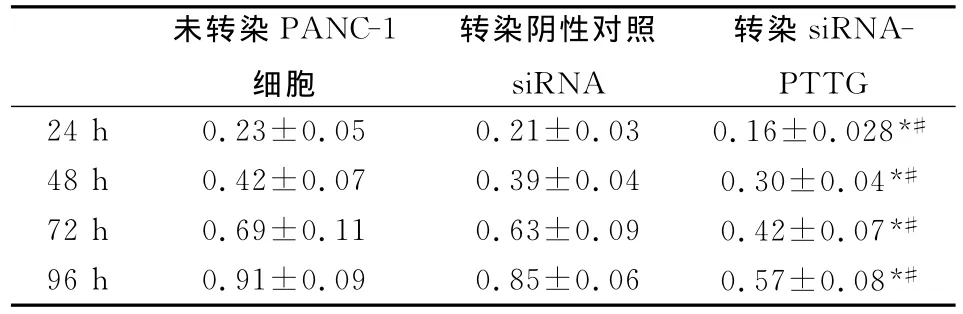
表1 MTT分析不同组PANC-1细胞的吸光度值
2.2 siRNA-PTTG 对3 H-TdR 掺入PANC-1细胞DNA合成的影响
siRNA-PTTG组3H-TdR掺入率的放射性计数明显低于未转染PANC-1细胞和转染阴性对照siRNA组,其DNA合成抑制率为37.87%,差异具有统计学意义(P<0.05)(见表2),表明PTTG基因下调能够抑制细胞DNA合成。
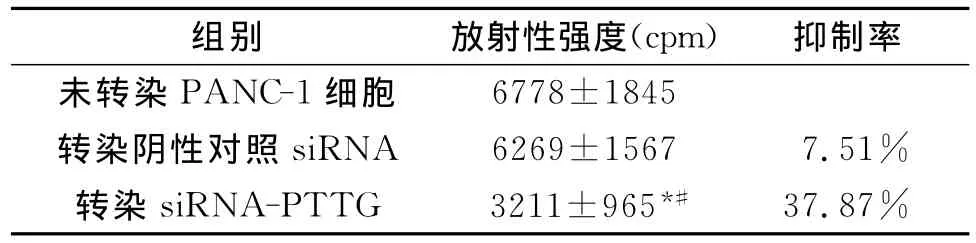
表2 siRNA-PTTG 对3 H-TdR掺入PANC-1细胞DNA合成的影响
2.3 siRNA-PTTG对PANC-1细胞周期的作用
与未转染PANC-1细胞和转染阴性对照siRNA组细胞相比,转染siRNA-PTTG后G0/Gl期细胞百分率升高为58.96±12.14,显著高于阴性对照组的39.42±9.45和未转染 PANC-1细胞组的36.75±10.28,差异具有统计学意义(P<0.05);转染siRNA-PTTG后S期比例下降为28.41±6.78,显著低于阴性对照组的43.39±12.05和未转染PANC-1细胞组的42.21±11.74,差异具有统计学意义(P<0.05),具体结果详见表2。未转染PANC-1细胞和转染阴性对照siRNA相比,G0/G1期及S期比率无统计学差异(P>0.05)。结果提示,siRNA-PTTG显著抑制PANC-1细胞增殖,细胞周期阻抑在G0/G1期,DNA合成显著降低。
3 讨论
胰腺癌是恶性度较高的胃肠道肿瘤,发病率逐年上升,常规治疗方法效果有限,探寻新的治疗方法具有重要意义。随着RNA干扰(RNA interference,RNAi)技术的发展,通过该方法沉默癌基因表达在胰腺癌治疗上显示出巨大的优势[4]。PTTG基因是近年来发现的在多种肿瘤组织中异常表达的一种癌基因[1],其在胰腺癌中的表达高于癌旁组织、胰腺良性肿瘤和正常胰腺组织,并和胰腺癌侵袭,分化相关[5],但尚没有研究证明其和胰腺癌增殖的关系。

表3 siRNA-PTTG对不同实验组细胞周期影响
PTTG与肿瘤细胞增殖关系密切,现有的研究表明其在不同的肿瘤,不同的生理病理条件下,可能发挥不同的作用,结果间存在很大差异。由于PTTG编码的securin具有抑制姐妹染色单体分离的功能,其过表达可能会通过延迟有丝分裂、抑制姐妹染色单体分离从而抑制细胞增殖[6]。还有研究报道其还可通过诱导细胞凋亡实现其抑制细胞增殖的作用[7]。一些动物模型和细胞转染实验均证实如此。研究发现小鼠成纤维细胞系3T3高表达PTTG蛋白可抑制细胞增殖并引起细胞转化,成瘤性降低[8];将hPTTG转染至HeLa和A549细胞,发现细胞增殖受到明显抑制[9]。与此相反,另一些实验却发现PTTG作为一种细胞转化癌基因,具有激活增殖的功能。在垂体腺瘤和平滑肌瘤,PTTG表达与细胞增殖相关标志-增殖细胞核抗原(PCNA)或Ki-67表达高度相关[10,11]。在鼠垂体成瘤模型[12]和甲状腺滤泡癌[13],PTTG缺失可导致垂体和甲状腺细胞增殖减低。垂体细胞、肝细胞、神经胶质瘤细胞系U87和培养的子宫肌瘤细胞中PTTG表达水平与增殖活力成正相关[14,15]。使用基因敲除技术使PTTG缺失的研究也证实在骨髓干细胞、胶质瘤、肉瘤、肝癌和促皮质激素细胞中PTTG具有刺激增殖的作用[16,17]。尽管 Kim 等[13]研究发现 PTTG 可以诱导甲状腺滤泡癌细胞系FTC133增殖,但Saez[18]和Boelaert等[19]的研究则认为PTTG与甲状腺癌细胞增殖之间无相关性。
本研究利用化学合成的siRNA沉默PANC-1细胞内PTTG表达,经RT-PCR和Western blot证实其沉默效应[3]。倒置显微镜下观察发现经siRNA-PTTG处理的PANC-1细胞形态不规则,体积减小,贴壁细胞数量减少,脱落和悬浮细胞增多,细胞质回缩,折光率下降。这些细胞形态学的变化提示经siRNA-PTTG处理后的PANC-1细胞生长受到抑制。MTT比色法结果显示,siRNA-PTTG组各时间点的吸光度值均下降,细胞增殖速度明显降低,而未转染和阴性对照siRNA组增殖速率相近,吸光度无统计学差异。3H-TdR掺入实验表明未转染PANC-1细胞和转染阴性对照组放射性计数明显高于siRNA-PTTG组,表明PTTG基因沉默能够抑制PANC-1细胞DNA合成。细胞周期分析发现,转染siRNA-PTTG后G0/Gl期细胞百分率显著增加,S期显著降低。由此可见,PTTG具有促进体外培养胰腺癌细胞增殖的作用,其表达下调可通过抑制DNA合成导致细胞增殖下降。因此,PTTG有望成为胰腺癌早期诊断和基因治疗的新靶点,但其调控细胞增殖的确切机制和路径仍有待于进一步研究。
[1]Boelaert K,Tannahill LA,Bulmer JN,et al.A potential role for PTTG/securin in the developing human fetal brain[J].FASEB J,2003,17(12):1631.
[2]Zhang ML,Lu S,Zheng SS.Epigenetic changes of pituitary tumorderived transforming gene 1in pancreatic cancer[J].Hepatobiliary Pancreat Dis Int,2008,7(3):313.
[3]王 宁,王冠军,刘 洁.小干扰RNA抑制PTTG基因对人胰腺癌细胞PANC-1侵袭能力的影响[J].中国实验诊断学,2009,13(11):1527.
[4]王唯一,毛振彪,黄介飞.RNA干扰技术在胰腺癌基因治疗中的应用[J].国际消化病杂志,2007,27(4):284.
[5]王雪飞,王立秋.人垂体瘤转化基因在胰腺恶性肿瘤中的表达及其意义[J].中国医药导刊,2010;79(5):839.
[6]Yu R,Cruz-Soto M,Li Calzi S,et al.Murine pituitary tumortransforming gene functions as a securin protein in insulin-secreting cells[J].J Endocrinol,2006,191(1):45.
[7]Tfelt-Hansen J,Kanuparthi D,Chattopadhyay N.The emerging role of pituitary tumor transforming gene in tumorigenesis[J].Clin Med Res,2006,4(2):130.
[8]Stratford AL,Boelaert K,Tannahill LA,et al.Pituitary tumor transforming gene binding factor:a novel transforming gene in thyroid tumorigenesis[J].J Clin Endocrinol Metab,2005,90(7):4341.
[9]Mu YM,Oba K,Yanase T,et al.Human pituitary tumor transforming gene(hPTTG)inhibits human lung cancer A549cell growth through activation of p21(WAF1/CIP1)[J].Endocr J,2003,50(6):771.
[10]Filippella M,Galland F,Kujas M,et al.Pituitary tumour transforming gene(PTTG)expression correlates with the proliferative activity and recurrence status of pituitary adenomas:a clinical and immunohistochemical study[J].Clin Endocrinol(Oxf),2006,65(4):536.
[11]Tsai SJ,Lin SJ,Cheng YM,et al.Expression and functional analysis of pituitary tumor transforming gene-1[corrected]in uterine leiomyomas[J].J Clin Endocrinol Metab,2005;90(6):3715.
[12]Genkai N,Homma J,Sano M,et al.Increased expression of pituitary tumor-transforming gene(PTTG)-1is correlated with poor prognosis in glioma patients[J].Oncol Rep.2006;15(6):1569.
[13]Kim CS,Ying H,Willingham MC,et al.The pituitary tumortransforming gene promotes angiogenesis in a mouse model of follicular thyroid cancer[J].Carcinogenesis,2007,28(5):932.
[14]Yao YQ,Xu JS,Lee WM,et al.Identification of mRNAs that are up-regulated after fertilization in the murine zygote by suppression subtractive hybridization[J].Biochem Biophys Res Commun,2003,304(1):60.
[15]Vlotides G,Cruz-Soto M,Rubinek T,et al.Mechanisms for growth factor-induced pituitary tumor transforming gene-1expression in pituitary folliculostellate TtT/GF cells[J].Mol Endocrinol,2006,20(12):3321.
[16]Cho-Rok J,Yoo J,Jang YJ,et al.Adenovirus-mediated transfer of siRNA against PTTG1inhibits liver cancer cell growth in vitro and in vivo[J].Hepatology,2006,43(5):1042.
[17]Rubinek T,Chesnokova V,Wolf I,et al.Discordant proliferation and differentiation in pituitary tumor-transforming gene-null bone marrow stem cells[J].Am J Physiol Cell Physiol,2007,293(3):C1082.
[18]Saez C,Pereda T,Borrero JJ,et al.Expression of hpttg proto-oncogene in lymphoid neoplasias[J].Oncogene,2002,21(53):8173.
[19]Boelaert K,McCabe CJ,Tannahill LA,et al.Pituitary tumor transforming gene and fibroblast growth factor-2expression:potential prognostic indicators in differentiated thyroid cancer[J].J Clin Endocrinol Metab,2003,88(5):2341.
