胰腺癌细胞中Runx3基因表达及甲基化的研究
2012-11-23邱志东范琳峰雷长江缪辉来
邱志东,范琳峰,雷长江,缪辉来
(广东医学院附属医院 肝胆外科,广东 湛江524001)
胰腺癌是一种恶性程度高,进展迅速,手术切除率低,预后极差的恶性肿瘤,本文从表观遗传学的角度研究Runx3基因在胰腺癌细胞中失表达的机制,以期为胰腺癌的早期诊断及新的治疗方案提供理论依据。
1 材料与方法
1.1 材料
(1)细胞株:Panc-1、BxPC-3、AsPC-1三种胰腺癌细胞株(中国科学院上海生命科学研究院细胞资源中心);(2)主要试剂:DMEM 培养基、RPMI 1640培养基(美国Gibco公司),TRIZOL总RNA提取试剂盒、PrimeScript OneStep RT-PCR Kit Ver.2(大连宝生物公司)、One step sybr primescripttmrtpcr kitⅡ(大连宝生物公司),EZ DNA甲基化试剂盒-direct、Zymo Taqtm PreMix(美国 ZYMO RESEARCH公司),引物、内参(上海生物工程公司、大连宝生物公司),Western封闭液、一抗稀释液、二抗稀释液、一抗二抗去除液、鼠抗人GADPH抗体(碧云天生物技术研究所),小鼠抗人Runx3单克隆抗体(Santa Cruz Biotechnology)。
1.2 方法
(1)细胞培养。(2)RT-PCR检测 Runx3基因的表达:①癌细胞株及胰腺组织中RNA的抽提;②引物序列及产物长度:Runx3上游引物为5′-AGGCATTGCGCAGCTCAGCGGAGT-3′,Runx3 下游 引 物 为 5′-AGGCATTGCGCAGCTCAGCGGAGTA-3′,扩增长度为152bp,β-actin上游引物为 5′-TGGCACCCAGCACAATGAA-3′,β-actin下游引物 为 5′-CT AAGTCATAG TCCGCCTAGAAGCA-3′,扩增长度为186bp,引物均由上海生工合成,引物离心后用0.1%DEPC处理水稀释至所需浓度,-20℃保存;③参照TaKaRa公司的onestep RT-PCR Kit使用说明书进行RT-PCR;④琼脂糖凝胶电泳和图象分析。(3)Westren blotting:①样品制备;②蛋白定量;③SDS-PAGE电泳;④转膜;⑤封闭及抗原抗体反应;⑥化学发光显影、定影及图像分析。(4)甲基化特异PCR:①细胞计数;②贴壁细胞DNA提取;③正常胰腺组织中提取DNA;④引物设计及扩增长度,Runx3基因的甲基化特异性PCR引物用Methprimer软件设计,甲基化引 物 (M)上 游 为:5′-CGTCGGGTTAGCGAGGTTTC-3′,下游为:5′-GCCGCTACCG CGAAAAACGA-3′,扩增长度120bp;非甲基化引物(U)上游为:5′– GTGGGTGG TTGTTGGGTTAGT-3′,下游 引 物 为:5′-TCCTCAACCACCACTA CCACA-3′,扩增长度为138bp,引物均由上海生工合成。⑤甲基化特异性PCR;⑦琼脂糖凝胶电泳实验。
1.3 统计学处理
实验数据用均数±标准差(±s)表示,所有实验至少重复3次。
2 结果
2.1 Runx3基因mRNA表达 RT-PCR检测结果显示在Panc-1、BxPC-3、AsPC-1 3种胰腺癌细胞株中Runx3基因的mRNA电泳未见亮条带,而在正常胰腺组织中Runx3基因的mRNA电泳有亮条带出现(见图2.1);用Quantity One软件测量条带灰度值,以目的基因与β-actin内参条带的光密度积分值之比进行相对定量分析,结果显示正常胰腺组织的值为1.3594±0.0059,而Panc-1、BxPC-3、AsPC-1未测得相对定量值,说明在正常胰腺组织中Runx3基因的mRNA有表达,而在3种胰腺癌细胞株中没有表达。
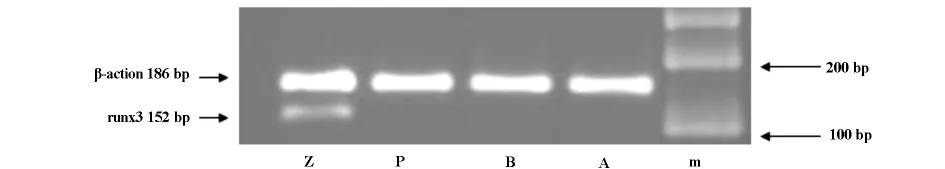
图2.1 RT-PCR凝胶电泳
2.2 Runx3基因蛋白表达 Western blotting法未能检测到 Panc-1、BxPC-3、AsPC-1的 Runx3蛋白表达(图2.2)
2.3 Runx3基因启动子区CpG岛的甲基化 利用MSP检测法显示在 Panc-1、BxPC-3、AsPC-1胰腺癌细胞株中,Runx3基因甲基化引物均扩增出产物,电泳可见120bp处有亮条带,非甲基化引物未扩增出产物;而在正常胰腺组织中Runx3基因非甲基化引物扩增出产物,而甲基化引物则未扩增出引物。

图2.2 Panc-1、BxPC-3、AsPC-1细胞 Runx3蛋白表达水平
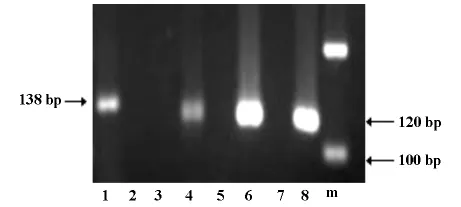
图2.3 正常胰腺组织与各癌细胞株Runx3基因的甲基化情况
3 讨论
胰腺癌的发生与很多因素有关,包括基因水平上的改变和后生修饰的累积效应,如癌基因的激活或抑癌基因的失活。DNA甲基化在基因沉默、基因组印记、X染色体失活和肿瘤形成过程中发挥重要作用。近期研究提示许多抑癌基因启动子区的高甲基化是肿瘤发生过程中基因失活的重要原因,在某些情况下甚至是抑癌基因失活的唯一机制[1,2]。最近的研究表明Runx3可能是一新的抑瘤基因,其在宫颈癌、前列腺癌、胃癌、结直肠癌、胆管癌、胰癌和肺癌等多种肿瘤中有不同程度表达缺失或者下调[3-8]。Wada等用 Northern blotting和 RT-PCR研究显示75%的胰腺癌细胞株Runx3mRNA及蛋白没有发生表达(9/12)[9],但是其原因未明。本研究也未能检测到 Panc-1、BxPC-3、AsPC-1中 Runx3基因mRNA及蛋白表达,而正常胰腺组织可检测到Runx3基因mRNA表达;同时我们通过MSP方法检测了正常胰腺组织和人胰腺癌细胞株,发现Panc-1、BxPC-3、AsPC-1癌细胞中均检测到Runx3基因启动子CpG岛发生甲基化,而正常胰腺组织中Runx3基因启动子CpG岛没有出现甲基化现象,由此我们大胆推测,Runx3基因在胰腺癌细胞中的失表达可能与Runx3基因启动子CpG岛发生甲基化有关。
众所周知,胰腺癌恶性程度高,易转移且预后较差,手术切除是治疗胰腺癌的主要手段,但很多胰腺癌患者在确诊后就丧失了根治性切除的机会,而作为晚期胰腺癌的一线化疗药物吉西他滨,接受其单药治疗患者的中位生存期仅为6个月左右,并且吉西他滨与其他化疗药物联合应用并不能延长患者的生存期[10]。改变基因表观遗传学是目前一种新的临床治疗癌症的方法,本研究发现Runx3基因在胰腺癌细胞中的失表达可能与Runx3基因启动子CpG岛发生甲基化有关,那么如果能够使Runx3基因启动子CpG岛发生去甲基化,是否就能使Runx3基因重新表达,从而起到治疗肿瘤的作用?这是进一步研究的重点。
[1]Jones PA,Takai D.The role of DNA methylation in mammalion epigenetics[J].Science,2001,293(5532):1068.
[2]Ehrlich M.DNA methylation in cancer:too much,but also too little[J].Oncogene,2002,21(35):5400.
[3]Kang S,kim JW,Kang GH,et al.Polymorphism in folate-and methionine-metabolizing enzyme and aberrant CPG island hypermethylation in uterine cervical cancer[J].Gynecologic Oncology,2005,96(1):173.
[4]肖文华,刘为纹.肝细胞癌RUNX3基因甲基化与杂合缺失的分析及意义[J].中华肝脏病杂志,2004,12(4):227.
[5]Takahashi T,Shivapurkar N,Riquelme E,et al.Aberrant promoter hypermeth-ylation of multiple genes in gallbladder carcinoma and chronic cholecystitis[J].Clin Cancer Res,2004,10:6126.
[6]Sakakijra C,Hagiwara A,Miyagawa K,et al.Frequent downregulation of the runt domain transcription factors RUNX1,RUNX3 and their cofactor CBFB in gastric cancer[J].International Journal of Cancer,2005,113(2):221.
[7]Nomoto S,Kinoshita T.Mori T,et al.Adverse prognosis of epigenetic inactiv-ation in RUNX3gene at 1p36in human pancreatic cancer[J].British Journal of Cancer,2008,98(10):1690.
[8]Peng Z,Tang H,Wang X,et al.Inhibition of the growth and metastasis of human colon cancer by restoration of RUNX3expression in cancer cells[J].International journal of oncology,2008,33(5):979.
[9]Wada M,Yazumi S,Takaishi S,et al.Frequent loss of Runx3 gene expression in human bile duct and pancreatic cancer cell lines[J].Oncogene,2004,23(13):2401.
[10]Louvet C,Labianca R,Hammel P,et al.Gemcitabine in combination with oxaliplatin compared with gemcitabine alone in locally advanced or metastatic pancreatic cancer:results of a GERCOR an d GISCAD phaseⅢtrial[J].J Clin Oncol,2005,23(15):3509.
