Klotho基因转染促进脂肪间充质干细胞增殖的实验研究
2012-11-23郑永霞肖燕萍
韩 冬,徐 煌,郑永霞,肖燕萍
(嘉兴学院医学院,浙江 嘉兴314001)
ADSCs(adipose-derived stem cells,脂肪间充质干细胞),是一类存在于脂肪基质中,具有自我更新能力和多分化潜能的成体干细胞。ADSCs取材方便,是细胞治疗的良好种子细胞来源[1]。klotho是一种抗衰老基因,其基因缺陷型动物出现多种过早衰老的症状,如寿命缩短、骨质疏松、皮肤肌肉萎缩、听力下降、软组织钙化等[2,3]。研究发现,klotho可以影响细胞的增殖,因此本研究将klotho基因转染至ADSCs中观察其对ADSCs增殖能力的影响,为深入研究klotho基因功能及ADSCs作为种子细胞进行细胞治疗提供实验基础。
1 材料与方法
1.1 试剂 DMEM细胞培养液购自美国GIBCO公司,碘化丙碇(PI)购自美国sigma公司,Cell Counting Kit-8(CCK-8)购自日本同仁化学研究所,兔抗人cyclinD1抗体,HRP标记的羊抗兔二抗购自北京中杉公司。转染试剂lipofectamine2000购自美国invitrogen公司,其他化学试剂为国产分析纯,质粒 pcDNA3.1-GFP、pcDNA3.1-GFP-KL 由吉林圣元科技有限公司惠赠。
1.2 ADSC的分离 取脂肪吸脂术的脂肪抽提物50mg,用PBS溶液反复冲洗3次,然后依次加入5 ml的0.5%胰酶和0.1%胶原酶,置37℃细胞培养箱内消化15min,1 000rpm离心10min后去上清,PBS冲洗3次后,低速离心,弃掉漂浮的脂肪及脂滴,200目纱网过滤,收集细胞,将分离的单细胞移入培养皿中,10%FBS的DMEM、37℃、5%CO2条件下培养。
1.3 Klotho基因的细胞转染 将质粒pcDNA3.1-GFP和pcDNA3.1-GFP-KL (含有klotho全长基因序列)通过转染试剂lipofectamine2000分别转染至ADSC中,具体操作按说明书进行。在转染后24 h、48h、96h采用 CCK-8法测定细胞增殖。将pcDNA3.1-GFP转染组、pcDNA3.1-GFP-KL转染组和未转染组的ADSC细胞悬液分别调整至浓度为2.5×105/ml接种于96孔板,每孔加200μl调整好浓度的细胞悬液,37℃、5%CO2饱和湿度培养,每孔加入CCK-8溶液10μl,继续培养2h,酶标仪上检测各孔450nm处的OD值,以650nm波长为参考波长进行双波长测定,以未转染组为对照组,以pcDNA3.1-GFP转染组、pcDNA3.1-GFP-KL转染组为实验组,按照公式:细胞增殖率=实验组(A)/对照组(A)×100% 计算细胞增殖率,比较各组间增殖率的差异。
1.4 Western blot法检测细胞周期蛋白cyclin D1的表达 取第96h平行培养的未转染组和pcDNA3.1-GFP转染组、pcDNA3.1-GFP-KL转染组的细胞,胰酶消化,含血清的培养基终止胰酶的作用,收集细胞于离心管中,细胞计数后4 000rpm离心5min,预冷PBS洗3次,弃上清,加入细胞裂解液150μl冰上孵育10min,14 000rpm离心10 min,收集上清。采用BCA蛋白定量法测定各组总蛋白浓度,取等量总蛋白在分离胶浓度为12%的条件下进行SDS-PAGE电泳,电泳结束后常规转膜,依次用兔抗人cyclin D1的一抗和羊抗兔酶标二抗孵育,以β-actin为对照,检测pcDNA3.1-GFP转染组、pcDNA3.1-GFP-KL 转染组和未转染组cyclin D1的表达。
1.5 流式细胞仪测定ADSC的细胞周期 分别收集未转染组和pcDNA3.1-GFP转染组、pcDNA3.1-GFP-KL转染组的细胞1×106个于离心管中,1 000rpm离心5min,弃上清加入1ml 70%预冷的乙醇4℃过夜。1 000rpm离心5min,弃上清,用PBS离心洗涤2次,加入1ml DNA抽提缓冲液(192ml 0.2mol/L Na2HPO4与8ml 0.1mol/L枸橼酸的混合溶液),混匀室温放置5min,1 000 rpm离心5min弃上清,将细胞重悬于浓度为100 mg/L的PI溶液中,室温避光染色30min后流式细胞仪检测。
2 结果
2.1 镜下观察分离和质粒转染的ADSC形态 光镜下观察可见分离培养的ADSC呈贴壁生长,细胞形态为梭形,原代培养的细胞24h内即贴壁生长,转染pcDNA3.1-GFP和pcDNA3.1-GFP-KL质粒的ADSC在荧光显微镜下呈现绿色荧光,证明质粒已成功转染入ADSC中,见图1。
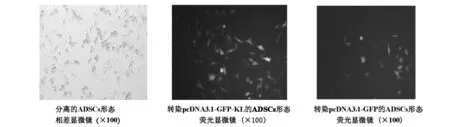
图1 分离及转染后ADSC的细胞形态
2.2 CCK-8法测定细胞增殖 测定吸光度值后计算各组增殖率,pcDNA3.1-GFP-KL组与未转染组相比ADSC的增殖率在第24h、48h、96h分别为124.75%、140.52%、175.50%。而 pcDNA3.1-GFP组与未转染组相比的增殖率在第24h、48h、96h分别为100.99%、101.29%、100.22%,细胞增殖率与对照组相比无明显差异,各组吸光度结果见表1,细胞形态见图2。
2.3 cyclinD1蛋白的表达western blot结果显示pcDNA3.1-GFP-KL转染组与 pcDNA3.1-GFP转染组和未转染组相比cyclin D1蛋白的表达水平明显增高,结果见图3。而转染pcDNA3.1-GFP组和未转染组相比cyclinD1蛋白的表达水平无明显差异,而3组细胞的β-actin蛋白的表达无明显差异。

表1 各组细胞不同时间的吸光度值
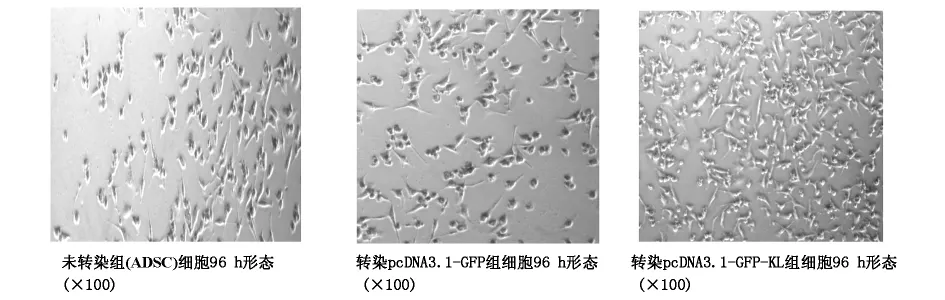
图2 未转染组及转染组96hADSC的细胞形态

图3 western blot检测各组细胞cyclinD1的表达
2.4 流式细胞仪检测细胞周期 未转染组、pcDNA3.1-GFP-KL转染组和pcDNA3.1-GFP转染组的细胞周期分析结果显示,pcDNA3.1-GFP-KL转染组G0/G1期的细胞明显减少(P<0.05),而S期细胞明显增多(P<0.05),G2/M 期细胞也增多(P<0.05),而未转染组和pcDNA3.1-GFP转染组的细胞周期分析无明显差异,结果见表2。
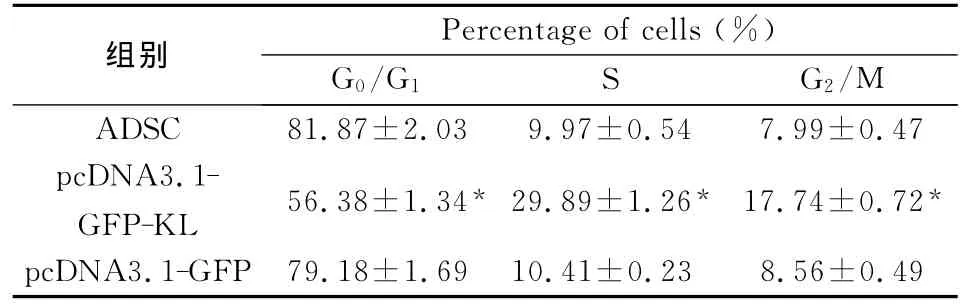
表2 流式细胞仪测定各组细胞的细胞周期
3 讨论
人klotho基因位于17号染色体的大臂,全长5.2kb,由5个外显子和4个内含子组成[4]。Klotho是一种抗衰老基因,研究发现klotho基因发生突变可导致动物出现过早衰老症状及寿命缩短,而过表达klotho基因的小鼠则出现衰老抑制和寿命延长[5]。Klotho基因通过双向作用发挥抗衰老的作用,体现为一方面抑制肿瘤细胞增殖,另一方面促进正常细胞增殖。已有研究证实Klotho基因可抑制IGF-1信号通路进而抑制肿瘤细胞增殖,而klotho基因也可抑制过量的维生素D引起的细胞凋亡,激活细胞的有丝分裂来发挥其促进正常细胞增殖作用[6,7]。klotho随着年龄的增长和某些疾病条件下其表达呈下降趋势。在自发性高血压大鼠和糖尿病大鼠中持续的高压和氧化应激使klotho表达明显下降,在人慢性肾脏疾病中klotho表达也呈下降趋势[8-10],因此采用klotho基因转染的手段,可以提高klotho在细胞的表达量,进而达到促进细胞增殖及抗衰老的目标。
ADSCs(adipose-derived stem cells,脂肪间充质干细胞),是一类存在于脂肪基质中,具有自我更新能力和多分化潜能的成体干细胞,研究证实它可分化为脂肪细胞、心肌细胞、成骨细胞、神经细胞等多种成体细胞。ADSCs可从吸脂术中的废弃脂肪中分离,取材极为方便,ADSC认为是替代骨髓间充质干细胞用于细胞移植的理想种子细胞。ADSC在体外培养时,血清浓度、细胞密度等培养条件对其增殖能力影响较大。在既往研究中,我们发现ADSC增殖周期为1w左右,如能提高ADSC的体外增殖能力,在体外大量扩增ADSC,将为ADSC作为种子细胞进行细胞移植、构建工程化组织提供实验基础。
本研究中使用细胞转染手段,将Klotho基因转染至培养的ADSC中,通过CCK-8检测细胞增殖能力,实验结果为在转染后96hpcDNA3.1-GFP-KL转染组的增殖能力为未转染组的175.50%,而通过流式细胞仪检测细胞周期发现,转染klotho基因后ADSC在静止期(G0/G1期)细胞数明显减少,而合成期 (S期)和有丝分裂期 (G2/M期)的细胞数明显增多,说明ADSC转染klotho基因后细胞的增殖能力明显增强,而通过免疫组化的测定结果发现,ADSC中cyclinD1蛋白的表达在转染klotho基因后明显增高,而cyclinD1蛋白也是使细胞进入合成期,促进细胞增殖的必要条件,以上实验结果均说明转染klotho基因可增强体外培养ADSC的增殖能力。
Klotho作为抗衰老基因,其研究尚处于起步阶段,其发挥抗衰老促进正常细胞增殖的分子机制有待深入研究。本研究采用转染klotho基因的方法提高了ADSC体外增殖能力,为进一步研究klotho基因抗衰老的机制和将ADSCs用于细胞移植治疗疾病打下实验基础。
[1]Casteilla L,Planat-Benard V,Laharrague P,et al.Adipose-derived stromal cells:Their identity and uses in clinical trials,an update[J].World J Stem Cell,2011,3(4):25.
[2]Kuro-o M,Matsumura Y,Aizawa H,et al.Mutation of the mouse klotho gene leads to a syndrome resembling ageing[J].Nature,1997,390:45.
[3]Arking DE,Krebsova A,Macek M,et al.Association of human aging with a functional variant of klotho[J].Proc Natl Acad Sci U S A,2002,99:856.
[4]Matsumura Y,Aizawa H,Shiraki-Iida T,et al.Identification of the human klotho gene and its two transcripts encoding membrane and secreted klotho protein[J].Biochem Biophys Res Commun,1998,242:626.
[5]Ogata N,Matsumura Y,Shiraki M,et al.Association of klotho gene polymorphism with bone density and spondylosis of the lumbar spine in postmenopausal women[J].Bone,2002,31:37.
[6]Tatar M,Bartke A,Antebi A.The endocrine regulation of aging by insulin-like signals[J].Science,2003,299:1346.
[7]Tsujikawa H,Kurotaki Y,Fujimori T,et al.Klotho,agene related to a syndrome resembling human premature aging,functions in a negative regulatory circuit of vitamin D endocrine system[J].Mol Endocrinol,2003,17:2393.
[8]Nabeshima Y.Ectopic calcification in Klotho mice[J].Clin Calcium,2002 ,12(8):1114.
[9]Zhao Y,Banerjee S,Dey N,et al.klotho depletion contributes to increased inflammation in kidney of mouse of diatetes via ReIA 536phosphorylation[J].Diabetes,2011,60(7).1907.
[10]Koh N,Fujimori T,Nishiguchi S,Tamori A,Shiomi S,Nakatani T,Sugimura K,Kishimoto T,Kinoshita S,Kuroki T,Nabeshima Y.Severely reduced production of klotho in human chronic renal failure kidney[J].Biochem Biophys Res Commun,2001,280:1015.
