利用等位基因特异性扩增检测人结直肠癌BRAF基因V600E突变
2012-11-23司徒博曹楠楠刘丽琴刘芹兰
司徒博,曹楠楠,刘丽琴,李 博,刘芹兰,林 丽,王 前,郑 磊*
(1.南方医科大学南方医院 检验医学科,广东 广州510515;2.广州军区广州总医院 医学实验科,广东 广州510010)
RAS/RAF/MEK/ERK/MAPK信号转导通路参与细胞生长、分化、凋亡等多种生物学事件。BRAF基因的编码产物的是参与该通路信号转导的一种重要丝氨酸/苏氨酸激酶,该基因的15外显子1799位核苷酸的T→A突变是BRAF基因的热点突变(约占80%-90%)[1],此突变使其编码的氨基酸由缬氨酸变为谷氨酸(V600E),导致该激酶活性大大增强,能持续激活MAPK信号通路,致使细胞异常增殖及分化,被认为是细胞癌变的关键因素[2,3]。在结直肠肿瘤治疗中,BRAF V600E突变情况被认为是除KRAS突变外对分子靶向药物西妥昔单抗与帕尼单抗的疗效预测的另外一个重要指标[4,5]。此外,突变的BRAF基因也是结直肠肿瘤预后较差的一个生物标志物[6],以及区分散发性结直肠癌与Lynch综合征的分子指标[7]。因而,准确检测肿瘤组织中BRAF基因的突变情况具有重要的诊疗意义。本研究以人BRAF基因V600E突变位点设计等位基因特异性扩增引物,通过选择性扩增实现检测BRAF基因热点突变的目的,通过与金标准Sanger测序法比较,探讨该方法的可行性。
1 材料与方法
1.1 材料
1.1.1 细胞株 人大肠癌SW480及HT29细胞分别由南方医院消化科及广州军区总医院医学实验科惠赠。两株细胞均经过测序证实分别为BRAF野生型及携带BRAF V600E杂合突变。
1.1.2 结直肠癌标本 40例结直肠癌石蜡标本来源于广州军区广州总医院病理科。所有提取DNA肿瘤组织切片均经镜检证实肿瘤细胞含量大于90%。
1.1.3 试剂与仪器 细胞核酸提取试剂盒(美国Omega公司),石蜡组织核酸提取试剂盒(德国Qiagen公司),TaKaRa TaqTM试剂盒(日本TaKaRa公司),琼脂粉(西班牙Biowest公司)。Nanodrop2000分光光度计(美国Thermo公司),PCR仪(德国Eppendorf公司),凝胶成像仪(美国Bio-Rad公司)。
1.1.4 引物设计及合成 针对人BRAF基因V600E位点设计3’末尾碱基错配的上游引物:TGATTTTGGTCTAGCTACAGA,下游引物:TTTCAACAGGGTACACAGAACA,下划线碱基与BRAF野生型模板15外显子1799位碱基错配,与突变热点V600E匹配而达到选择性扩增的目的,扩增产物长度为490bp。测序引物扩增范围覆盖BRAF基因第15外显子V500E突变位点:上游引物:AGATCTACTGTTTTCCTTTACTTACTACACC,下游引物:AATCAGTGGAAAAATAGCCTCAATTCT,扩增片段184bp。所有引物均由上海生工生物工程有限公司合成 ,PAGE纯化。
1.2 方法
1.2.1 核酸提取 分别用细胞核酸提取试剂盒及石蜡组织核酸提取试剂盒对细胞及肿瘤标本进DNA提取,模板DNA置-20℃保存。
1.2.2 等位基因特异性扩增 对人大肠癌细胞株SW480、HT29以及40例肿瘤标本进行等位基因特异性扩增,条件如下:PCR体系总体积为20μl,含Mg2+buffer 2μl,dNTP mixture 1.5μl(各 2.5 mM),上下游引物各0.5μl(10umol),模板 DNA 30ng,加灭菌去离子水至20μl。反应条件:95℃预变性30s;95℃变性10s,67℃退火20s,72℃延伸30s,共45个循环。肿瘤标本取1μl第一次扩增产物作为进行二次扩增,扩增条件一致。PCR产物取5μl进行琼脂糖(2%)凝胶电泳30min后显像。
1.2.3 普通PCR并测序 所有标本及细胞株均经PCR后测序与等位基因特异性扩增结果作比较。PCR反应条件:含 Mg2+buffer 2μl,dNTP mixture 1.5μl(各2.5mM),上下游引物各1μl(10μmol),模板DNA 30ng,加灭菌去离子水至20μl。反应条件:95℃预变性30s;95℃变性10s,54℃退火20s,72℃延伸30s,共40个循环。PCR产物经琼脂糖(2%)凝胶电泳证实目的条带扩增成功后送测序(华大基因有限公司)。
1.2.4 灵敏度检测 取SW480及 HT29细胞株DNA经核酸定量仪均定量为30ng后,按一定比例用携带有BRAF野生型(SW480)的核酸混合到带有BRAF V600E突变(HT29)的核酸中,得到分别含有50%、25%、12.5%、6.2%、3.1%、1.5%的突变DNA的混合模板,分别取30ng进行等位基因特异性扩增与普通PCR后测序进行灵敏度比较。
2 结果
2.1 等位基因特异性扩增BRAF V600E突变结果 在上述PCR条件下,该方法成功选择扩增出携带有BRAF V600E杂合突变的细胞株(图1)。而在40例大肠癌石蜡标本中,3例出现了目的扩增产物(图2)。
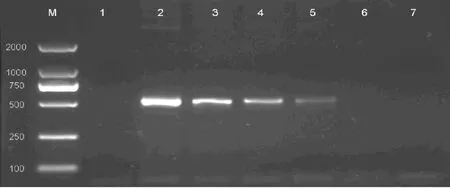
图1 不同比例的BRAF V600E突变核酸经等位基因特异性扩增后行琼脂糖凝胶电泳

图2 利用等位基因特异性扩增检测40例大肠癌石蜡标本
2.2 普通PCR后测序结果 40例大肠癌石蜡标本经成功扩增后送测序,测序结果显示40例标本中37例BRAF基因15外显子1799位核苷酸为野生型,3例为BRAF V600E突变,检测结果与等位基因特异性扩增结果一致。
2.3 两种方法灵敏度比较 如图1显示,通过等位基因特异性扩增不同比例突变核酸,本方法可在6.2%的突变基因模板中扩增出目的条带,显示本方法检测BRAF V600E突变的敏感度可低至6.2%。普通PCR后测序结果则能从峰图中显出50%、25%、12.5%的突变位点,低于12.5%则与背景信号混杂无法测出(图3)。

图3 不同比例的BRAF V600E突变核酸经普通PCR后测序的信号峰图
3 讨论
肿瘤是由于细胞在致癌因素的影响下发生基因变异,从而失去对生长的正常调控而导致的单克隆性异常增生所致。其中,被认为对肿瘤形成起重要作用的突变被称为“驱动突变”(Driver Mutation),准确、敏感地检测该类突变可作为肿瘤的生物标志物从而对肿瘤的分子诊断提供重要信息。BRAF V600E突变已被证实出现于甲状腺癌、大肠癌、恶性黑素瘤、肺癌、毛细胞白血病等多种肿瘤中[8],在肿瘤的早期诊断、鉴别诊断、预后判断以及分子分型中起了重要作用。近年来,随着分子靶向药物的不断研发,作用于BRAF突变蛋白的靶向药物也陆续进入临床。目前该基因突变情况被认为是对大肠癌[9]、恶性黑素瘤[10]分子靶向药物疗效预测的重要指标而受到人们的日益重视。由于靶向药物往往价格昂贵且毒副作用明显,因而准确、敏感地检测出判断其疗效的基因突变情况具有重要的指导意义。然而,众多晚期肿瘤患者初诊时已失去手术机会,检测肿瘤源性的突变基因情况只能通过穿刺组织活检、胸腹水等检测。该类标本肿瘤细胞丰度低且混杂了大量正常的体细胞,即使是肿瘤组织本身,也常混杂了大量野生型的体细胞。目前检测突变的常用方法有测序、RFLP(限制性片段长度多态性)、SSCP(单链构象多态性)、荧光定量PCR、dHPLC(变性高效液相色谱)、HRM(高分辨率溶解曲线)等,RFLP与SSCP存在步骤繁琐、敏感性欠佳的缺点;定量PCR、HRM及dHPLC均需要特殊设备或标记探针;被认为是基因检测“金标准”的测序法往往需要昂贵的测序仪器及较复杂操作要求,且成本较高、操作耗时,一般实验室难以开展。此外,临床上利用测序作为检测方法实验室为避免假阴性,往往拒收肿瘤细胞含量低于50%的标本,导致了一部分晚期肿瘤病人对靶向治疗选择无据可循。
等位基因特异性扩增是检测已知突变的一种简便方法,该方法利用Taq酶缺少3’→5’外切酶活性,引物3’末端碱基与模板错配时,扩增难以进行的原理,而达到选择性扩增定点突变或野生型基因的目的。本研究通过设计上游引物3’端与BEAF基因V600E点突变完全互补、与野生型碱基错配的上游引物,通过优化反应条件,从而达到选择性扩增BRAF V600E突变的目的。通过利用携带V600E突变的HT29细胞与BRAF野生型的SW480大肠癌细胞株的模板稀释实验,证实该方法可检测出混杂于野生型中的6.2%BRAF突变,与测序相比(12.5%)本方法具有更高的灵敏度。利用本研究建立方法检测40例大肠癌石蜡标本,成功检测出3例,与PCR后测序结果对比一致。
综上所述,等位基因特异性扩增可快速检测出肿瘤BRAF基因V600E突变,与测序法相比,本方法无需特殊设备,具有简便、快捷、灵敏、经济的特点,较适合普通实验室对肿瘤突变基因的筛查检测。
[1]Kumar R,Angelini S,Czene K,et al.BRAF mutations in metastatic melanoma:apossible association with clinical outcome[J].Clin Cancer Res,2003,9:3362.
[2]Balmanno K,Cook SJ.Tumour cell survival signalling by the ERK1/2pathway[J].Cell Death Differ,2009,16:368.
[3]Wickenden JA,Jin H,Johnson M,et al.Colorectal cancer cells with the BRAF(V600E)mutation are addicted to the ERK1/2 pathway for growth factor-independent survival and repression of BIM[J].Oncogene,2008,27:7150.
[4]Amado R G,Wolf M,Peeters M,et al.Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer[J].J Clin Oncol,2008,26:1626.
[5]Di Nicolantonio F,Martini M,Molinari F,et al.Wild-type BRAF is required for response to panitumumab or cetuximab in metastatic colorectal cancer[J].J Clin Oncol,2008,26:5705.
[6]Yokota T,Ura T,Shibata N,et al.BRAF mutation is a powerful prognostic factor in advanced and recurrent colorectal cancer[J].Br J Cancer,2011,105:856.
[7]Domingo E,Laiho P,Ollikainen M,et al.BRAF screening as a low-cost effective strategy for simplifying HNPCC genetic testing[J].J Med Genet,2004,41:664.
[8]Davies H,Bignell GR,Cox C,et al.Mutations of the BRAF gene in human cancer[J].Nature,2002,417:949.
[9]Loupakis F,Ruzzo A,Cremolini C,et al.KRAS codon 61,146and BRAF mutations predict resistance to cetuximab plus irinotecan in KRAS codon 12and 13wild-type metastatic colorectal cancer[J].Br J Cancer,2008,101:715.
[10]Paul BC,Axel H,Caroline R,et al.Improved Survival with Vemurafenib in Melanoma with BRAF V600EMutation[J].N Engl J Med,2011,364:2507.
