汉防己甲素对肝癌耐药细胞抑制作用机制研究
2012-11-22孙倩茹王炳芳张明王庆华
孙倩茹,王炳芳,张明,王庆华
(1.江苏大学临床医学院,江苏镇江212013;2.江苏大学附属昆山医院消化科,江苏昆山215300)
肝癌是恶性肿瘤中发病率和恶性程度较高的一种,因其早期诊断比较困难,晚期的手术存活率低且复发率高,严重危害人类的健康。采用化疗多因肝癌的天然性和(或)获得性耐药,致使抗癌药的细胞毒性降低,即使增加剂量,又因其严重的不良反应而被迫中断治疗。
近来有汉防己甲素(tetrandrine,TET)抑制癌细胞增殖的报道[1-3],但在其作用机制方面的研究中只提出了与P-170糖蛋白竞争性抑制有关。本文通过研究TET对细胞内Ca2+浓度影响及其与肿瘤细胞的DNA合成、肿瘤细胞内抗癌药浓度等之间的关系,探讨TET及其联合抗癌药抑制肝癌耐药细胞系增殖的机制,以寻找药物抗癌的新途径,为新型抗癌药物的研制提供理论依据。
1 材料和方法
1.1 材料
肝癌耐药细胞系(BEL-7402/DOX)由本研究室诱导[4];TET(浙江金华制药厂);多柔比星(doxorubicin,DOX),Fura-2/AM,四甲基偶氮唑蓝(MTT)购自Sigma公司;Triton X-100由美国进口,上海化学试剂公司分装厂分装。
1.2 方法
1.2.1 TET及其联合DOX对BEL-7402/DOX抑制率的测定 选择对数生长期BEL-7402/DOX细胞,经胰酶消化后,以含10%小牛血清的RPMI-1640培养液调整细胞浓度为2×104/ml,分别加入48孔细胞培养板中,每孔1.0 ml细胞悬液。置37℃、5%CO2培养箱中孵育24 h后,将其分为5组:单独DOX组(1.0 mg/L),单独 TET 组(2.5 mg/L),两种浓度的 TET(2.5 mg/L、5.0 mg/L)加 DOX 组(1.0 mg/L),对照组加入等量的药物溶剂。每个浓度做3个复孔,并分别加入MTT溶液20 μl(5.0 g/L),继续培养4 h后终止培养,吸去孔内培养液,每孔加入150 μl二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪D(490 nm)处测量各孔的D值。抑制率=(对照组D值-药物组D值)/对照组D值×100%。
1.2.2 癌细胞内抗癌药物DOX浓度的测定 收集对数生长的BEL-7402/DOX细胞,以5×105/ml密度,每管加入2 ml(培养液稀释),同时加入5 mg/L的DOX,在此基础上加入各种不同浓度的TET,每组3个复管,放入37℃的CO2孵育箱中培养1 h,用冷PBS 2 ml终止细胞代谢,1 000 r/min离心5 min,弃上清,细胞重复用冷PBS洗2遍,然后用PBS重新悬浮。将细胞在超声波破碎仪上破碎1 min。破碎后正丁醇萃取,然后加 1.0 ml 0.9%NaCl,0.5 ml 30%三氯乙酸,振荡混匀,4 000 r/min离心30 min,上清液在荧光分光光度计(475 nm/590 nm、狭缝各15 nm)上测定D值。
细胞内药物浓度的计算:在测定D值时,设一标准对照管(本实验对照管为2 ml双蒸水中加5 μg DOX)。
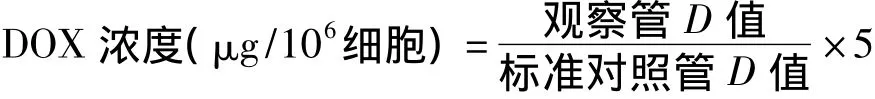
1.2.3 细胞内Ca2+浓度的测定 选择对数生长期BEL-7402/DOX细胞,经0.25%胰酶消化后收集细胞悬液,10 000 r/min离心5 min。沉淀的细胞用PBS液悬浮,并调整细胞浓度为1×1010/L。用台盼蓝染色判断细胞活性(>95%)。加入Fura-2/AM(终浓度为 10 μmol/L),37℃ 避光孵育 50 min。10 000 r/min离心5 min。弃去上清液,用PBS液洗涤2次以除去残留在细胞外的Fura-2/AM。最后加入等量的PBS液悬浮细胞,在RF-540岛津荧光分光光度计上测定。为观察Fura-2负载情况,将发射波长(Em)固定在510 nm,Em光栅10 nm,扫描激发波长(Ex)波峰,扫描范围300~420 nm,扫描速度32 mm/min。荧光测定条件:Ex 340 nm,Em 510 nm,Em光栅10 nm,Ex光栅10 nm。根据公式[Ca2+]=Kd·(F-Fmin)/(Fmax-F)计算。Kd:Fura-2与Ca2+的解离常数,等于224 nmol/L;F:实际测得的荧光强度;Fmax:最大荧光值;Fmin:最小荧光值。
1.3 统计学方法
2 结果
2.1 TET及其联合DOX对BEL-7402/DOX的抑制作用
结果显示,单用DOX和TET对肝癌耐药细胞BEL-7402/DOX的抑制作用较弱;DOX与对细胞增殖基本无影响的2.5 mg/L浓度的TET合用时,其抑制率较单独用DOX时明显升高(P<0.05);而与5.0 mg/L的TET合用时,其抑制率较单独用DOX时升高更为显著(P<0.01)。结果表明,TET能协同化疗药物DOX的细胞毒性,且呈剂量依赖性,见表1。

表1 单独用TET、DOX以及DOX与TET合用时对BEL-7402/DOX的抑制作用Tab 1 The inhibitory effect of BEL-7402/DOX cells treated with TET,DOX and TET plus DOX
2.2 TET对癌细胞内抗癌药物DOX浓度的影响
浓度分别为 2.5、5.0、10.0、20.0、40.0 mg/L 的TET分别与DOX共同加入BEL-7402/DOX及BEL/7402细胞中进行孵育。结果显示,浓度为2.5 mg/L的TET可明显增加肝癌耐药细胞内DOX的浓度(P <0.05),而当 TET 浓度为 5.0、10.0、20.0、40.0 mg/L时,其增加肝癌耐药细胞内DOX浓度的作用更为显著,P均<0.01。说明TET可抑制抗癌药物的外排。
2.3 TET对BEL-7402/DOX细胞内Ca2+浓度的影响
在细胞外液不含Ca2+(Hanks液除去CaCl2并加入0.1 mmol/L的EGTA)时的胞内Ca2+浓度为(76±4)nmol/L,而当细胞外液为含Ca2+的Hanks液时,测得其浓度为(261±46)nmol/L。在含有Ca2+的Hanks液的细胞中,加入不同浓度的TET处理,结果显示,TET浓度为2.5 mg/L时,其浓度无明显变化(P >0.05),TET浓度为5.0 mg/L时可显著降低癌细胞内的Ca2+浓度(P<0.05),而当TET浓度为10.0 mg/L时,其降低癌细胞内Ca2+的作用更为显著(P<0.01),呈剂量依赖性。
3 讨论
肿瘤多药耐药(MDR)是肿瘤化疗失败的主要原因之一,寻找低毒高效的肿瘤耐药逆转剂已成为肿瘤化疗药物领域研究的热点,目前进入临床研究及应用的化学药物逆转剂因作用机制单一、选择性差、中毒剂量与有效剂量接近等诸多原因,其广泛临床应用受到限制[5]。中药因其资源分布广泛、价格相对低廉、毒副反应小等优点,一些学者已经把逆转肝癌多药耐药转向了中药的研究,中药在肿瘤治疗中具有广阔的应用前景[6-8]。
汉防己甲素(TET)又名粉防己碱,是存在于防己科植物粉防己根中的双苄基异喹啉衍生物,与尼卡地平相似,是一种非选择性的钙通道拮抗剂。研究发现,尼卡地平等钙通道拮抗剂能导致耐药细胞内化疗药物的积聚,其机制是逆转剂能与细胞表面P-gp结合,导致其功能失活[9]。本研究结果显示,TET对BEL-7402/DOX细胞内的Ca2+浓度有明显的影响,能显著降低细胞内的Ca2+浓度,且呈剂量依赖性,说明用TET可替代尼卡地平,通过钙通道拮抗作用而抑制肿瘤细胞的增殖。胞内Ca2+作为细胞传递中的重要信使物质,在某些细胞的增殖中发挥着重要作用。TET作为胞内钙拮抗剂可通过抑制胞内存贮Ca2+释放,阻抑与钙有关的受体活性,使胞内的Ca2+浓度降低。由于降低了胞内Ca2+浓度,因而削弱了肌醇酯激酶的活性,故可抑制细胞特别是肿瘤细胞的增殖。
20世纪70、80年代,已有国内外相关报道显示TET在体外对大鼠腹水型肝癌细胞、人肝癌细胞、Hela细胞等多种细胞具有生长抑制作用。本文实验结果表明,TET对细胞的增殖具有抑制作用。实验应用2.5 mg/L的TET与DOX合用,结果显示其抑制率较单独用DOX明显提高,增加TET的剂量(5.0 mg/L),对细胞的增殖抑制率提高更加明显,进一步说明TET对耐药肝癌细胞有直接的细胞毒作用,并能显著增强抗癌药物的细胞毒作用,在一定程度上逆转耐药肝癌细胞的耐药性。
1976年Juliano等[10]首先观察到具有MDR表型的CHO细胞药物积聚发生障碍,相对分子质量为170 000的膜糖蛋白—P-170糖蛋白过度表达。MDR细胞抗药程度及胞内药物积聚与P-170糖蛋白过度表达有关。目前已有相关研究显示TET逆转肿瘤细胞MDR的机制可能包括逆转P-170糖蛋白的过度表达、逆转谷胱甘肽S转移酶的催化解毒功能、抑制多药耐药相关蛋白的表达等方面[11]。
根据既往的文献报道及我们的研究结果,TET的抗肿瘤细胞MDR作用方面已取得一定的研究成果,对未来临床有一定的应用前景,但是目前许多研究仍然局限于体外细胞实验阶段,大样本的系统临床研究报道还十分缺乏,其具体药理、药代动力学、药效学、更为详尽的逆转肿瘤MDR的机制还需要更深层次的探索与研究。
[1]邓雨霞,孙新臣.粉防己碱对人鼻咽癌细胞株CNE增殖抑制和凋亡作用的研究[J].医学研究生学报,2007,20(4):360-365.
[2]Ng LT,Chiang LC,Lin YT,et al.Antiproliferative and apoptotic effects of tetrandrine on different human hepatoma cell lines[J].Am J Chin Med,2006,34(1):125 -135.
[3]Lee JH,Kang GH,Kim KC,et al.Tetrandrine-induced cell cycle arrest and apoptosis in A549 human lung carcinoma cells[J].Int J Oncol,2002,21(6):1239 - 1244.
[4]Lee JH,Kang GH,Kim KC,等.肝癌耐药细胞的诱导及其生物学特性的研究[J].肿瘤,1998,18(3):212-214.
[5]刘嘉.肿瘤多药耐药机制及其逆转方案的研究进展[J].中国肿瘤外科杂志,2010,2(3):174-178.
[6]解霞,郝力宏,高清波,等.川芎嗪逆转肿瘤多药耐药性及其机制的研究[J].中华肿瘤防治杂志,2006,13(18):1368-1370.
[7]秦小清,梁宇光,高洪志,等.五味子甲素对 K562/DOX、HL-60/DOX、MCF-7/DOX多药耐药逆转机制的研究[J].中国药理学通报,2011,27(3):329 -334.
[8]Li SL,Huang ZN,Hsieh HH,et al.The augmented antitumor effects of Antrodia camphorata co-fermented with Chinese medicinal herb in human hepatoma cells[J].Am J Chin Med,2009,37(4):771 -783.
[9]陈贤鸿,王炳芳,陈锡美,等.尼卡地平抑制肝癌耐药细胞增殖的研究[J].铁道医学,2001,29(3):149 -151.
[10] Juliano RL,Ling V.A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutants[J].Biochim Biophys Acta,1976,455(1):152 -162.
[11]徐萌,周蓓.汉防己甲素逆转肺癌化疗耐药和凋亡抗性的实验研究[J].新中医,2006,38(6):90 -91.
