TGF-β1诱导人肝HL7702细胞发生上皮细胞间质转化的实验研究
2012-11-22李婷芬王冰莹严永敏李里明蒋留留钱晖
李婷芬,王冰莹,严永敏,李里明,蒋留留,钱晖
(江苏大学基础医学与医学技术学院,江苏镇江212013)
肝纤维化是一种肝脏正常结构破坏,胶原沉积的过程[1],目前肝纤维化的发病机制尚有争议。TGF-β1 是上皮-间质转化(epithelial-to-mesenchyme transition,EMT)最重要的调节分子,Zeisberg 等[2]发现小鼠肝纤维化中成纤维细胞来源于局部肝细胞经TGF-β1作用发生EMT,骨形成蛋白7(BMP7)抑制EMT后,相应肝纤维化也得到修复。Kaimori等[3]把小鼠原代肝细胞和小鼠肝细胞系AML12做了对比,发现 TGF-β1会诱导成熟的小鼠肝细胞发生EMT转变。Chen等[4]也发现体外 TGF-β1诱导小鼠肝细胞发生EMT转变。但是人肝脏纤维化与EMT关系的研究还未见报道。
本实验旨在探讨人肝细胞系HL7702在TGF-β1诱导下是否发生EMT,并检测EMT相关基因蛋白的表达变化,为进一步研究EMT和肝纤维化之间的具体机制提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞系 人肝细胞HL7702购自中国科学院细胞库。
1.1.2 主要试剂 1640培养基,小牛血清(Gibco公司);人类重组TGF-β1(Peprotech公司);兔抗人多克隆E-钙黏附蛋白抗体(SAB公司);鼠抗人多克隆N-钙黏附蛋白抗体(BD公司);鼠抗人多克隆波形蛋白抗体(Santa cruz公司);鼠抗多克隆GAPDH抗体,羊抗鼠IgG,羊抗兔IgG(上海康成公司);Trizol试剂(Invitrogen公司),RT-PCR试剂盒(MBI公司),SYBR Green荧光染料(ToYoBo公司)。
1.1.3 主要仪器 二氧化碳培养箱(Forma,Scientific公司),倒置式生物显微镜(Ti,Nikon公司),PCR仪(2720,ABI公司),荧光定量 PCR分析仪(CFX96TM,Bio-Rad公司)。
1.2 方法
1.2.1 TGF-β1 刺激人肝细胞 HL7702 HL7702 于20%小牛血清(1640)培养基37℃ 5%CO2孵箱中培养,每3天换1次营养液。消化传代后HL7702分别种于6孔板,细胞浓度为1×107/孔。20%小牛血清(1640)营养液培养2 d后,撤除营养液换成无血清1640 培养基和 TGF-β1 2 ng/ml培养 24,48,72 h后,通过倒置显微镜观察诱导前后细胞的形态变化。
1.2.2 实时定量PCR检测EMT相关基因 用Trizol试剂提取诱导前后细胞总RNA,以总RNA为模板,Oligo dT为引物,逆转录合成cDNA,以cDNA为模板,qRT-PCR检测相关基因的表达量,各引物序列见表 1。qRT-PCR反应体系:10 μl 2 ×SYBR Green 荧光染料,引物1 和引物2 各0.5 μl,Taq DNA聚合酶 0.1 μl,1 μl cDNA,补水至总体积 20 μl。循环35 次:94 ℃ 30 s、60 ℃ 30 s、72 ℃30 s,E-钙黏附蛋白(80℃),N-钙黏附蛋白,Twist(75℃),β-肌动蛋白(78℃)采集荧光;随后72℃延伸5 min,最后进行72℃ ~99℃的熔解曲线分析。E-钙黏附蛋白、N-钙黏附蛋白、Twist的数据与β-肌动蛋白数据采用相对比值法处理。

表1 引物碱基序列Tab 1 Primer sequence
1.2.3 蛋白质印迹法检测EMT相关蛋白 诱导组及未诱导组细胞经裂解液充分裂解后,加入等体积5×SDS上样缓冲液于蛋白裂解上清液中,煮沸5 min。进行聚丙烯酰胺电泳,每孔上样等量总蛋白。分离的蛋白转移至PVDF膜上,5% 脱脂牛奶室温封闭1 h后,加入E-钙黏附蛋白(1∶200)、N-钙黏附蛋白(1∶2 000)、波形蛋白(1 ∶500)及GAPDH(1∶10 000)抗体稀释液,4℃过夜。TBS/0.5%Tween20洗膜3次后,再加入1∶5 000抗HRP抗体稀释液37℃ 孵育1 h,TBS、0.5%Tween20充分洗膜3次后,用预混HRP化学发光底物(Luminata crescendo western HRP substrate)检测蛋白。
1.3 数据处理及统计
实验数据用GraphpadPrism 5软件进行统计学分析,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 HL7702细胞诱导前后的形态学变化
体外培养的HL7702细胞的形态是不规则的六边形,经TGF-β1诱导24 h后细胞形态基本没有变化,48 h后少量的细胞拉长变成纺锤形,72 h后细胞形态的变化很明显,大量的细胞完全变成纺锤形,细胞之间的间隙也变大(图1)。
2.2 TGF-β1诱导后HL7702细胞EMT相关基因表达
通过观察细胞形态学的变化,选择72 h的细胞提取总RNA用于定量分析,结果显示HL7702细胞经诱导72 h后E-钙黏附蛋白mRNA的表达较对照组明显减少,差异有统计学意义(t=3.353,P<0.05)。而 N-钙黏附蛋白,Twist mRNA 的表达较对照组 HL7702显著增加(t=3.850,P<0.05;t=5.433,P <0.05)。见图2。
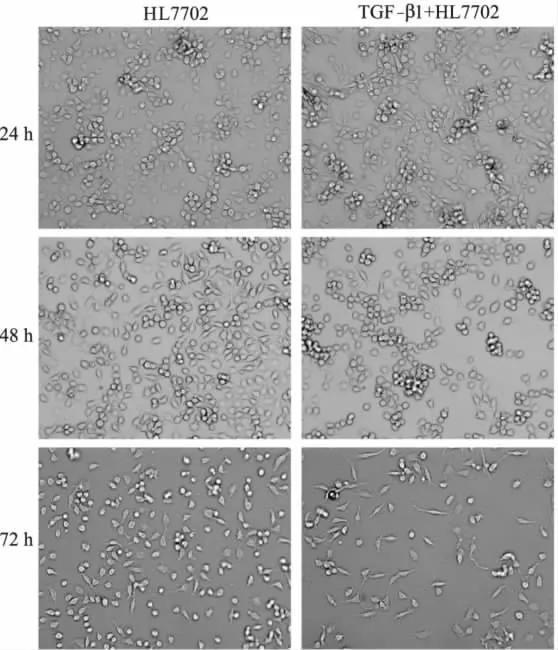
图1 TGF-β1诱导前后HL7702细胞的形态学变化(×100)Fig 1 Morphology changes after TGF-β1 induction in HL7702 cells

图2 TGF-β1诱导后HL7702细胞EMT相关基因mRNA的表达Fig2 Relative EMT-associated gene expression level after TGF-β1 treatment in HL7702 cells
2.3 TGF-β1诱导后HL7702细胞EMT相关蛋白表达
蛋白质印迹结果显示,HL7702诱导24 h和48 h后E-钙黏附蛋白基本没什么变化,72 h后E-钙黏附蛋白表达明显减弱(P<0.001)。而N-钙黏附蛋白、波形蛋白均随诱导时间的延长表达明显增强。见图3。
3 讨论
TGF-β1是一组具有多种功能的蛋白多肽,对细胞的增殖分化、细胞外基质(ECM)形成、组织损伤修复起着重要作用[5]。TGF-β1是肝脏中最主要的成分,随着对TGF-β1认识逐步加深,人们发现肝纤维化与TGF-β1有重要的联系。本研究采用TGF-β1作用于人肝细胞系HL7702之后,通过细胞形态学变化,EMT相关基因和蛋白表达分析,证明了肝细胞HL7702经过TGF-β1诱导后确实发生了EMT,上皮化标记E-钙黏附蛋白显著下降,间质化标记N-钙黏附蛋白、波形蛋白和 Twist显著增加。肝细胞渐渐失去了上皮细胞的特性和功能。
E-钙黏附蛋白、N-钙黏附蛋白、波形蛋白和 Twist是EMT的重要检测指标,TGF-β1广泛用于EMT的诱导[2-4]。相关研究已表明TGF-β1诱导小鼠的原代肝细胞和肝细胞系发生EMT之后,上皮化标记E-钙黏附蛋白下降,间质化标记N-钙黏附蛋白和波形蛋白显著增加[3-4],这说明细胞失去了上皮化特性和功能,具有间质化细胞的特性和分泌胶原的功能。在小鼠体内纤维化的实验中,小鼠肝内大量的成纤维细胞也是由肝细胞经过EMT而来,促使肝纤维化中胶原的形成[2]。研究发现 TGF-β1诱导上皮细胞发生EMT的机制与Snail-1转录因子有关。Snail-1转录因子是EMT发生的关键分子[6-8],TGF-β1激活 Snail-1与E-钙黏附蛋白转录的抑制有关系,Snail-1是间质化标记波形蛋白的上游分子[9]。Kaimori等[3]发现用Smad4-siRNA干扰小鼠肝细胞后抑制了TGF-β1诱导EMT和Ⅰ型胶原的表达,且依然保留上皮化表型 (E-钙黏附蛋白)和功能(白蛋白)。

图3 TGF-β1诱导后HL7702细胞EMT相关蛋白表达Fig3 Expression of EMT-associated proteins after TGF-β1 induced in HL7702 cells
Snail-1是EMT的关键分子,那么如果封闭Snail-1转录因子之后,是否会抑制TGF-β1诱导人肝细胞发生EMT?TGF-β1/Smads信号通路是EMT发生的重要信号通路,那么Smad4-siRNA干扰之后,即使肝细胞在TGF-β1作用下也不会发生EMT吗?这些问题将是在此基础上我们今后要研究的内容。
[1]Friedman SL.Mechanisms of hepatic fibrogenesis[J].Gastroenterology,2008,134(6):1655-1669.
[2]Zeisberg M,Yang C,Martino M,et al.Fibroblasts derive from hepatocytes in liver fibrosis via epithelial to mesenchymal transition[J].J Biol Chem,2007,282(32):23337-23347.
[3]Kaimori A,Potter J,Kaimori JY,et al.Transforming growth factor-beta1 induces an epithelial-to-mesenchymal transition state in mouse hepatocytes in vitro[J].J Biol Chem,2007,282(30):22089-22101.
[4]Chen YL,Lv J,Ye XL,et al.Sorafenib inhibits transforming growth factor β1-mediated epithelial-mesenchymal transition and apoptosis in mouse hepatocytes[J].Hepatology,2011,53(5):1708-1718.
[5]郭锐芳,杨少奇.以TGF-β1为靶点的抗肝纤维化治疗[J].实用肝脏病杂志,2008,11(5):341-343.
[6]Vega S,Morales AV,Ocaña OH,et al.Snail blocks the cell cycle and confers resistance to cell death[J].Genes Dev,2004,18(10):1131-1143.
[7]Chagraoui J,Lepage-Noll A,Anjo A,et al.Fetal liver stroma consists of cells in epithelial-to-mesenchymal transition[J].Blood,2003,101(8):2973-2982.
[8]Carver EA,Jiang R,Lan Y,et al.The mouse snail gene encodes a key regulator of the epithelial-mesenchymal transition[J].Mol Cell Biol,2001,21(23):8184-8188.
[9]Yokoyama K,Kamata N,Fujimoto R,et al.Increased invasion and matrix metalloproteinase-2 expression by snailinduced mesenchymal transition in squamous cell carcinomas[J].Int J Oncol,2003,22(4):891-898.
