3-(3,4,5-三甲氧基苯基)-4-氨基-5-取代苄巯基-1,2,4-三唑的合成及其生物活性*
2012-11-21杜海军杜海堂桑维钧
杜海军, 杜海堂, 桑维钧, 王 慧
(1. 贵州民族学院 化学与环境科学学院,贵州 贵阳 550025;2. 贵阳学院 化学系,贵州 贵阳 550005; 3. 贵州大学 农学院,贵州 贵阳 550025)
1,2,4-三唑类杂环衍生物在农药和医药领域具有广泛的应用,如抗菌[1~4],抗微生物[5~7]、抗炎[8~11]和抗癌[12]等,一直是杂环化学的研究热点之一。研究的内容和主要目标是通过保留三唑环的分子结构而对其他部分进行适当的改造与修饰,以求扩大杀菌谱和应用范围,进一步提高生物活性和减少用药量。3-取代-4-氨基-5-巯基-1,2,4-三唑是合成1,2,4-三唑类化合物的常用原料,两个相邻的氨基和巯基具有亲核作用,可以转化为多种新的杂环结构。如与巯基作用形成的硫醚
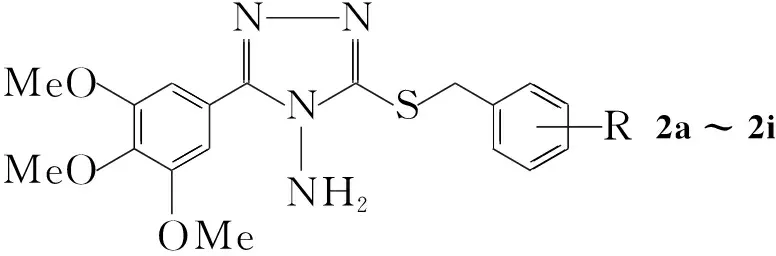
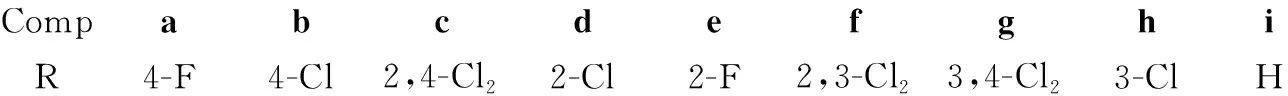
CompabcdefghiR4-F4-Cl2,4-Cl22-Cl2-F2,3-Cl23,4-Cl23-ClH
Scheme1
类化合物也具有多种生物活性[13~17]。
为了获得新的具有生物活性的三唑硫醚类化合物, 本文将五倍子酸衍生物3,4,5-三甲氧基苯基引入1,2,4-三唑硫醚类化合物中,设计并合成了九个新的3-(3,4,5-三甲氧基苯基)-4-氨基-5-取代苄巯基-1,2,4-三唑(2a~2i, Scheme 1),其结构经1H NMR, IR和MS表征。初步生物活性测试结果表明,3-(3,4,5-三甲氧基苯基)-4-氨基-5-对氯苄巯基-1,2,4-三唑(2b)对半夏立枯病菌具有抑制活性。
1 实验部分
1.1 仪器与试剂
YRT-3型熔点仪(温度计未校正);Varian Oxford 500 MHz或INOVA-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bio-Rad Excalibur FTS 3000型红外光谱仪(KBr压片);5975C型质谱仪(EI电离源,70 eV)。
3-(3,4,5-三甲氧基苯基)-4-氨基-5-巯基-1,2,4-三唑按文献[18]方法合成;其余所用试剂均为国产化学纯或分析纯。
1.2 2的合成通法
在反应瓶中加入3-(3,4,5-三甲氧基苯基)-4-氨基-5-巯基-1,2,4-三唑280 mg(1 mmol)和1 mmol·L-1NaOH溶液5 mL,于室温搅拌15 min;滴加取代苄氯(1a~1i) 1 mmol的无水乙醇(5 mL)溶液,滴毕,反应1 h~24 h。抽滤,滤饼干燥后用乙醇和水重结晶得白色晶体2。
2a: 产率80%, m.p.181 ℃~182 ℃;1H NMRδ: 3.88(s, 6H), 3.89(s, 3H), 4.33(s, 2H), 4.40(s, 2H), 6.97~7.01(m, 2H), 7.27~7.30(m, 4H); IRν: 3 365, 3 145, 2 930, 1 578, 1 486, 1 434, 1 235 cm-1; MSm/z(%): 390(M+, 52), 194(14), 178(10), 124(89), 109(100)。
2b: 产率82%, m.p.148 ℃~149 ℃;1H NMRδ: 3.87(s, 6H), 3.89(s, 3H), 4.32(s, 2H), 4.42(s, 2H), 7.26~7.27(m, 4H), 7.28(s, 2H); IRν: 3 339, 3 196, 2 930, 1 583, 1 486, 1 470, 1 240 cm-1; MSm/z(%): 408(M++2, 22), 406(M+, 57), 194(23), 178(17), 140(96), 125(100), 102(28), 89(16)。
2c: 产率79%, m.p.146 ℃~147 ℃;1H NMRδ: 3.88(s, 6H), 3.89(s, 3H), 4.48(s, 2H), 4.53(s, 2H), 7.14~7.16(m, 1H), 7.31(s, 2H), 7.40~7.42(m, 2H); IRν: 3 329, 3 129, 2 930, 1 578, 1 491, 1 465, 1 235 cm-1; MSm/z(%): 442(M++2, 11), 440(M+, 15), 405(100), 282(30), 194(31), 178(23), 159(51), 150(15) 135(19), 120(19), 89(11), 64(10)。
2d: 产率79%, m.p.137 ℃~138 ℃;1H NMRδ: 3.88(s, 6H), 3.89(s, 3H), 4.41(s, 2H), 4.48(s, 2H), 7.13~7.17(m, 1H), 7.23(d,J=6.0 Hz, 1H), 7.32(s, 2H), 7.23(d,J=8.0 Hz, 1H); IRν: 3 334, 3 124, 2 930, 1 588, 1 496, 1 465, 1 230 cm-1; MSm/z(%): 408(M++2, 5), 406(M+, 14), 371(100), 194(30), 178(24), 150(16), 135(20), 125(92), 89(26), 64(14), 44(15)。
2e: 产率76%, m.p.171 ℃~172 ℃;1H NMRδ: 3.88(s, 6H), 3.89(s, 3H), 4.39(s, 2H), 4.47(s, 2H), 7.02~7.10(m, 2H), 7.27~7.29(m, 2H), 7.32(s, 2H); IRν: 3 365, 3 156, 2 935, 1 578, 1 486, 1 429, 1 240 cm-1; MSm/z(%): 390(M+, 55), 194(20), 178(14), 124(100), 109(86), 83(12)。
2f: 产率74%, m.p.154 ℃~155 ℃;1H NMRδ: 3.87(s, 6H), 3.89(s, 3H), 4.53(s, 2H), 4.61(s, 2H), 7.08~7.12(m, 1H), 7.31(s, 2H), 7.37~7.40(m, 2H); IRν: 3 350, 3 129, 2 930, 1 583, 1 465, 1 434, 1 240 cm-1; MSm/z(%): 442(M++2, 11), 440(M+, 15), 405(100), 282(30), 194(15), 178(10), 159(16)。
2g: 产率74%, m.p.141 ℃~142 ℃;1H NMRδ: 3.87(s, 6H, OCH3), 3.89(s, 3H, O CH3), 4.33(s, 2H, SCH2), 4.61(s, 2H, NH2), 7.21(d,d,J=8.3 Hz, 2.00 Hz, 1H, ArH), 7.26(s, 2H, ArH), 7.36(d,J=8.0 Hz, 1H, ArH), 7.46(d,J=2.4 Hz, 1H, ArH); IRν: 3 360, 3 170(N-H), 2 935(C-H), 1 583(C=N), 1 491, 1 440, 1 235(N-N=C) cm-1; MSm/z(%): 442(M++2, 30), 440(M+, 42), 282(23), 194(76), 174(100), 159(97), 150(32), 135(40), 120(39), 102(54), 89(26), 77(13), 64(21), 45(17)。
2h: 产率71%, m.p.122 ℃~123 ℃;1H NMRδ: 3.86(s, 6H), 3.88(s, 3H), 4.31(s, 2H), 4.53(s, 2H), 7.20(s, 1H), 7.22~7.25(m, 3H), 7.31(s, 2H); IRν: 3 334, 3 257, 2 935, 1 588, 1 490, 1 465, 1 250 cm-1; MSm/z(%): 408(M++2, 20), 406(M+, 50), 282(12), 194(49), 178(34), 150(21), 140(100), 125(91), 102(45), 89(28), 77(10), 63(14), 45(11)。
2i: 产率83%, m.p.202 ℃~203 ℃;1H NMRδ: 3.88(s, 6H), 3.89(s, 3H), 4.26(s, 2H), 4.29(s, 2H), 7.24~7.26(m, 2H), 7.29~7.30(m, 5H); IRν: 3 365, 3 150, 2 945, 1 583, 1 480, 1 434, 1 240 cm-1; MSm/z(%): 372(M+, 61), 194(17), 178(21), 106(83), 91(100), 65(16)。
2 结果与讨论
2.1 合成
在2的合成中,作为缚酸剂的NaOH要用少量水溶解,在反应中,对氟苄氯(1a)和对氯苄氯(1b)与巯基反应较快,开始滴加就有沉淀生成;而有间氯取代的苄氯(1h)与巯基反应较慢,需要24 h才能反应完全。
2.2 生物活性
采用生长速率法测定2对病原菌菌丝生长的抑制作用。供试病原菌:小麦赤霉病菌、半夏立枯病菌和何首乌叶斑病菌,培养基PDA(马铃薯、葡萄糖和琼酯),用药量50 mg·L-1。
将待测菌株接种在PDA平板上,25 ℃培养3 d,用内径为0.5 mm的打孔器把菌落打成菌饼,在无菌操作下移植到含有不同药剂的PDA平板上,以无菌水为对照,在25 ℃恒温下培养3 d后用十字交叉法测量菌落直径,计算相对抑菌率,结果见表1。由表1可见,2b对半夏立枯病菌的抑制率较高,而其它的抑制率较差。
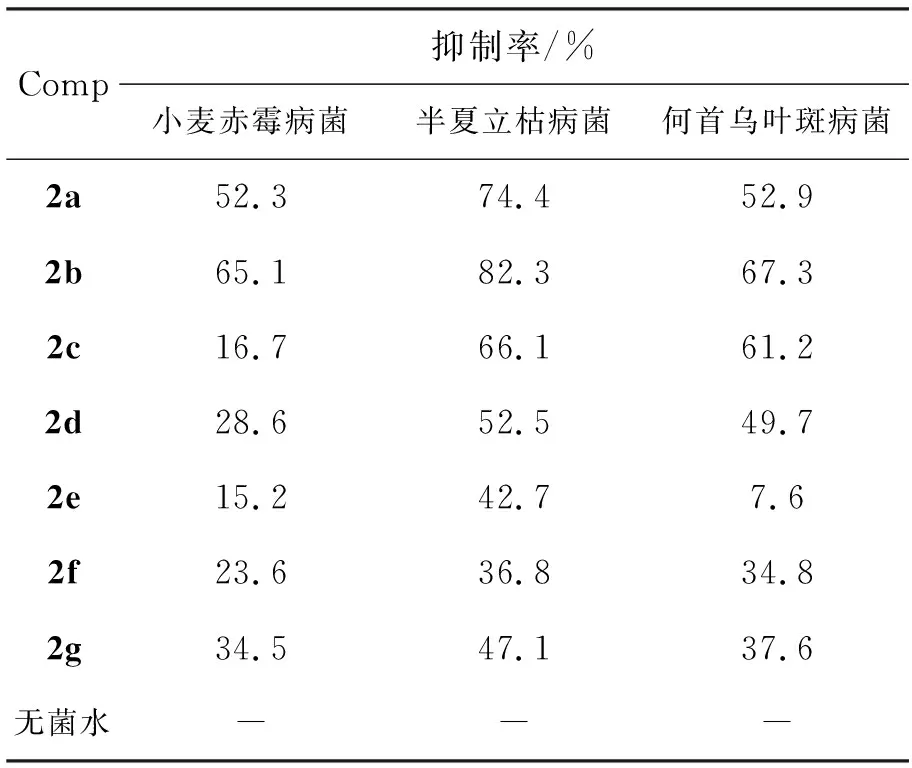
表 1 2的抑菌活性*Table 1 Fungicidal activity of 2
*c(2)=50 mg·L-1
[1] Wang B L, Shi Y X, Ma Y,etal. Synthesis and biological activity of some novel trifluoromethyl-substituted 1,2,4-triazole and bis(1,2,4-triazole) mannich bases containing piperazine rings[J].J Agric Food Chem,2010,58(9):5515-5522.
[2] Ezabadi I R, Camoutsis C, Zoumpoulakis P,etal. Sulfonamide-1,2,4-triazole derivatives as antifungal and antibacterial agents:Synthesis,biological evaluation,lipophilicity,and conformational studies[J].Bioorg Med Chem,2008,16(3):1150-1161.
[3] 朱姗姗,卢俊瑞,辛春伟,等. 3-取代硫基-5-(1-羟基苯基)-4H-1,2,4-三唑类化合物的合成及抑菌活性[J].高等学校化学学报,2010,31(11):2228-2233.
[4] 孙晓红,白燕,刘源发,等. 3-取代苯氧甲基-4-氨基-1,2,4-三唑-5-硫酮席夫碱的合成、结构表征和生物活性研究[J].化学学报,2010,68(2):788-792.
[5] Padmavathi V, Thriveni P, Reddy G S,etal. Synthesis and antimicrobial activity of novel sulfone-linked bis heterocycles[J].Eur J Med Chem,2008,43(5):917-924.
[6] Padmavathi V, Reddy G S, Padmaja A,etal. Synthesis,antimicrobial and cytotoxic activities of 1,3,4-oxadiazoles,1,3,4-thiadiazoles and 1,2,4-triazoles[J].Eur J Med Chem,2009,44(5):2106-2112.
[7] Bayrak H, Demirbas A, Karaoglu S A,etal. Synthesis of some new 1,2,4-triazoles,their Mannich and Schiff bases and evaluation of their antimicrobial activities[J].Eur J Med Chem,2009,44(3):1057-1066.
[8] Metwally K A, Yaseen S H, Lashine E M,etal. Non-carboxylic analogues of arylpropionic acids:Synthesis,anti-inflammatory activity and ulcerogenic potential[J].Eur J Med Chem,2007,42(2):152-160.
[9] Kucukguzel S G, Kucukguzel I, Tatar E,etal. Synthesis of some novel heterocyclic compounds derived from diflunisal hydrazide as potential anti-infective and anti-inflammatory agents[J].Eur J Med Chem,2007,42(7):893-901.
[10] Kumar H, Javed S A, Khan S A,etal. 1,3,4-Oxadiazole/thiadiazole and 1,2,4-triazole derivatives of biphenyl-4-yloxy acetic acid:Synthesis and preliminary evaluation of biological properties[J].Eur J Med Chem,2008,43(12):2688-2698.
[11] Abdel-Megeed A M, Abdel-Rahman H M, Alkaramany G S,etal. Design,synthesis and molecular modeling study of acylated 1,2,4-triazole-3-acetates with potential anti-inflammatory activity[J].Eur J Med Chem,2009,44(1):117-123.
[12] Li Z Z, Gu Z, Yin K,etal. Synthesis of substituted-phenyl-1,2,4-triazol-3-thione analogues with modified D-glucopyranosyl residues and their antiproliferative activities[J].Eur J Med Chem,2009,44(11):4716-4720.
[13] 胡志强,杨亚迅,张功胜,等. 2-{5-[(1H-1,2,4-三唑-1-基)甲基]-4-苯基-4H-1,2,4-三唑-3-硫基}-1-芳基乙酮类化合物的合成、表征及生物活性测试[J].有机化学,2007,27(3):419-423.
[14] 朱姗姗,卢俊瑞,辛春伟,等. 2/3-取代硫基-5-邻羟基苯基唑类化合物的合成及抑菌活性[J].有机化学,2010,30(12):1914-1920.
[15] 李清寒,崔浩. 3-甲基-4-氨基-5-[二(4-氟苯基)]甲硫基-1,2,4-三氮唑席夫碱的微波合成及表征[J].有机化学,2010,30(10):1555-1558.
[16] Grandi M D, Olson M, Prashad A S,etal. Small molecule inhibitors of HIV RT Ribonuclease H[J].Bioorg,Med Chem Lett,2010,20(1):398-402.
[17] Idrees G A, Omar M, Aly O M,etal. Design,synthesis and hypolipidemic activity of novel 2-(naphthalen-2-yloxy)propionic acid derivatives as desmethyl fibrate analogs[J].Eur J Med Chem,2009,44(10):3973-3980.
[18] 杜海堂,杜海军. 6-取代-3-(3,4,5-三甲氧基苯基)-1,2,4-三唑[3,4-b][1,3,4]噻二唑的合成与生物活性[J].有机化学,2010,30(1):137-141.
