金属催化端炔与亚胺衍生物亲核加成制备炔丙基胺的研究进展*
2012-11-21李伯刚
成 明, 李伯刚
(1. 中国科学院 成都有机化学研究所,四川 成都 61004l;2. 中国科学院 研究生院,北京 100039; 3. 中国科学院 成都生物研究所,四川 成都 61004l)
近年来,随着生命科学的蓬勃发展,含氮化合物引起了人们的极大兴趣。在合成的这些含氮化合物中,炔丙基胺就是一类非常重要的合成中间体,被广泛应用于合成天然产物和一些具有一定生物活性的复杂分子。炔丙基胺分子中的C≡C键可以很容易发生氢化反应,此法可以用来设计合成含有不同饱和侧链的α-氨基酸衍生物。另外由于炔基的富电子特性,炔丙基胺化合物可以经历[3+2]或[4+2]环加成反应制备其它类型的非天然氨基酸衍生物(Scheme 1)[1~7]。
在传统的合成炔丙基胺的方法[8~10]中,通常采用炔丙基卤化物、炔丙基磷酸酯或炔丙基三氟甲磺酸酯的氨基化反应和有机金属炔基化试剂、格式试剂与亚胺或亚胺衍生物的亲核加成反应。这些方法通常需要事先合成炔基化试剂或不稳定的亚胺衍生物,反应需要无水、无氧等苛刻条件,并且伴随等量副产物的产生,严重抑制了此方法的广泛应用。与传统合成方法相比,金属催化端炔与亚胺或烯胺(或原位产生的亚胺或烯胺)的亲核加成反应是目前制备炔丙基胺的理想方法,并得到了充分发展。此方法主要分为两类:间接偶联反应和直接偶联反应。间接偶联反应(Scheme 2)属于二元反应,即亚胺与端炔的直接加成反应;直接偶联反应属于三组分反应,即醛或酮、胺、炔三组分一步构建C-N键的反应。与间接偶联反应[11~13]相比,直接偶联反应具有以下几个优点: (1)不需要预先合成比较活泼的亚胺或烯胺; (2)亲核试剂不需要预先活化。
根据偶联反应分类的不同,本文综述了金属催化端炔与醛亚胺、酮亚胺或烯胺(或原位产生的亚胺)的亲核加成制备炔丙基胺的合成方法,并介绍了本小组发展的将原位产生的酮亚胺直接应用于炔加成反应来构建季碳炔丙基胺的方法。
Scheme1
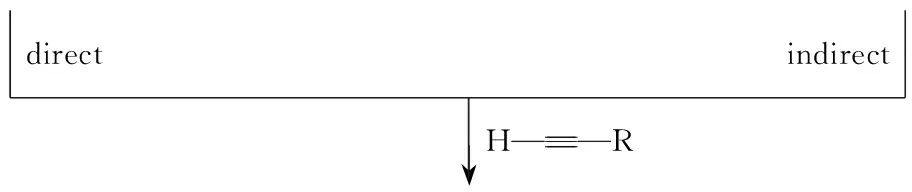
Scheme2
1 间接偶联反应
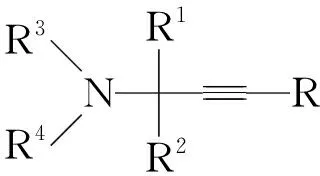
亚胺可分为醛亚胺和酮亚胺。端炔与亚胺或烯胺的亲核加成反应是一类非常重要的制备叔碳或季碳氨基化合物的合成方法,并得到充分发展。此类反应属于二元反应,即亚胺或烯胺与炔的直接加成反应。下面分别介绍了醛亚胺、酮亚胺或烯胺与端炔的亲核加成反应。
Carreira等[14]报道了三甲基硅基乙炔与醛亚胺的加成反应。在[IrCl(COD)]2催化下,合成叔碳炔丙基胺。此反应底物适应性较差。为了克服以上缺点,Carreira等[15]于2004年又报道了炔基锌化合物与N-酰基或N-膦酰基醛亚胺的加成反应。在Zn(OTf)2催化下,合成叔碳炔丙基胺,并得到较好的产率和底物适用性(Scheme 3)。但此类反应通常需要预先制备敏感的亚胺或其衍生物、有机金属亲核试剂,且副产物等量产生。
Knochel等[16,17]分别在2002和2003年报道了烯胺作为亲电试剂的间接炔加成反应,并首次报道了CuBr/(+)-Quinap催化体系,实现了端炔对烯胺的不对称加成,产物ee值高达90%(Scheme 4)。
1995年,M A Huffman等报道了一个通过炔基锂与N-酰基酮亚胺加成制备抗癌候选药物取代喹唑啉酮的反应。Y G Si等[18,19]报道了炔与酮亚胺经间接偶联反应合成季碳炔丙基胺的方法(Scheme 5)。在此反应中,在手性试剂的存在下,炔基直接与N-酰基酮亚胺可手性合成抗HIV药物的反应。
Scheme3
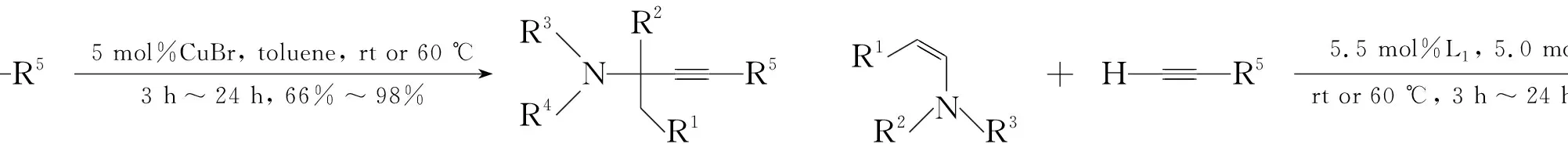
Scheme4
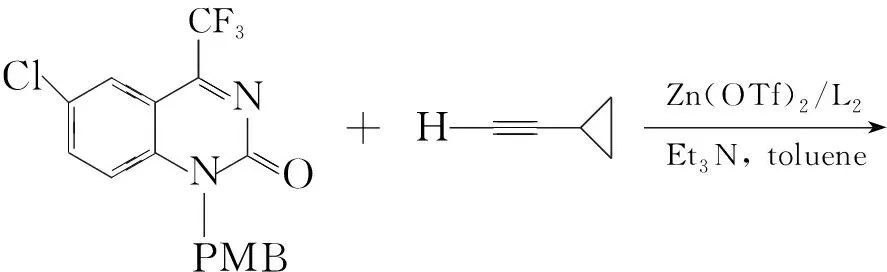
Scheme5
综上所述,与传统合成方法相比,间接偶联反应尽管在一定程度上改善了合成炔丙基氨基化合物的方法,但其需要预先合成比较活泼的亚胺或烯胺和部分反应的亲核试剂需要预先活化的缺点限制了此方法的广泛应用,因此寻找一个高效、方便有用的合成方法成为迫切需要。
2 直接偶联反应
三个或更多的化合物以一锅煮的反应方式形成一个包含所有组分主要结构的新化合物的过程被称为多组分反应。多组分反应过程中至少涉及两个以上的官能团,可将其视为多个双分子反应组合体,但它并不单纯是几个分子在数量上的叠加,还必须是一个根据多米诺规则进行的有序反应。与传统的双分子反应相比,多组分反应在产生分子结构的复杂性和多样性上具有很大的优势。其中,将亚胺和端炔应用于多组分反应的方法受到了广泛的关注,并得到了显著的发展。最具代表性的反应就是A3反应[20~26]。A3反应属于三组分反应,即端炔与醛和胺原位产生的亚胺或亚胺衍生物亲核加成,一步构建叔碳炔丙基胺,此类反应条件温和,易于操作。迄今为止,Ag, Au, Cu, Ir, Zn盐或络合物以及Cu/Ru等双金属催化体系被广泛应用于A3反应体系。其反应机理如Scheme 6所示。
尽管A3反应得到了显著发展,但在这些直接偶联反应中,原位产生的C=N双键亲电试剂仅仅局限于醛亚胺,此反应仅适用于制备叔碳炔丙基胺。与醛亚胺相比,酮亚胺由于空间位阻和电子效应的影响,其反应活性远低于醛亚胺。因此,将原位产生的酮亚胺应用于直接偶联反应,一直以来都是一大挑战。迄今为止,仅有极少报道,并且都有很大的局限性。尽管如此,其在合成季碳炔丙基胺化合物的应用价值依然诱人。
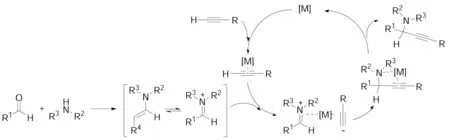
[M]=Ag, Au, Cu, Ir, Zn盐或络合物以及Cu/Ru等双金属催化体系
Scheme7
X=CH2, NAc, NBn, NCO2Et, NBz
Scheme8
R1=R2=Et, 38% yield; R1=Me, R2=Ph, 29% yield
Scheme9
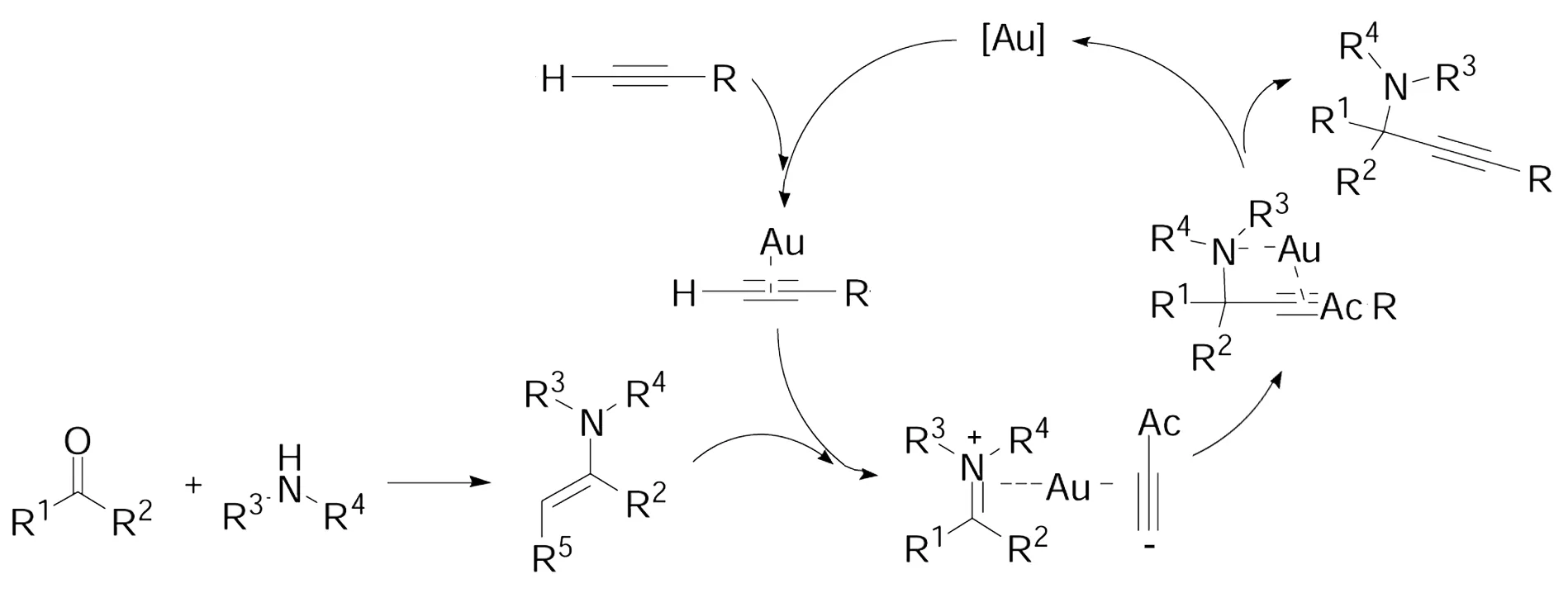
Scheme 10
近年来,Che等报道了Au[P(t-Bu)2(o-biphenyl)]Cl/AgSbF6联合催化的分子内直接偶联反应。但此反应需要事先合成羰基和氨基在同一分子内的特殊化合物,并且反应的底物适仅应用于N-(4-甲氧基苯基)-5-氨基戊-2-酮与苯乙炔的亲核加成反应(Scheme 7)。Van der Eycken等[27]报道了CuI催化的脂肪酮、伯胺、炔三组分反应。此反应需微波辅助、高温下才能获得较好的产率(Scheme 8)。Yus等[28]报道了Cu(OH)x-Fe3O4催化的酮、胺、炔三组分直接偶联反应。底物适应于苯乙炔、3-戊酮或苯乙酮和哌啶,此反应在高温下反应7 d,且产率较低(Scheme 9)[29]。
虽然,以酮为亚胺供体的酮、胺、炔三组分直接偶联制备季碳炔丙基胺的反应取得了一定的进展,但这些反应都受到反应条件和底物适应性的严重限制,极大的降低了这些反应的应用价值。因此发展一种新颖的、高效的酮、胺、炔三组分直接偶联反应,成为化学工作者合成季碳炔丙基胺的重要目标。为此,我们小组发展了一种AuBr3催化三组分酮、胺、炔一步有效合成季碳炔丙基胺的方法。此方法具有:反应条件温和,不需要其它添加剂或外部辅助设备,起始原料简单易得,反应操作简便,反应产率较高。此反应适用于脂肪酮、二级胺、端炔的偶联加成反应,为合成季碳炔丙基胺提供一个高效、方便有用的方法(Scheme 10)[30]。
3 结论
近年来,金属催化端炔与亚胺或烯胺(或原位产生的亚胺或烯胺)的亲核加成反应已经发展成为构建叔碳或季碳C-N键的重要反应。其中,多组分反应是尤为重要的一类,此法不需要事先合成敏感的亚胺或烯胺,不需要预先活化亲核试剂,有望成为合成叔碳或季碳炔丙基胺化合物的重要方法。
[1] Taggi A E, Hafez A M, Lectka T.α-Imino esters:Versatile substrates for the catalytic,asymmetric synthesis ofα- andβ-amino acids andβ-lactams[J].Acc Chem Res,2003,36:10-19.
[2] Ferraris D, Young B, Dudding T,etal. Catalytic,enantioselective alkylation ofα-imino esters using late transition metal phosphine complexes as catalysts[J].J Am Chem Soc,1998,120:4548-4549.
[3] Hagiwara E, Fujii A, Sodeoka M. Enantioselective addition of enol silyl ethers to imines catalyzed by palladium complexes:A novel way to optically active acylalanine derivatives[J].J Am Chem Soc,1998,120:2474-2475.
[4] Kobayashi S, Hamada T, Manabe K. The catalytic asymmetric mannich-type reactions in aqueous media[J].J Am Chem Soc,2002,124:5640-5641.
[5] Knudsen K R, Risgaard T, Nishiwaki N,etal. The first catalytic asymmetric aza-henry reaction of nitronates with imines:A novel approach to optically activeβ-nitro-α-amino acid- andα,β-diamino acid derivatives[J].J Am Chem Soc,2001,123:5843-5844.
[6] Nishiwaki N, Knudsen K R, Gothelf K V,etal. Catalytic enantioselective addition of nitro compounds to imines-A simple approach for the synthesis of optically activeβ-nitro-amino esters[J].Angew Chem,Int Ed Engl,2001,40:2992-2995.
[7] Ji J X, Au Yeung T T L, Wu J,etal. Efficient synthesis ofβ,γ-alkynylα-amino acid derivatives by Ag(Ⅰ)-catalyzed alkynylation ofα-imino esters[J].Adv Synth Catal,2004,346:42-46.
[8] Kopka I E, Fataftah Z A, Rathke M W. Preparation of a series of highly hindered secondary amines,including bis-(triethylcarbinyl)amine[J].J Org Chem,1980,45:4616-4622.
[9] Imada Y, Yuassa M, Nakamura I,etal. Copper(Ⅰ)-catalyzed amination of propargyl esters.Selective synthesis of propargylamines,l-alken-3-ylamines,and (Z)-allylamines[J].J Org Chem,1994,59:2282-2284.
[10] Tubery F, Grierson D S, Husson H P. Simple 4-acetoxy-5,6-dihydropyridinium salts:New synthons for the preparation of functionalized piperidine systems[J].Tetrahedron Lett,1987,28:6457-6460.
[11] List B, Pojarliev P, Biller W T,etal. The proline-catalyzed direct asymmetric three-component Mannich reaction:Scope,optimization,and application to the highly enantioselective synthesis of 1,2-amino alcohols[J].J Am Chem Soc,2002,124:827-833.
[12] Koradin C, Polborn K, Knochel P. Enantioselective synthesis of proargylamines by copper-catalyzed addition of alkynes to enamines[J].Angew Chem Int Ed,2002,41:2535-2538.
[13] Trost B M, Terrell L R. A direct catalytic asymmetric mannich-type reaction tosyn-amino alcohols[J].J Am Chem Soc,2003,125:338-339.
[14] Fischer C, Carreira E M. Direct addition of TMS(acetylene to aldimines catalyzed by a simple,commercially available Ir(Ⅰ) complex[J].Org Lett,2001,3:4319-4321.
[15] Fischer C, Carreira E M. Zn(alkynylide additions to acyl Iminiums[J].Org Lett,2004,6:1497-1499.
[16] Koradin C, Polborn K, Knochel P. Enantioselective synthesis of proargylamines by copper-catalyzed addition of alkynes to enamines[J].Angew Chem Int Ed,2002,41:2535-2538.
[17] Koradin C, Gommermann N, Polborn K,etal. Synthesis of enantiomerically enriched propargylamines by copper-catalyzed addition of alkynes to enamines[J].Chem Eur J,2003,9:2797-2811.
[18] Huffman M A, Yasuda N, Decamp A E,etal. Lithium alkoxides of cinchona alkaloids as chiral controllers for enantioselective acetylide addition to cyclicN-acyl ketimines[J].J Org Chem,1995,60:1590-1594.
[19] Jiang B, Si Y G. Highly enantioselective construction of a chiral tertiary carbon center by alkynylation of a cyclicN-acyl ketimine:An efficient preparation of HIV therapeutics[J].Angew Chem Int Ed,2004,116:218-220.
[20] Wei C M, Li Z G, Li C J. The first silver-catalyzed three-component coupling of aldehyde,alkyne,and amine[J].Org Lett,2003,5:4473-4475.
[21] Park S B, Alper H. An efficient synthesis of propargylamines via C-H activation catalyzed by copper(Ⅰ) in ionic liquids[J].Chem Commun,2005:1315-1317.
[22] Wei C M, Li C J. A highly efficient three-component coupling of aldehyde,alkyne,and amines via C-H activation catalyzed by gold in water[J].J Am Chem Soc,2003,125:9584-9585.
[23] Wei C M, Mague J T, Li C J. Asymmetric catalysis special feature part Ⅱ:Cu(Ⅰ)-catalyzed direct addition and asymmetric addition of terminal alkynes to imines[J]Proc Natl Acad Sci,2004,101:5749-5754.
[24] Li C J, Wei C M. Highly efficient Grignard-type imine additions via C-H activation in water and under solvent-free conditions[J].Chem Commun,2002:268-269.
[25] Ramu E, Varala R, Sreelathaa N,etal. Zn(OAc)2·2H2O:A versatile catalyst for the one-pot synthesis of propargylamines[J].Tetrahedron Lett,2007,48:7184-7190.
[26] Cao K, Zhang F M, Tu Y Q,etal. Iron(Ⅲ)-catalyzed and air-mediated tandem reaction of aldehydes,alkynes and amines:An efficient approach to substituted quinolines[J].Chem Eur J,2009,15:6332-6334.
[27] Liu X Y, Che C M. A highly efficient and selective AuI-catalyzed tandem synthesis of diversely substituted pyrrolo[1,2-a]quinolines in aqueous media[J].Angew Chem Int Ed,2008,47:3805-3810.
[28] Pereshivko O P, Peshkov V A, Van der Eycken E V. Unprecedented Cu(Ⅰ)-catalyzed microwave-assisted three-component coupling of a ketone,an alkyne,and a primary amine[J].Org Lett,2010,12:2638-2641.
[29] Aliaga M J, Ramón D J, Yus M. Impregnated copper on magnetite:An efficient and green catalyst for the multicomponent preparation of propargylamines under solvent free conditions[J].Org Biomol Chem,2010,8:43-46.
[30] Cheng M, Zhang Q, Hu X Y,etal. Gold-catalyzed direct intermolecular coupling of ketones,secondary amines,and alkynes:A facile and versatile access to propargylamines containing a quaternary carbon center[J].Adv Synth Catal,2011,353:1274-1278.
