修饰金鸡纳碱催化的不对称烯丙基烷基化反应*
2012-11-21陈湜,董琳
陈 湜, 董 琳
(四川大学 华西药学院,四川 成都 610041)
烷基取代的β-酮酸酯是一类具有多官能团的化合物,能进行多样性的有机转化,是许多天然产物、生物活性化合物及药物的重要合成中间体,因此成为许多化学家研究的热点[1~3]。
Morita-Baylis-Hillman(MBH)加成产物的不对称烯丙基烷基化反应,是在叔胺或有机磷催化下,通过与不同亲核试剂反应,生成多官能团取代的不对称烯丙基烷基化产物的反应[4~6]。本文以修饰金鸡纳碱的手性叔胺[(DHQD)2AQN(A), (DHQD)2PYR(B), (DHQD)2PHAL(C),D和E(Chart 1)]为催化剂,MBH碳酸酯(2a~2g)与α取代的β-酮酸酯(1h~1m)经不对称烯丙基烷基化反应[7],以中等收率及较好的非对映选择性和对映选择性合成了一系列具有连续季碳叔碳手性中心的烷基取代β-酮酸酯类化合物(3a~3l, Scheme 1),其结构经1H NMR,13C NMR表征。进一步研究表明,3a经还原、内酯化可“一锅”合成三环内酯化合物4。

DEChart 1


CompabcdefgArC6H5-m-ClC6H4-p-NO2C6H4-m-MeC6H4-p-MeC6H4-p-MeOC6H4-p-BrC6H4-ComphijklROCO2Et-OCO2Me-OOPhO-PhSOOCO2Me-POEtOEtOOPh-
Scheme1

Scheme2
1 实验部分
1.1 仪器与试剂
Varian IONVA2 400型核磁共振仪(CDCl3为溶剂,TMS为内标)。
1h~1m[8,9],2a~2g[10],D和E[11]按文献方法合成;A,B,C及其余所用试剂均为市售分析纯。
1.2 合成
(1)3a~3l的合成通法
在反应试管中依次加入A10 mmol%,1m0.1 mmol和CH2Cl21 mL,氩气保护,搅拌下加入2a~2g0.2 mmol,于40 ℃反应至终点(TLC跟踪)。反应液经柱层析[洗脱剂:A=V(石油醚) ∶V(乙酸乙酯)=20 ∶1]分离得白色固体3a~3g。
由2a与1h~1l反应,用类似方法合成白色固体3h~3l(柱层析洗脱剂:A=20 ∶1)。
3的部分实验结果及表征数据见表1和表2。3g的绝对构型见图1。

表 1 合成3的部分实验结果Table 1 Some experimental result of synthesizing 3

图 1 3g的分子结构图Figure 1 Molecular structure of 3g
(2) 4的合成
将3a25 mg(0.066 mmol)在反应

表 2 3的部分表征数据Table 2 Some characteristic data of 3
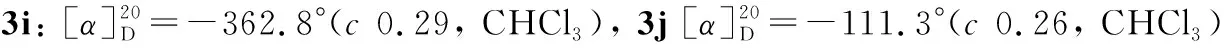

2 结果与讨论
2.1 反应条件选择
(1) 催化剂的筛选
以1h(0.1 mmol)与2a(0.2 mmol)反应合成3h为模型,考察催化剂的活性,结果见表3 。由表3可见,A的催化活性最好。

表 3 合成3h筛选催化剂*Table 3 Selection of catalyst by synthesizing 3h
*以CH2Cl2为溶剂,于40 ℃反应26 h,其余反应条件同1.2(2);ee值由HPLC测定
(2) 溶剂的筛选
以A(10 mmol%)为催化剂,1m(0.1 mmol)与2a(0.2 mmol)于40 ℃反应合成3a为模型,考察溶剂对反应的影响, 结果见表4。由表4可见,溶剂主要对反应的时间和收率产生影响,而对ee值无显著影响。其中,以三氟甲苯做溶剂时收率最高,但同时反应时间延长,ee值也仅略有提高,经过比较,选用了反应时间最短、收率和ee值相对较好的CH2Cl2做溶剂。

表 4 合成3a筛选溶剂*Table 4 Selection of solvent by synthesizing 3a
*催化剂10 mol%A,其余反应条件同表3
综上所述,以1和2为底物的不对称烯丙基烷基化反应的最佳条件为:1 0.1 mmol,n(1) ∶n(2)=1 ∶2,催化剂10 mol%A, CH2Cl2为溶剂,反应温度40 ℃。
2.2 底物结构对反应的影响
(1)2的取代基对反应的影响
在最佳反应条件下,1m(0.1 mmol)分别与2a~2g(0.2 mmol)反应合成3a~3g,考察2的取代基对反应的影响,结果见表5。由表5可见,苯环上具有供电子基团(2d和2e)时,ee值略有升高,而具有吸电子基团(2c)时,ee值相对较低。

表 5 2的取代基对烷基化反应的影响*Table 5 Effect of substituent group of 2 on the allylic alkylation
*1 0.1 mmol,n(1) ∶n(2)=1 ∶2,催化剂10 mol%A, CH2Cl2为溶剂,反应温度40 ℃
(2) 1结构对反应的影响
2a分别与不同结构类型的酮酸酯(1h~1l)反应,考察1结构对反应的影响,结果见表6。由表6可见,无论是芳基环状酮酸酯(1h和1i),酮酸内酯(1j),还是其他含活泼亚甲基的类双羰基化合物[如用砜基代替酮羰基的砜基酯(1k)和用膦酸酯代替碳酸酯的酮基膦酸酯(1l)]均能取得中等收率以及中等到较好对映选择性的结果。
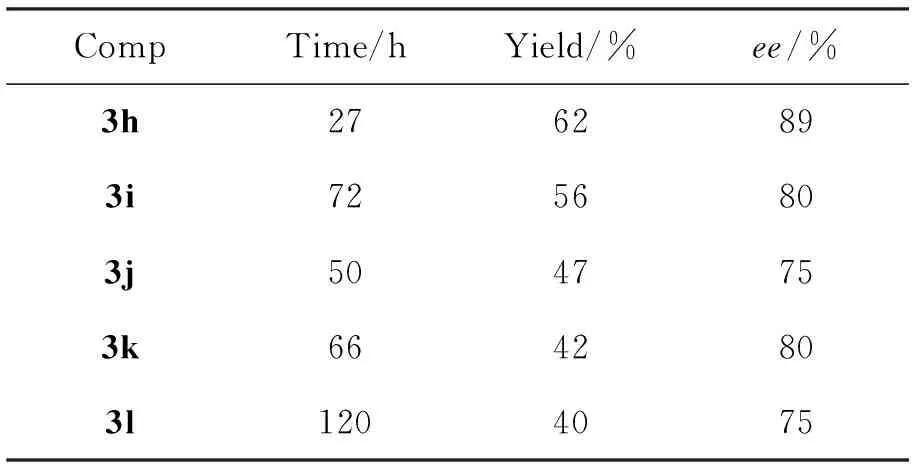
表 6 1结构对反应的影响*Table 6 Effect of structure of 1 on the allylic alkylation
*2a0.2 mmol,其余反应条件同表5
3 结论
本文实现了修饰金鸡纳碱的手性叔胺催化剂催化的Morita-Baylis-Hillman碳酸酯与α-取代的β-酮酸酯的不对称烯丙基烷基化反应,成功构建了具有连续季碳叔碳手性中心的烷基取代β-酮酸酯类化合物,并取得中等收率以及较好对映选择性的结果。
以3a为代表衍生得到三环内酯化合物4,保持了中等收率及中等对映选择性。
[1] Faye Maertens, Suzanne toppet, Frans compernolle. Incorporation of diarylbutylamine pharmacophore into indeno- or naphtho[1,2-b]pyran Ring Systems[J].Eur J Org Chem,2004:2707-2714.
[2] Eugene G, Tamar Y, Alfred H. Utilization of ethyl 2-[(phenylsulfonyl)methyl]acrylate for the synthesis ofα-methylenevalerolactones[J].J Org Chem,1990,55(24):5977-5982.
[3] Carlos A M Fraga, Lis Helena P Teixeira, Carla Maria de S Menezes,etal. Studies on diastereoselective reduction of cyclicβ-ketoesters with boron hydrides.Part 4:The reductive profile of functionalized cyclohexanone derivatives[J].Tetrahedron,2004,60:2745-2755.
[4] Peng J, Cui H L, Chen Y C. Organocatalytic asymmetric allylic alkylation of sulfonylimidates with Morita-Baylis-Hillman carbonates[J].Science China Chemistry,2011,54(1):81-86.
[5] Cui H L, Peng J, Chen Y C.etal. Dual organocatalysis:Asymmetric allylic-allylic alkylation ofα,α-dicyanoalkenes and Morita-Baylis-Hillman carbonates[J].Chem Eur J,2009,15:1574-1577.
[6] Peng J, Huang X, Chen Y C. Organocatalytic and electrophilic approach to oxindoles withC3-quaternary stereocenters[J].Org Lett,2010,12(19):4260-4263.
[7] 方玲,石岩,朱成建. 有机小分子催化的α-酮酯不对称β-官能化反应[J].化学进展,2010,22(9):1679-1686.
[8] House H O, Hudson C B.Perhysro indan derivatives Ⅻ6-Methoxyindanone and its derivatives[J].J Org Chem,1970,35(8):647-651.
[9] Jack K Crandall, Chrostian Pradat. Synthesis of Sulfones by phase-transfer alkylation of arenesulfinate salts[J].J Org Chem,1985,50(8):1327-1329.
[10] Feng J, Lu X, Kong A,etal. A highlyregio- andstero-selective [3+2] annulation of allylic compounds and 2-substituted 1,1-dicyanoalkenes through a catalytic carbo-phosphorus ylid reaction[J].Tetrahedron,2007,63:6035-6041.
[11] D Y S, Han X L, Lu X Y. Alkaloids-catalyzedregio- andenantio-selective allylic nucleophilic substitution oftert-butyl carbonate of the Morit-Baylic-Hillman products[J].Tetrahedron Lett,2004,45:4967-4971.
