Meinwald-Friedländer反应合成3-芳基取代喹啉*
2012-11-21罗万荣仇文卫
罗万荣, 仇文卫, 杨 帆, 汤 杰
(华东师范大学 科学与技术跨学科高等研究院,上海 200062)
喹啉、取代喹啉及其衍生物广泛存在于天然产物中,具有广泛的生物活性,用于治疗多种疾病。Friedländer反应[1]是合成取代喹啉化合物的一种有效方法:邻氨基苯甲醛(2m)或芳香族邻氨基羰基化合物与至少含一个α-亚甲基的羰基化合物在酸或碱催化下发生缩合的反应。然而,应用Friedländer反应制备3-芳基取代喹啉时,由于苯乙醛性质活泼,易于发生氧化、聚合等,难以高效制备和储存。
本文用三氟甲磺酸(TfOH)催化查尔酮环氧化物(1a~1j)在氯苯中开环-重排,然后叔丁醇钾(KOtBu)作碱与2m通过Meinwald-Friedländer反应,“一锅”合成了3-芳基取代喹啉(3a~3f,3j~3l),收率51%~74%;同时生成苯甲酸(4a)或取代苯甲酸(4g~4l, Scheme 1)。TfOH催化1a~1k在二氯甲烷中发生Meinwald重排,生成相应的开环产物3-氧代-2,3-二芳基丙醛(5a~5k, Scheme 2),收率48%~89%。化合物的结构经NMR和MS确证。
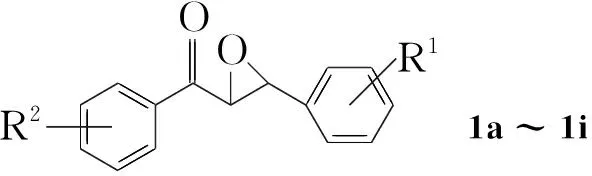
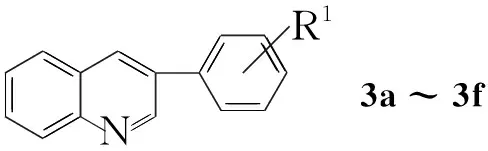

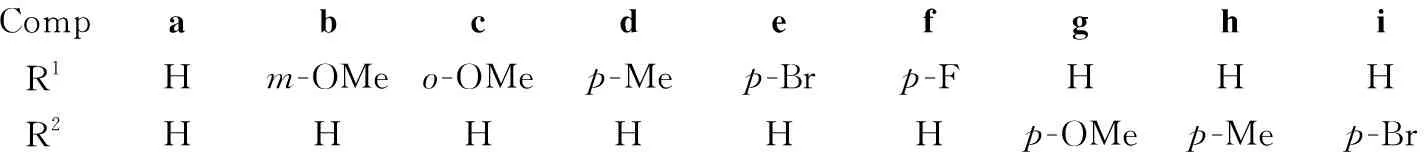
CompabcdefghiR1Hm-OMeo-OMep-Mep-Brp-FHHHR2HHHHHHp-OMep-Mep-Br
Scheme1

Scheme2
1 实验部分
1.1 仪器与试剂
Bruker-500型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker micrOTOF Ⅱ型高分辨飞行时间质谱仪。
所用试剂均为分析纯,使用前经纯化或干燥处理。
1.2 3的合成通法
在反应管中加入1a~1j0.25 mmol的氯苯(1.5 mL)溶液和5 mol%TfOH,搅拌下于室温反应10 min;加入2m0.375 mmol,于100 ℃反应约90 min(TLC跟踪,中间体基本转化完全);加入KOtBu 0.5 mmol,于100 ℃反应10 min。加水,分液,有机相用无水硫酸钠干燥,旋干溶剂,残余物经柱层析[洗脱剂:A=V(乙酸乙酯) ∶V(石油醚)=1 ∶5~1 ∶10]纯化得3a~3f或3j。
1a与间甲氧基邻氨基苯甲醛(2k)或间溴邻氨基苯甲醛(2l)反应,用类似方法合成3k或3l。
1.3 TfOH催化1的Meinwald重排
在反应管加入1a~1k5 mmol的二氯甲烷(25 mL)溶液和5 mol%TfOH,搅拌下于室温反应(TLC跟踪)。旋干溶剂,残余物经快速柱色谱(A=1 ∶10)分离纯化得5a~5k(Scheme 2)。
2 结果与讨论
2.1 1的开环反应
在研究1的制备及应用过程中发现,TfOH可以高效催化1的Meinwald反应,生成相应的开环产物5。
文献报道三氟甲磺酸铒[Erbium(Ⅲ) Triflate][2], BF3·Et2O[3], Au(PPh)3Cl/AgOTf[4]等体系可以催化α-羰基环氧化物的开环反应,但是需要较长的反应时间。本文采用5 mol%TfOH催化1的Meinwald反应,几分钟即可完成反应。
15 mmol, 5 mol%TfOH, CH2Cl225 mL,其余反应条件同1.3,考察了1a~1k的开环反应(产物5a~5k),结果见表1。由表1可见,苯环取代基的电子效应对反应无显著影响,1a~1j通过Meinwald反应均以良好的分离收率生成相应的开环-重排产物5a~5j;乙酰基取代的非查尔酮类环氧化物(1k)在该条件下的开环-重排反应收率相对较低(5k, 48%)。该研究结果为芳香取代β-酮基醛类化合物的高效制备提供了一种简便的新方法。
根据上述结果,我们推测该反应的可能机理与文献[5]报道相类似。
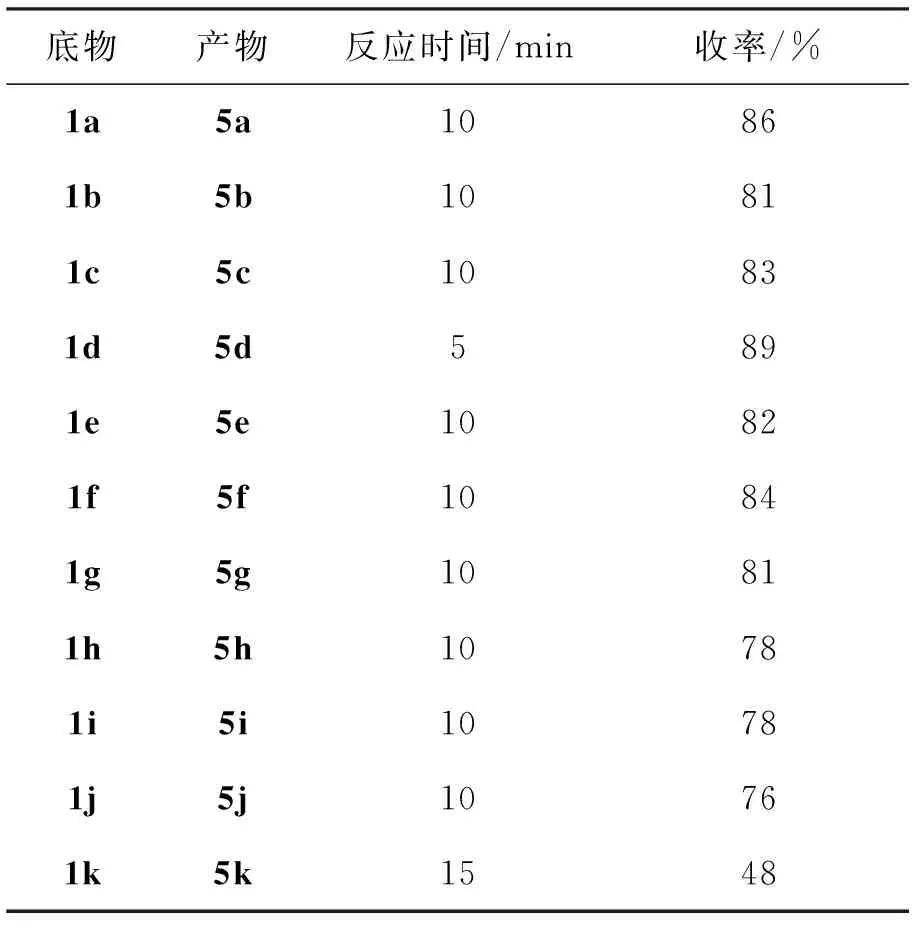
表 1 1的开环反应*Table 1 Ring-opening reaction of 1
*15 mmol, 5 mol%TfOH, CH2Cl225 mL,其余反应条件同1.3;分离收率
2.1 Meinwald-Friedländer反应“一锅”合成3
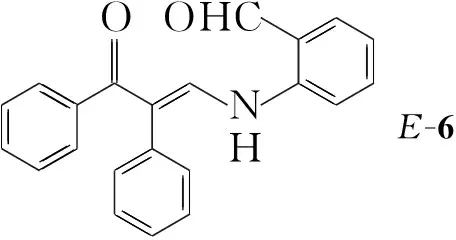
仔细分析5的结构,发现其为醛基取代的α-亚甲基羰基化合物,由此我们设想以1为原料,通过Meinwald-Friedländer反应“一锅”合成3。据此,我们以TfOH催化1a与2m的反应为模型,但未获得目标产物3a,改用BF3·Et2O作催化剂,仍未成功,仅分离出烯胺酮中间体(6, Chart 1)。
通过进一步的反应条件探索发现,当反应生成5a之后加入碱可以促进3a的形成。由此,我们考察了不同体系,包括碱的改变、溶剂及反应温度变化对合成3a的影响,结果见表2。从表2可以看出,采用TfOH-KOtBu, TfOH-KOH, TfOH-K3PO4, TfOH-DBU体系进行Meinwald-Friedländer反应均以良好的收率得到3a(No.7, No.16, No.17, No.19和No.21)。碱性强弱对烯胺酮的环合反应有一定影响,强碱可以促进反应进行(No.15, No.17, No.21)。溶剂的结构和极性对反应也存在显著影响,以氯苯作溶剂可以获得较理想的收率。
*1a0.250 mmol,2m0.375 mmol, 溶剂1.5 mL,碱0.5 mmol,其余反应条件同1.2;分离收率

表 3 合成3的实验结果*Table 3 Experimental result of synthesizing 3
*(1)10.25 mmol, 5 mol%TfOH,氯苯1.5 mL,于室温反应10 min; (2)20.375 mmol,于100 ℃反应90 min; (3) KOtBu 0.5 mmol,于100 ℃反应10 min。分离收率
筛选结果表明最佳反应条件为:氯苯作溶剂,5 mol%TfOH催化1a开环-重排、然后KOtBu作碱与2m通过Meinwald-Friedländer反应关环,“一锅”合成3a,收率74%(No.17)。
在最佳条件下考察了Meinwald-Friedländer“一锅”合成3的普适性。结果见表3。从表3可以看出,被考察的1与2经Meinwald-Friedländer反应,均可以中等到较好的收率一步得到3,收率51%~74%。3j收率相对较低,可能是由于噻吩基团的稳定性较差,在该反应条件下生成较多的副产物。此外,1的苯甲酰基部分的取代基电子效应对反应有一定影响,相对于给电子基团,吸电子基团因有助于重排后得到的苯甲酰氧基的离去而使得反应收率较高(以1g和1i为底物)。2的取代基对反应未显示明显影响,吸电子基(2l)稍有利于反应进行,给电子基取代的2k由于相对较易发生自聚反应而导致收率略有下降(相对于由1a与2m合成3a)。
3和5的MS数据见表4, NMR数据见表5。

表 4 3和5的MS数据Table 4 MS data of 3 and 5
*MSm/z: Calcd for [M+Na]+

表 5 3和5的NMR数据Table 5 NMR data of 3 and 5
续表5

Comp1H NMR δ(J/Hz)13C NMR δ3c9.12(d, J=2.2, 1H), 8.25(d, J=2.2, 1H), 8.13(d, J=8.0, 1H), 7.84(d, J=8.0, 1H), 7.72~7.68(m, 1H), 7.56~7.52(m, 1H), 7.43~7.38(m, 2H), 7.12~7.03(m, 2H), 3.83(s, 3H)156.7, 152.0, 146.8, 135.4, 131.6, 130.9, 129.6, 129.1, 129.1, 127.9, 127.1, 126.5, 121.1(2C), 111.2, 55.53d9.17(d, J=2.0, 1H), 8.27(s, 1H), 8.13(d, J=8.0, 1H), 7.86(d, J=8.0, 1H), 7.72~7.54(m, 4H), 7.34~7.32(m, 2H), 2.43(s, 3H)150.0, 147.3, 138.1, 135.1, 133.9, 132.9, 130.0, 129.3(2C), 129.2, 128.2, 128.0, 127.3(2C), 127.0, 21.13e9.13(d, J=2.2, 1H), 8.26(d, J=2.2, 1H), 8.14(d, J=8.0, 1H), 7.87(d, J=8.0, 1H), 7.75~7.71(m, 1H), 7.66~7.63(m, 2H), 7.60~7.56(m, 3H)149.4, 147.5, 136.8, 133.1, 132.6(2C), 132.3, 129.6, 129.3, 129.0(2C), 128.0, 127.9, 127.2, 122.53f9.13(d, J=2.2, 1H), 8.25(d, J=2.2z, 1H), 8.14(d, J=8.0, 1H), 7.87(d, J=8.0, 1H), 7.74~7.65(m, 3H), 7.60~7.56(m, 1H), 7.23~7.19(m, 2H)164.3, 161.8, 149.8, 147.4, 134.1, 133.1, 133.0, 129.5, 129.3, 129.2, 129.1, 128.0, 127.2, 116.3, 116.13j9.21(d, J=2.2, 1H), 8.27(d, J=2.2, 1H), 8.10(d, J=8.0, 1H), 7.83(d, J=8.0, 1H), 7.71~7.67(m, 1H), 7.57~7.49(m, 2H), 7.40~7.39(m, 1H), 7.17~7.15(m, 1H)148.6, 147.3, 140.7, 131.3, 129.3, 129.3, 128.4, 127.9, 127.8, 127.5, 127.2, 126.1, 124.43k9.02(d, J=2.2, 1H), 8.19(d, J=2.2, 1H), 8.03~8.01(m, 1H), 7.71~7.69(m, 2H), 7.54~7.50(m, 2H), 7.45~7.41(m, 1H), 7.38~7.35(m, 1H), 7.13~7.12(m, 1H), 3.95(s, 3H)158.2, 147.5, 138.1, 134.2, 132.1, 130.7, 129.2(2C), 129.1(2C), 128.1, 127.5(2C), 122.2, 105.3, 55.53l9.17(d, J=2.2, 1H), 8.18(d, J=2.2, 1H), 8.03~7.99(m, 2H), 7.79~7.76(m, 1H), 7.70~7.68(m, 2H), 7.55~7.51(m, 2H), 7.47~7.44(m, 1H)150.3, 145.8, 137.3, 134.7, 132.8, 132.0, 130.9, 129.9, 129.3(2C), 129.2, 128.4, 127.5(2C), 120.95a15.93(d, J=5.0, 1H), 8.64(d, J=5.0, 1H), 7.37~7.35(m, 3H), 7.28~7.21(m, 5H), 7.11~7.10(m, 2H)185.42, 184.42, 135.64, 135.45, 131.27, 130.11, 129.20, 128.67, 127.89, 127.09, 116.125b15.93(d, J=5.5, 1H), 8.64(d, J=5.0, 1H), 7.40~7.36(m, 3H), 7.25~7.16(m, 3H), 6.81(d, J=2.5, 1H), 6.69~6.63(m, 2H), 3.69(s, 3H)185.38, 184.34, 159.66, 136.94, 135.36, 131.29, 129.62, 129.09, 127.88, 122.57, 115.96, 115.60, 112.62, 55.115c15.66(d, J=6.0, 1H), 8.43(d, J=5.5, 1H), 7.36~7.34(m, 2H), 7.32~7.24(m, 2H), 7.19~7.16(m, 2H), 7.10~7.08(m, 1H), 6.92~6.89(m, 1H), 6.76~6.74(m, 1H), 3.42(s, 3H)186.65, 182.88, 157.15, 136.52, 131.46, 130.85, 129.19, 127.87, 127.59, 124.72, 120.90, 111.78, 111.02, 54.90
续表5
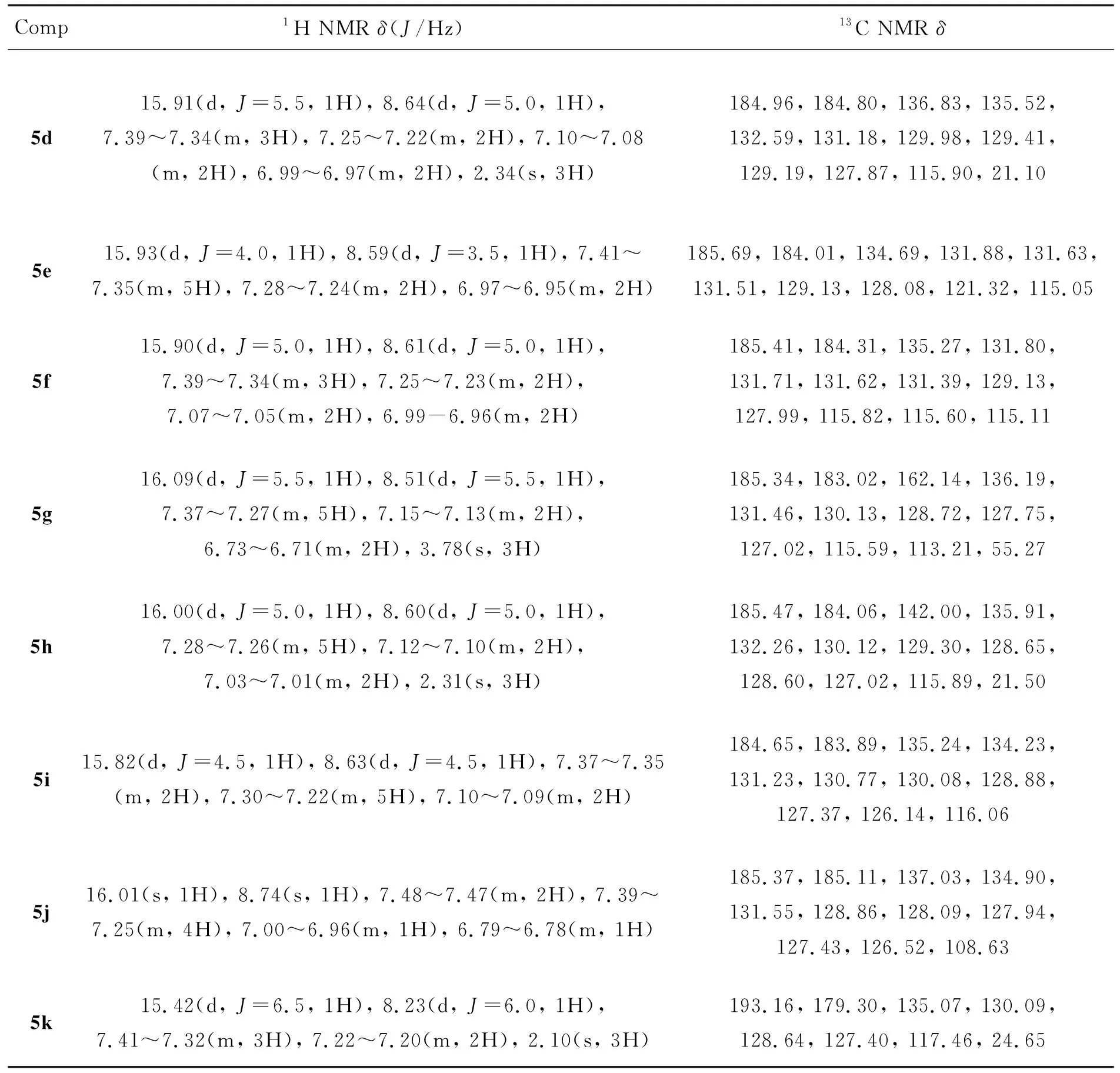
Comp1H NMR δ(J/Hz)13C NMR δ5d15.91(d, J=5.5, 1H), 8.64(d, J=5.0, 1H), 7.39~7.34(m, 3H), 7.25~7.22(m, 2H), 7.10~7.08(m, 2H), 6.99~6.97(m, 2H), 2.34(s, 3H)184.96, 184.80, 136.83, 135.52, 132.59, 131.18, 129.98, 129.41, 129.19, 127.87, 115.90, 21.105e15.93(d, J=4.0, 1H), 8.59(d, J=3.5, 1H), 7.41~7.35(m, 5H), 7.28~7.24(m, 2H), 6.97~6.95(m, 2H)185.69, 184.01, 134.69, 131.88, 131.63, 131.51, 129.13, 128.08, 121.32, 115.055f15.90(d, J=5.0, 1H), 8.61(d, J=5.0, 1H), 7.39~7.34(m, 3H), 7.25~7.23(m, 2H), 7.07~7.05(m, 2H), 6.99-6.96(m, 2H)185.41, 184.31, 135.27, 131.80, 131.71, 131.62, 131.39, 129.13, 127.99, 115.82, 115.60, 115.115g16.09(d, J=5.5, 1H), 8.51(d, J=5.5, 1H), 7.37~7.27(m, 5H), 7.15~7.13(m, 2H), 6.73~6.71(m, 2H), 3.78(s, 3H)185.34, 183.02, 162.14, 136.19, 131.46, 130.13, 128.72, 127.75, 127.02, 115.59, 113.21, 55.275h16.00(d, J=5.0, 1H), 8.60(d, J=5.0, 1H), 7.28~7.26(m, 5H), 7.12~7.10(m, 2H), 7.03~7.01(m, 2H), 2.31(s, 3H)185.47, 184.06, 142.00, 135.91, 132.26, 130.12, 129.30, 128.65, 128.60, 127.02, 115.89, 21.505i15.82(d, J=4.5, 1H), 8.63(d, J=4.5, 1H), 7.37~7.35(m, 2H), 7.30~7.22(m, 5H), 7.10~7.09(m, 2H)184.65, 183.89, 135.24, 134.23, 131.23, 130.77, 130.08, 128.88, 127.37, 126.14, 116.065j16.01(s, 1H), 8.74(s, 1H), 7.48~7.47(m, 2H), 7.39~7.25(m, 4H), 7.00~6.96(m, 1H), 6.79~6.78(m, 1H)185.37, 185.11, 137.03, 134.90, 131.55, 128.86, 128.09, 127.94, 127.43, 126.52, 108.635k15.42(d, J=6.5, 1H), 8.23(d, J=6.0, 1H), 7.41~7.32(m, 3H), 7.22~7.20(m, 2H), 2.10(s, 3H)193.16, 179.30, 135.07, 130.09, 128.64, 127.40, 117.46, 24.65
[1] Marco-Contelles J, Perez-Mayoral E, Samadi A,etal. Recent advances in the Friedländer reaction[J].Chem Rev,2009,109:2652-2671.
[2] Procopio A, Dalpozzo R, De Nino A,etal. Erbium(Ⅲ) triflate:A valuable catalyst for the rearrangement of epoxides to aldehydes and ketones[J].Synlett 2004,14:2633-2635.
[3] Mathew P, Mathew D, Asokan C V. Efficient synthesis of deoxybenzoins from chalcones[J].Syn Commun,2007,37:661-665.
[4] Dai L, Shi M. Gold(Ⅰ) catalysis:Selective synthesis of six- or seven-membered heterocycles from epoxy alkynes[J].Eur J Org Chem,2009:3129-3133.
[5] Ranu B C, Jana U. Indium(Ⅲ) chloride-promoted rearrangement of epoxides:A selective synthesis of substituted benzylic aldehydes and ketones[J].J Org Chem,1998,63:8212-8216.
