α-平滑肌肌动蛋白在PVR增生膜中的表达以及PDGF对其在人RPE细胞中表达的影响
2012-11-13司艳芳韩泉洪惠延年
司艳芳 王 君 关 娟 韩泉洪 惠延年
增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)是视网膜表面和玻璃体后面广泛纤维增生膜收缩、牵拉而引起的视网膜脱离性疾病,是孔源性视网膜脱离复位手术失败的主要原因[1-2]。动物实验表明,在猫的孔源性视网膜脱离发生后24 h,脱离视网膜下方的视网膜色素上皮(retinal pigment epithelium,RPE)细胞核重新开始合成DNA,而在未脱离的区域未见此现象[3]。RPE细胞一旦脱离原位,离开自身原有的微环境开始增殖,便进入一种与生长因子相关的正反馈自分泌调节状态,即细胞产生生长因子,而这些生长因子又刺激细胞增殖、迁移,合成细胞外基质,发生形态学改变等[4-5]。部分RPE细胞表现出肌成纤维细胞样特征,产生特殊的微丝微管结构,有自身收缩功能,并能介导胶原等细胞基质的收缩[6-7]。这种自分泌调节的循环在血小板源性生长因子(platelet-derived growth factor,PDGF)的作用下已经得到验证[8-9]。
α-平滑肌肌动蛋白(α-SMA)是在多种类型细胞胞浆中表达的、具有收缩功能的细胞骨架微丝结构蛋白,是细胞移行和收缩功能的基础。目前对α-SMA与PVR病变程度的相关性以及PDGF对α-SMA在RPE细胞中表达的影响研究较少。本研究采用免疫荧光、免疫组织化学和细胞爬片等技术,来研究α-SMA在不同病变程度PVR中的表达以及PDGF对人RPE细胞表达α-SMA的影响。
1 材料与方法
1.1 研究对象与仪器
1.1.1 研究对象 收集解放军总医院第二附属医院眼科在2005年1月至2006年3月确诊为孔源性视网膜脱离伴PVR的患者14例视网膜组织,患者年龄4~63岁,病程2个月~2 a。PVR病变程度分级标准参照美国视网膜学会的分级方法,分为C3~D3。排除外伤性视网膜脱离、PVR、视网膜中央静脉阻塞、Eales病、Coats病等引起的继发性视网膜脱离和系统性疾病。患者PVR玻璃体均使用Premiere(Storzs公司)玻璃体切割机进行,速度为600~750次·min-1,吸力为40 kPa。用玻璃体镊取出视网膜表面增生膜,其中下膜5例,前膜9例。
1.1.2 细胞培养 原代培养的人RPE细胞由第四军医大学西京医院王雨生教授惠赠,人RPE细胞培养在含有体积分数10%胎牛血清(fetal bovine serum,FBS)的DMEM培养基中,置于37℃、含体积分数5%CO2恒温培养箱培养。
1.1.3 主要试剂及仪器 BFS(GIBCO),DMEM培养基(GIBCO),一抗:鼠抗人α-SMA一抗,二抗:羊抗鼠多克隆二抗(武汉博士德公司),DAB免疫组织化学试剂盒(丹麦 DAKO公司),抗 Avidin标记的Texas Red(美国Molecular Probes公司),抗生物素标记的FITC荧光染料(美国Molecular Probes公司),PDGF-BB(美国 Sigma公司),细胞培养箱(美国SHELLAB公司),LKB V型超薄切片机(瑞典),MR-1024激光共聚焦显微镜(美国Bio-Red公司)。
1.2 免疫组织化学染色 14例视网膜表面增生膜(PRM)于4℃用40 g·L-1多聚甲醛固定30 min。经脱水、透明和浸蜡后制成5 μm厚的切片并且贴附于用多聚赖氨酸涂片的玻片上。切片用体积分数3%H2O2-甲醇孵育10 min封闭内源性过氧化物酶,漂洗后于98℃微波炉修复抗原10 min,冷却至室温。滴加正常羊血清(1∶50稀释)于室温孵育30 min,后滴加鼠抗人α-SMA一抗(于4℃过夜孵育)。漂洗后滴加抗生物素标记的羊抗鼠多克隆二抗(1∶500稀释,37℃孵育30 min)。最后滴加ABC复合物,在显微镜下观察DAB-H2O2显色反应,自来水冲洗终止反应。最后经苏木精复染,常规脱水透明,封片,于光镜下观察、照相。
1.3 免疫荧光染色 石蜡标本常规脱蜡,然后进行如下操作:滴加正常羊血清(1∶50稀释),室温温育30 min;漂洗后与鼠抗人α-SMA(1∶50稀释)一抗混合于4℃孵育过夜;漂洗后与生物素标记的二抗(1∶50稀释)在37℃温育30 min;最后滴加抗生物素标记的Texas Red(1∶1 000稀释),于37℃放置30 min。漂洗后用甘油封片,于激光共聚焦显微镜下观察并照相,进行定量分析。空白对照使用PBS代替鼠抗人α-SMA一抗,用体积比1∶50稀释的正常羊血清作为替代对照。阳性对照均采用心脏平滑肌组织(该组织中α-SMA有明确的表达)。
1.4 细胞爬片实验 生长良好的人RPE细胞经胰蛋白酶液消化制成单细胞悬液。将100 μL含有20×106L-1人RPE细胞的悬液滴于铺在24孔板底部的无菌盖玻片上,恒温培养箱培养4 h后进行后续实验。将实验细胞分成两组进行处理:含有体积分数2%FBS的DMEM处理组(2%DMEM组)和无血清DMEM培养组(无血清DMEM组)。每组培养基中分别加入不同浓度的 PDGF-BB(0 μg·L-1、1 μg·L-1、50 μg·L-1)混合培养。24 h 后取出细胞爬片,用0.01 mol·L-1PBS 漂洗 2 次,40 g·L-1多聚甲醛固定好,干燥后于-20℃保存或进行免疫荧光染色实验,步骤同1.3。
1.5 结果判定和统计学分析 免疫组织化学染色结果,细胞浆内呈棕黄色者为阳性细胞。阳性细胞的计数以每个视野(200×)计数100个细胞中呈阳性的细胞数,每个标本计算5个视野,取均值。免疫荧光染色结果,在595 nm(组织标本)或540 nm(细胞爬片标本)激发光情况下,所有被Texas Red染色的细胞显示了强的胞浆内红色荧光。共聚焦显微镜下随机观察5个高倍镜视野(200×),统计阳性细胞的荧光强度。组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 α-SMA在不同PVR中的表达 免疫组织化学染色结果显示,在14例不同级别的PRM中α-SMA均表达为阳性,但其阳性程度存在差异(图1A)。在6例PVR/C3级PRM中,α-SMA阳性细胞的比率为35/80,呈散在分布,细胞染色及形状随分布区域的不同有所差异;在8例PVR/D级的增生膜中,α-SMA阳性细胞约占50/60,多分布于膜表面,染色较深,胞体呈梭形,胞核呈长圆形(图1B),常可见此类细胞在膜组织的起伏呈“搭桥样”,而在组织的中央区阳性细胞数较少。
免疫荧光与免疫组织化学染色结果一致(图1C-图1D)。荧光定量分析显示,PVR/C3级的PRM中α-SMA平均荧光强度为12.31,而 D级 PRM 中 α-SMA平均荧光强度为23.09,是C级增生膜的1.88倍(P <0.01;图1E-图1F)。
2.2 PDGF-BB促进体外培养的RPE细胞表达α-SMA 在无血清DMEM组的细胞爬片中,α-SMA阳性细胞占50%~60%,平均荧光强度为10.08;在50 μg·L-1PDGF-BB刺激后,阳性细胞比例增加至80%~90%,平均荧光强度增加至17.23(图2;P<0.05)。含有体积分数2%FBS的DMEM处理后,α-SMA阳性细胞比例为80%,添加50 μg·L-1PDGFBB后,几乎全部的细胞均表达α-SMA,且荧光强度明显增加,分别为无血清DMEM、无PDGF-BB作用组和2%DMEM、无PDGF-BB作用组细胞荧光强度的2.0 倍和1.5 倍,达到21.36(表1)。
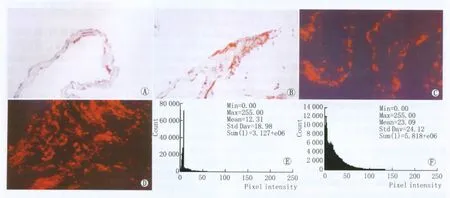
Figure 1 Expression of α-SMA in PRM of PVR with different grades.A,B:Distribution of α-SMA in PRM with grade C and D detected by Immunohistochemistry;C,D:Expression of α-SMA in PRM with grade C and D detected by immunofluorescence;E,F:Fluorescence intensity of α-SMA in PRM of PVR with different grades α-SMA在不同病变程度PVR的PRM中表达不同。A、B:免疫组织化学检测α-SMA在PVR C级增生膜和D级增生膜中的分布;C、D:免疫荧光检测α-SMA在PVR C级增生膜和D级增生膜中的表达;E、F:α-SMA在不同级别PVR增生膜中表达的荧光定量分析结果

表1 不同浓度PDGF对人RPE细胞α-SMA表达的影响Table 1 Effects of PDGF with different concentrations on expression of α-SMA in human RPE cells(fluorescence intensity)
无血清DMEM组和2%DMEM组间荧光强度(P=0.026 7<0.05)和不同PDGF浓度组间(P=0.010 6<0.05)均存在显著性差异,这一结果显示不同浓度的PDGF均能显著促进α-SMA在人RPE细胞中的表达。进行线性相关分析显示,PDGF浓度与人RPE细胞α-SMA表达呈正相关,即PDGF-BB促进α-SMA在人RPE中的表达呈剂量依赖性,而且培养基中的血清能明显增强这一作用(图2)。
3 讨论

Figure 2 PDGF-BB promoted the expression of α-SMA in human RPE cell cultured in vitro in a dose-dependent manner.A:The effect of different concentration of PDGF in DMEM group with no serum and 2%DMEM group on the expression of α-SMA;Expression of α-SMA after PDGF-BB treatment with concentration of 0 μg·L-1(B)and 50 μg·L-1(C)for 24 hours in 2%DMEM group PDGF-BB 以剂量依赖性促进体外培养的人RPE细胞表达α-SMA。A:无血清DMEM组和2%DMEM组中不同浓度PDGF-BB对α-SMA表达的影响;2%DMEM组0 μg·L-1(B)和50 μg·L-1(C)PDGF-BB处理人RPE细胞24 h后α-SMA的表达情况
α-SMA是表达在多种类型细胞浆中的一组具有收缩功能的骨架微丝结构蛋白,是细胞移行和收缩的基础[10]。α-SMA可作为一种特异性的免疫组化染色标志分子识别肌纤维母细胞。Lewis等[4]报道,PRM中存在一种有足突的人RPE细胞,在电镜下观察时这些细胞内有大量的微丝,同时细胞有收缩的现象。在这些细胞与细胞之间以及细胞与细胞外基质之间存在多种形式的细胞连接,这些细胞连接对组织的收缩功能有重要的作用。细胞的这些特点与肌成纤维细胞非常相似[11]。人RPE细胞的异常转型可能对PVR的发生有重要的作用。脱离原位的RPE上皮表型以及胞浆内的色素颗粒逐渐消失,合成多种细胞外基质,并表达 α-SMA。α-SMA 的表达导致眼内过度的损伤愈合,收缩能力持续增加。α-SMA的持续表达对PVR的发生有重要的意义。我们的研究结果显示,在 PVR/C级增生膜中,α-SMA阳性细胞较多,但细胞着色浅,说明α-SMA在这些细胞中的表达较弱。而在PVR/D级增生膜中,细胞数目明显减少,但细胞染色明显加深,荧光定量分析结果显示α-SMA在D级增生膜中的表达量为C级增生膜的1.88倍。从α-SMA的分布来看,其附着点位于增生膜收缩的“受力点”位置。从人RPE细胞的转型特点来看,C级增生膜RPE细胞轻度表达α-SMA可能与细胞合成细胞外基质、移行以及具有一定的收缩能力有关。而在D级增生膜中,RPE细胞α-SMA表达明显增强可能与其收缩能力增强有关,这种α-SMA阳性细胞在数量和空间分布上的差异可能是RPE细胞在增生膜中位置不同受到的应力不同的结果。
在PVR的发病过程中,多种细胞和细胞因子都参与其中。PDGF是一种普遍存在的有丝分裂剂,其与PDGF受体结合后,激活具有酪氨酸蛋白激酶活性的膜受体,直接促进有丝分裂,诱导有丝分裂反应有关基因的表达,增强细胞的增生反应[12-13]。本实验研究发现PDGF-BB能促进体外培养的人RPE细胞表达α-SMA,而且当血清存在时这种促进作用明显增强。血清中存在的多种因子可能对α-SMA的表达也有促进作用,PRM中多种细胞因子对α-SMA的协同作用导致 α-SMA表达量升高,从而影响PVR。
综上所述,PVR增生膜中α-SMA的表达量与PVR的病变程度呈正相关;PDGF-BB能促进人RPE细胞中α-SMA的表达,而且血清的存在能明显促进这一作用。α-SMA和PDGF在PVR的发病中都有重要的作用。对PDGF信号通路的研究将更加有助于揭示其确切的作用机制,为PVR的预防及治疗提供新的思路。
1 Ryan S.The pathophysiology of proliferative vitreoretinopathy in its management[J].Am J Ophthalmol,1985,100(1):188-193.
2 Abu EA,Ahmed M,Missotten L,Geboes K.Expression of myofibroblastactivation molecules in proliferative vitreoretinopathy epiretinal membranes[J].Acta Ophthalmol(Copenh),2011,89(2):e115-e121.
3 Baudouin C,Fredj-Reygrobellet D,Gordon WC,Baudouin F,Peyman G,Lapalus P,et al.Immunohistologic study of epiretinal membranes in proliferative vitreoretinopathy[J].Am J Ophthalmol,1990,110(6):593-598.
4 Lewis GP,Matsumoto B,Fisher SK.Changes in the organization and expression of cytoskeletal proteins during retinal degeneration induced by retinal detachment[J].Invest Ophthalmol Vis Sci,1995,36(12):2404-2416.
5 Li R,Maminishkis A,Wang FE,Miller SS.PDGF-C and-D induced proliferation/migration of human RPE is abolished by inflammatory cytokines[J].Invest Ophthalmol Vis Sci,2007,48(12):5722-5732.
6 Abu El-Asrar AM,Van den Steen PE,Al-Amro SA,Missotten L,Opdenakker G,Geboes K.Expression of angiogenic and fibrogenic factors in proliferative vitreoretinal disorders[J].Int Ophthalmol,2007,27(1):11-22.
7 Lyle WM.The retinal pigment epithelium:function and disease[J].Optom Vis Sci,1999,76(4):193.
8 Campochiaro PA,Hackett SF,Vinores SA,Freund J,Csaky C,La-Rochelle E,et al.Platelet-derived growth factor is an autocrine growth stimulator in retinal pigmented epithelial cells[J].J Cell Sci,1994,107(13):2459.
9 Nagineni CN,Kutty V,Detrick B,Hooks JJ.Expression of PDGF and their receptors in human retinal pigment epithelial cells and fibroblasts:Regulation by TGF-beta[J]?J Cell Physiol,2005,203(1):35-43.
10 Hinz B,Celetta G,Tomasek JJ,Gabbiani G,Chaponnier C.Alphasmooth muscle actin expression upregulates fibroblast contractile activity[J].Mol Biol Cell,2001,12(9):2730-2741.
11 Xie X,Wang CY,Cao YX,Wang W,Zhuang R,Chen LH,et al.Expression pattern of epithelial cell adhesion molecule on normal and malignant colon tissues[J].World J Gastroenterol,2005,11(3):344-347.
12 Fredriksson L,Li H,Eriksson U.The PDGF family:four gene products form five dimeric isoforms[J].Cytokine Growth Factor Rev,2004,15(4):197-204.
13 Lei H,Velez G,Hovland P,Hirose T,Gilbertson D,Kazlauskas A.Growth factors outside the PDGF family drive experimental PVR[J].Invest Ophthalmol Vis Sci,2009,50(7):3394-3403.
