纳米氧化锌对人正常肝细胞DNA及染色体的损伤作用
2012-11-12关荣发陈潇婷蒋家新刘明启刘光富
关荣发,陈潇婷,芮 昶,蒋家新,刘明启,刘光富
(1.中国计量学院生命科学学院生物计量及检验检疫技术重点实验室,浙江杭州 310018;2.杭州质量技术监督检测院,浙江杭州 310019)
纳米氧化锌是一种粒径在1~100 nm的新型高功能精细无机材料,它在吸收和散射红外紫外、非迁移性和压敏性等方面表现出优良的性能。纳米级氧化锌还是一种新型锌源,具有较高的生物活性、免疫调节能力和吸收率,少量的纳米氧化锌即可达到促进生物体生长的功效[1-2]。
纳米氧化锌粒径微小,具有独特的理化性质,可通过皮肤接触、呼吸道、消化道和静脉注射等途径进入生物体并在机体深部蓄积和迁移,产生生物毒性[3-4]。因而对其生物安全性的研究也成为目前的研究热点。纳米化后的氧化锌材料与常规锌相比具有小尺寸效应,更容易进入机体及细胞内部并蓄积其中,同时表面具有较高的化学活性,因而其毒性、吸收和排泄方式都有所变。随着纳米氧化锌材料在多领域的广泛开发和利用,对其安全性进行研究已成为刻不容缓的问题。目前毒性研究主要集中在体内动物实验和体外细胞实验,主要指标有急性经口毒性、皮肤刺激、眼刺激、遗传毒性、生态毒性等以及对DNA和蛋白质等生物大分子的影响[5]。Huang等[6]发现纳米氧化锌对人支气管上皮细胞BEAS-2B的毒性作用呈明显的剂量-效应关系,并推断氧化应激可能是纳米粒子产生细胞毒性的机制之一。丁小波等[7]发现纳米氧化锌可影响金属硫蛋白(MT)的合成及MT mRNA的表达。Sharma等[8]研究了纳米氧化锌对人表皮细胞株(A431)的遗传毒性,发现纳米粒子可与DNA发生结合,诱导DNA双链断裂。目前,尚未发现纳米氧化锌对人正常肝细胞DNA损伤效应的相关报道。
本研究拟采用单细胞凝胶电泳和微核试验的方法研究纳米氧化锌对HL7702人正常肝细胞DNA和染色体的损伤效应,以及损伤效应随染毒时间和染毒剂量变化的动态过程。以期为深入了解纳米氧化锌的毒性及其机制提供实验依据。
1 材料与方法
1.1 细胞、试剂和仪器
纳米氧化锌(粒径≤50 nm,>97%)购自Sigma公司;DMES,青霉素-链霉素,L-谷氨酰胺,0.25% 胰酶(trypsin)购自Gibco公司;胎牛血清(FBS)购自杭州四季青;低熔点琼脂糖,依地酸二钠(Na2EDTA),Triton X-100购自Amresco公司。其他实验耗材购自Corning公司。
JEM-2100透射电镜,日本JEOL公司;P/N190653二氧化碳恒温培养箱,美国Thermo公司;DMI4000B倒置荧光显微镜,德国Leica公司;全自动显微摄像系统,意大利Biaorad公司等。
人正常肝细胞HL7702购自中国科学院上海细胞生物研究所,以含10%胎牛血清的DMEM培养基,于5%CO2,37℃及充分饱和湿度的培养箱中常规培养。细胞呈单层贴壁生长,每2 d换一次培养液,3~4 d可传代,取对数生长期细胞用于实验。
1.2 纳米氧化锌样品制备及表征
电子天平精确称量10 mg纳米氧化锌,用10 ml无菌PBS配成1 mg·L-1浓度的悬浮液,121℃下高压蒸汽灭菌30 min,小瓶分装,4℃保存。通过透射电子显微镜对氧化锌纳米粒子进行表征测定,确定其粒径。染毒实验前在超净工作台内用DMEM细胞培养液进行不同比例稀释,使其终浓度为5,10,25,50,75和100 mg·L-1,染毒液超声处理30 min后立即用于细胞染毒。
1.3 细胞收集和染毒处理
将处于对数生长期的细胞用胰蛋白酶消化后计数,调整细胞密度为2×108L-1,均匀接种于24孔板,每孔500 μl,培养12 h待细胞贴壁后将原培养基吸弃,加入纳米氧化锌 10,25,50,75和100 mg·L-1培养液,同时设不含纳米颗粒培养液组为对照组,每组设4个复孔。37℃培养箱中培养12,24和48 h后收集细胞进行检测。
1.4 MTT法进行细胞毒性评级
将细胞接种于96孔培养板上,37℃培养箱内孵育24 h后加入不同浓度的纳米氧化锌培养液。培养24h 后,加20 μl MTT 5 mg·L-1,继续培养4 h。弃上清,加150 μl DMSO振荡10 min,用酶标仪在490 nm波长处测定其吸光度(absorbance,A)值并进行毒性评级(RGR)。RGR(%)=(A实验/A对照) ×100%。参考GB/T16885.5分级如下:0级为RGR≥100%;1级为80%~99%,2级为50%~79%;3级为30%~49%;4级为0%~29%。
1.5 单细胞凝胶电泳检测DNA损伤[9]
细胞染毒后胰酶消化收集细胞制成单细胞悬液。在干净的磨砂载玻片上滴加200 μl预热45℃的1.0%正常熔点琼脂糖(NMA),迅速盖玻片,4℃下固化10 min;凝固后,铺第二层为1.0%的低熔点琼脂糖(LMA)和细胞悬液的混合液(体积比为3∶1)100 μl,迅速置4℃冰箱冷却;第二层凝胶固化后,铺第三层0.8%的LMA 100 μl,凝胶,完成制片。然后揭去盖玻片,浸入冷的细胞裂解液(NaCl 2.5 mol·L-1,EDTA-Na2100 mmol·L-1,10 mmol·L-1Tris,1%十二烷基肌氨酸钠,pH 10,用前加入1%的Triton X-100和10%的DMSO)中,4℃下裂解2 h,用冰冷的PBS漂洗去凝胶表面的盐分3 min,再放入电泳槽中,将配制好的电泳缓冲液(Na2EDTA 100 mol·L-1,NaOH 300 mmol·L-1,pH 13)倒入电泳槽,约覆盖过载玻片0.25 cm,避光碱解旋20 min;在 0.7 V·cm-1电压条件下电泳 20 min,Tris 0.4 mol·L-1缓冲液(pH 7.5)中和 3 次,每次 10 min。溴化乙啶 20 mg·L-1暗处染色5 min,阅片。运用CASP彗星图像分析软件进行分析。测量计算尾矩(tail movement,TM)、Olive 尾 矩 (Olive tail movement,OTM)、尾部DNA百分率和头部DNA百分率。
1.6 微核试验测定微核率
细胞分别染毒12,24和48 h后弃去培养基,胰酶消化2~3 min,吸去胰酶加入PBS洗脱细胞转移到EP管中用2247×g离心5 min,弃去上清液,用甲醇和冰醋酸体积比为3∶1的固定液打匀细胞,再离心去上清,加固定液。如此重复2次。最后将细胞悬液滴在冰冻的洁净载玻片上,室温下自然晾干。4%Giemsa染色,显微镜下观察悬浮液滴片,每组观察1000个双核细胞,记录微核数,与主核完全脱离,大小为主核直径1/3以下的小核即为微核,单个细胞内出现1个或多个微核均按1个有微核的细胞计数,计算双核细胞中的微核率,微核率(FMN)=(含有微核的双核细胞数/观察的双核细胞总数)×1000‰。
1.7 统计学分析
2 结果
2.1 纳米氧化锌对HL7702细胞活性的影响
MTT实验结果(表1)表明,随着浓度增加,A490nm逐渐降低,说明活细胞数量逐渐减少。纳米氧化锌10和 20 g·L-1时,细胞毒为 1 级,纳米氧化锌50 g·L-1时,毒性为 2 级,纳米氧化锌 75 mg·L-1,RGR为(41±3)%,毒性为 3级,纳米氧化锌100 mg·L-1时,RGR 为(21±2)%,毒性为 4 级。采用 SPSS13.0 计算得到 IC50为29.81 mg·L-1。
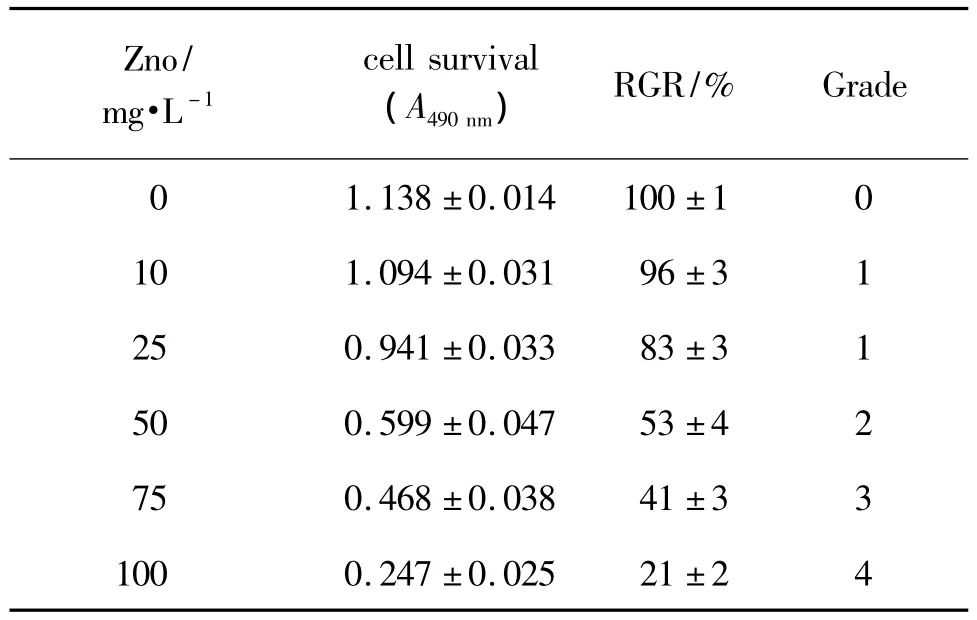
Tab.1 Effect of ZnO nanoparticles on human hepatocyte cells survival
2.2 纳米氧化锌对HL7702细胞DNA的损伤作用
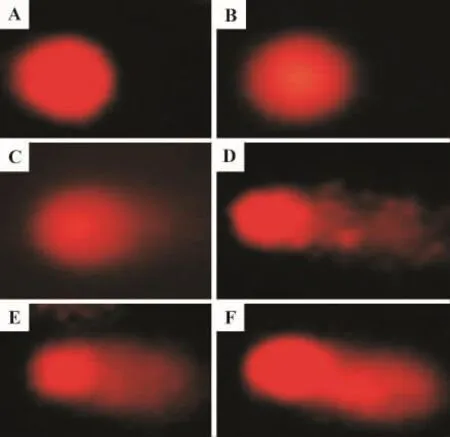
Fig.1 SCGE singlecelgeleletrophoresis of human hepatocyte cells exposed to ZnO nanoparticles.A -F:ZnO nanoparticles 0,10,25,50,75 and 100 mg·L -1for 24 h,respectively.
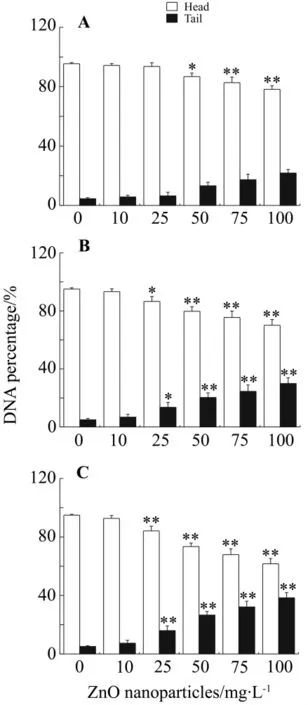
Fig.2 Effects of ZnO nanoparticles on the tail DNA percentage in HL7702 cells.A:12 h;B:24 h;C:48 h.±s,n=10.*P<0.05,**P<0.01,compared with normal control(ZnO 0 mg·L -1)group.
纳米氧化锌0,10,25,50,75 和100 mg·L-1分别染毒细胞12,24和48 h,拖尾随浓度逐渐增加(图1)。定量分析结果(图2和表2)显示,纳米氧化锌可引起HL7702细胞头部DNA百分率减少,尾部DNA百分率增加,尾矩和Olive尾矩上升,并具有一定的剂量-效应关系(r=0.992,P<0.05)。细胞染毒12 h后,随着纳米粒子浓度的增加,细胞尾部DNA含量逐渐增加,明显高于正常对照组 (P<0.05);与正常对照组相比,细胞染毒24 h,纳米氧化锌50~100 mg·L-1,细胞尾矩、Olive尾矩值和尾部DNA百分率逐渐上升(P<0.05);细胞染毒48 h后,纳米氧化锌≥25 mg·L-1时头部和尾部DNA百分率显著增高,TM和OTM显著增加(P<0.01)。浓度相同时,随染毒时间延长,TM和OTM逐渐增加。
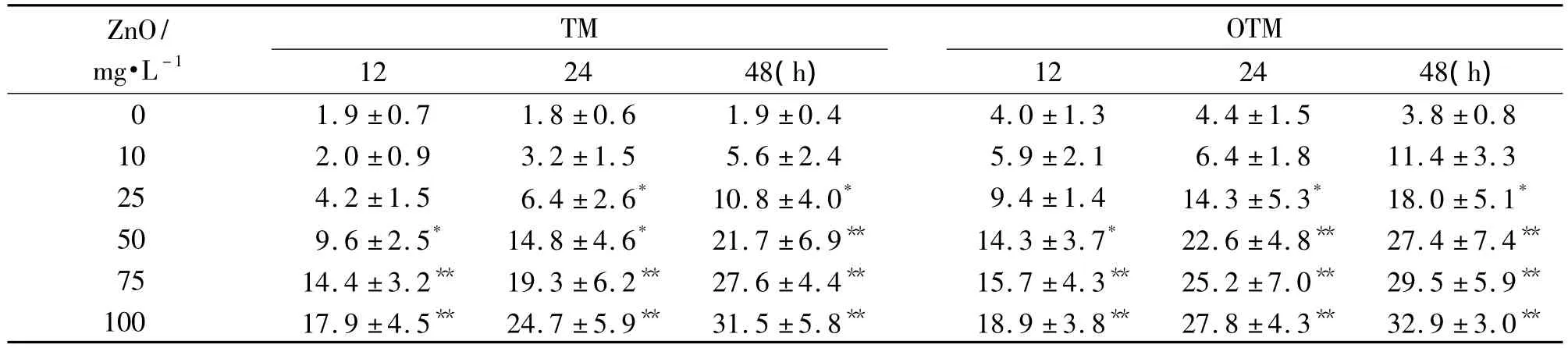
Tab.2 Effects of ZnO nanoparticles on the tail moment(TM)and Olive tail moment(OTM)in HL7702 cells
2.3 纳米氧化锌对HL7702细胞微核率的影响
微核试验结果(表3)可见。与正常对照组相比,纳米氧化锌 50,75 和 100 mg·L-1处理细胞12 h,可使细胞微核率显著升高(P<0.05)。染毒24 h,氧化锌浓度≥25 mg·L-1时,微核率显著增加(P<0.01)。染毒48 h时,纳米氧化锌 10 mg·L-1微核率显著升高(P<0.01)。纳米氧化锌75和100 mg·L-1,细胞染毒时间为48 h的微核率明显大于染毒时间为12 h的微核率(P<0.05)。
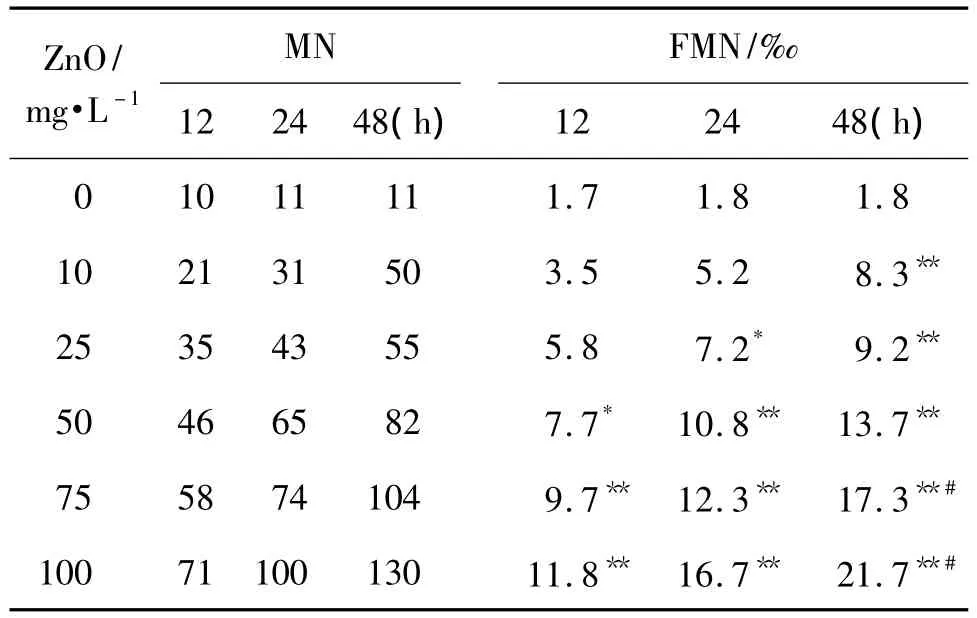
Tab.3 Effect of ZnO nanoparticles on micronucleus rates in human embryonic kidney cells
3 讨论
在实验发现纳米氧化锌对HL7702人正常肝细胞DNA和染色体有明显的损伤效应。纳米粒子可导致细胞尾部DNA百分率升高,细胞尾矩和Olive尾矩增大,从而诱导细胞DNA损伤。
由于纳米粒子的小尺寸效应,使得纳米氧化锌的比表面积大,表面原子的活性极高,很容易与蛋白质、DNA或其他物质结合,进而产生损伤。Gao等[10]对纳米氧化锌与甲硝唑在超声条件下对牛血清蛋白的联合损伤作用进行研究,结果显示超声激活纳米粒子产生氧化性极强的·OH自由基,对蛋白分子造成损伤。同时有研究证明,纳米氧化锌改变了细胞转录调控,对相关基因进行检测,发现BNIP,PRDX3,PRNP和TXRND1基因表达异常。纳米粒子可与 DNA发生结合,诱导 DNA双链断裂[10]。通常胞内ROS含量极少,并且其产生和清除处于动态平衡状态。以往的研究发现氧化锌纳米粒子会引起胞内乳酸脱氢酶ROS水平升高[11],过量的ROS会攻击 DNA,导致 DNA链断裂[12]。因此,纳米粒子引起的ROS可能是纳米氧化锌对细胞产生DNA损伤的诱导因素之一。但纳米氧化锌诱导ROS是否是DNA发生损伤的主要因素还有待更深入的研究。微核试验是检测细胞遗传物质损伤的重要方法。微核是在细胞有丝分裂后期,染色体片段无法进入子代细胞细胞核中而留在胞质内所形成的。本研究结果提示纳米氧化锌能引起人正常肝细胞染色体畸变,形成微核,对细胞具有染色质损伤效应,该损伤效应是由纺锤丝功能受损或染色体断裂引起的。综上所述,在本实验条件下纳米氧化锌对人正常肝细胞HL7702有明显的遗传毒性作用,这为进一步完善纳米氧化锌安全性评价提供了一定的理论支持。
[1]Suh WH,Suslick KS,Stucky GD,Suh YH.Nanotechnology,nanotoxicology,and neuroscience[J].Prog Neurobiol,2009,87(3):133-170.
[2]Wiench K,Wohlleben W,Hisgen V,Radke K,Salinas E,Zok S,et al.Acute and chronic effects of nano-and non-nano-scale TiO(2)and ZnO particles on mobility and reproduction of the freshwater invertebrate Daphnia magna[J].Chemosphere,2009,76(10):1356-1365.
[3]Gopalan RC,Osman IF,Amani A.The effect of zinc oxide and titanium dioxide nanoparticles in the comet assay with UVA photoactivation of human sperm and lymphocytes[J].Nanotoxicol,2009,3:33-39.
[4]Lin WS,Xu Y,Huang CC.Toxicity of nano-and micro-sized ZnO particles in human lung epithelial cells[J].J Nanoparticle Res,2009,11:25-39.
[5]Greenhalgh K,Turos E.In vivo studies of polyacrylate nanoparticle emulsions for topical and systemic applications[J].Nanomedicine,2009,5(1):46-54.
[6]Huang CC,Aronstam RS,Chen DR,Huang YW.Oxidative stress,calcium homeostasis,and altered gene expression in human lung epithelial cells exposed to ZnO nanoparticles[J].Toxicol In Vitro,2010,24(1):45-55.
[7]Ding XB,Wen LiX,Yuan H.Effect of nano zinc oxide on liver metallothionein of AA chicken[J].Chin J Vet Sci(中国兽医学报),2009,29(2):242-244.
[8]Sharma V,Shukla RK,Saxena N,Parmar D,Das M,Dhawan A.DNA damaging potential of zinc oxide nanoparticles in human epidermal cells[J].Toxicol Lett,2009,185(3):211-218.
[9]Singh N,Manshian B,Jenkins GJ,Griffiths SM,Williams PM,Maffeis TG,et al.NanoGenotoxicology:the DNA damaging potential of engineered nanomaterials[J].Biomaterials,2009,30(23-24):3891-3914.
[10]Gao J,Liu B,Wang J,Jin X,Jiang R,Liu L,et al.Spectroscopic investigation on assisted sonocatalytic damage of bovine serum albumin(BSA)by metronidazole(MTZ)under ultrasonic irradiation combined with nano-sized ZnO[J].Spectrochim Acta A Mol Biomol Spectrosc,2010,77(4):895-901.
[11]Yuan JH,Chen Y,Zha HX,Song LJ,Li CY,Li JQ,et al.Determination,characterization and cytotoxicity on HELF cells of ZnO nanoparticles[J].Colloids Surf B Biointerfaces,2010,76(1):145-150.
[12]Lee JH,Choi IY,Kil IS,Kim SY,Yang ES,Park JW.Protective role of superoxide dismutases against ionizing radiation in yeast[J].Biochim Biophys Acta,2001,1526(2):191-198.
