2,3,7,8-四氯二苯-对-二噁英对 BRL-3A细胞增殖、凋亡及胰岛素样生长因子2表达的影响
2012-11-12刘晓亮刘彩霞赵彦艳
王 珺,刘晓亮,刘彩霞,赵彦艳
(中国医科大学盛京医院1.妇产科,2.临床遗传科,辽宁沈阳 110004)
2,3,7,8-四氯二苯-对-二噁英(2,3,7,8-tetrachlorodibenzo-p-dioxin,TCDD)是二噁英类环境污染物中毒性最强的一种,主要来源于垃圾焚烧、农药生产和汽车尾气等。TCDD在自然界广泛存在,具有致畸、致癌、致突变作用[1]。此外,TCDD还损害免疫、皮肤等多个系统功能[2-3]。TCDD 对不同组织细胞呈现不同作用,它可诱导免疫细胞凋亡,使胸腺萎缩、免疫功能下降[2];而在其他组织,TCDD 则会抑制细胞凋亡以及促进癌变[4]。
胰岛素样生长因子-2(insulin-like growth factor 2,IGF2)是一个主要在胚胎期表达的重要生长因子,出生后其在各器官表达水平迅速下降[5]。IGF2过度表达可导致组织细胞异常增生,与Beckwith-Wiedemann综合征等先天畸形性疾病发生有关[6]。前期研究发现,TCDD致畸胎鼠的肝组织中Igf2基因表达增高[7]。
为探索肝细胞增殖及凋亡在TCDD致机体损害中的作用,以及Igf2基因表达与二者间的关系,本研究以大鼠肝BRL-3A细胞为研究对象,观察TCDD对该细胞增殖和凋亡的影响,检测 Igf2基因在BRL-3A细胞中的表达,探讨TCDD致畸、致癌和致突变作用可能的新机制。
1 材料与方法
1.1 药品与试剂及主要仪器
Trizol试剂购自Invitrogen公司;RT-PCR试剂盒购自Promega公司;噻唑蓝(MTT)、二甲亚砜(dimethyl sulfoxide,DMSO)和碘化丙啶(propidium iodide,PI)购自Sigma公司;蛋白质测定试剂购自南京建成生物工程研究所;胎牛血清(fetal bovine serum,FBS)和RPMI-1640购自Gibco公司。TCDD购自Cambridge Isotope Laboratories公司,用 DMSO配成溶液备用。碱性磷酸酶标记的山羊抗兔IGF2IgG抗体和β肌动蛋白抗体购自Santa Cruz公司。PCR探针及引物由TaKaRa公司合成。
1.2 主要仪器
Olympus TH4-200倒置显微镜为日本Olympus公司产品;Bio-RAD550酶标仪和Gel Doc 1000型凝胶成像系统均为美国Bio-Rad公司产品;CL-1000紫外交联仪为美国UVP公司产品;FASCalibur流式细胞仪为美国BD公司产品。Rotorgene 2000实时定量PCR仪为加拿大MBI公司产品。
1.3 细胞培养
大鼠肝BRL-3A细胞购自中国科学院上海细胞研究所。在含15%FCS、青霉素 100 kU·L-1、链霉素100 mg·L-1的 RPMI-1640 完全培养体系中,置37℃,体积分数为5%CO2,饱和湿度培养箱中贴壁生长。2~3 d传代1次,实验均选用对数生长期细胞。接种后,常规培养24 h,实验组分别加入不同浓度的TCDD,溶剂对照组加入等体积100%DMSO(DMSO终浓度不超过0.1%)。
1.4 MTT法检测细胞存活
密度为1×108L-1BRL-3A细胞接种96孔板,分别加入 TCDD 0,5,10,15 和 20 nmol·L-1(每个浓度3 个孔,TCDD 0 nmol·L-1为溶剂对照组),继续培养24 h后加入20 μl MTT(5 g·L-1)作用 4 h,吸去培养液,加入100μl DMSO。同时设仅加等体积培养基、MTT和 DMSO的孔为本底对照孔。15 min后,酶标仪测定490 nm波长处吸光度(A)值,细胞存活 率 (%)=(A实验组- A本底对照)/(A溶剂对照组-A本底对照)×100%。
1.5 流式细胞仪检测细胞凋亡
1.5.1 紫外线诱导BRL-3A细胞
取BRL-3A细胞弃培养基保持湿润置于紫外交联仪内,以 254 nm 波长,120 J·cm-2能量垂直照射0 min或2 min,再加入培养基孵育2 h。然后实验组加入 TCDD 10 nmol·L-1,溶剂对照组加入等体积100%DMSO,继续培养24 h后收集细胞,胰酶消化,制成细胞悬液,70%无水乙醇固定。复以RNA酶37℃孵育30 min,消除RNA对DNA量的干扰。调整细胞密度至 5×109L-1,加入等体积 PI 50 mg·L-1染液。用流式细胞仪进行单色荧光细胞流式计数,观察凋亡细胞百分比,每组实验重复3次。
1.5.2 血清饥饿诱导BRL-3A细胞
取 BRL-3A 细胞,实验组加入 TCDD 10 nmol·L-1、溶剂对照组加入等体积100%DMSO的有血清和无血清培养基培养72和120 h,然后收集细胞,PI染色行流式细胞计数,观察凋亡细胞百分比,每组实验重复3次。
1.6 荧光定量PCR方法检测Igf2基因表达
取BRL-3A细胞,实验组给予TCDD 10 nmol·L-1作用2,4,6,16及24 h,溶剂对照组给予等体积的100%DMSO,然后收集细胞,提取RNA,逆转录合成cDNA,作为模板,进行扩增。Igf2基因特异性引物和荧光探针序列为:上游:5'-GCCCTCCTGGAGACATACTG-3', 下 游:5'-CCAGGTGTCGAATTTGAAGAA-3',探针:5'-(FAM)-TCCGAGAGGGACGTGTCTAC-(TAMRA)-3'。反应体系包括:cDNA 1.0 μl,10 × PCR 缓冲液 2.0 μl,dNTPs 0.5 μl,引物各1μl,探针1μl,Taq酶5 U,加去离子水至总体积20μl,在实时定量PCR仪上进行扩增,反应条件为50℃ 120 s,94℃ 120 s预变性,然后 94℃ 15 s,53℃30 s,65℃ 30 s循环40次。内对照β肌动蛋白的反应条件相同,其特异性引物和荧光探针序列为:上游:5'-AGCAGATGTGGATCAGCAAG-3, 下 游:5'-AACAGTCCGCCTAGAAGCAT-3',探 针:5'-(FAM)-CCTCCATCGTGCACCGCAA-(TAMRA)-3'。每个样品扩增3次,计算平均Ct值,以Igf2和β肌动蛋白表达量之比代表每个样品Igf2的相对含量。
1.7 Western印迹法检测IGF2蛋白表达
取BRL-3A细胞,实验组加入TCDD 10 nmol·L-1作用6和24 h,溶剂对照组加入等体积的100%DMSO,然后收集细胞,用单去污裂解液方法提取总蛋白,用Bradford法进行蛋白定量。取50μg蛋白样品上样,SDS-PAGE电泳(成层胶浓度5%,分离胶浓度10%)分离蛋白后,转移至硝酸纤维膜上(40℃,200 mA,1.5 h)。转印膜用 5%牛血清白蛋白室温封闭1 h,再与一抗和二抗孵育,充分洗膜后加入显色剂反应至特异性条带出现,应用凝胶成像系统分析蛋白条带积分光密度值(integrated absorbance,IA),以目的条带与β肌动蛋白的IA比值代表IGF2蛋白的表达量。每个样品重复3次取平均值。
1.8 统计学分析
2 结果
2.1 TCDD对BRL-3A细胞增殖的影响
表1结果显示,与溶剂对照组比较,经过TCDD 5~20 nmol·L-1处理后,细胞存活率明显增加(P <0.05),TCDD 10 nmol·L-1处理组 BRL-3A 细胞存活率为(122.6±1.2)%,明显高于其他浓度TCDD作用细胞的存活率(P<0.01)。所以在以后的研究中,采用 TCDD 10 nmol·L-1作为刺激浓度。
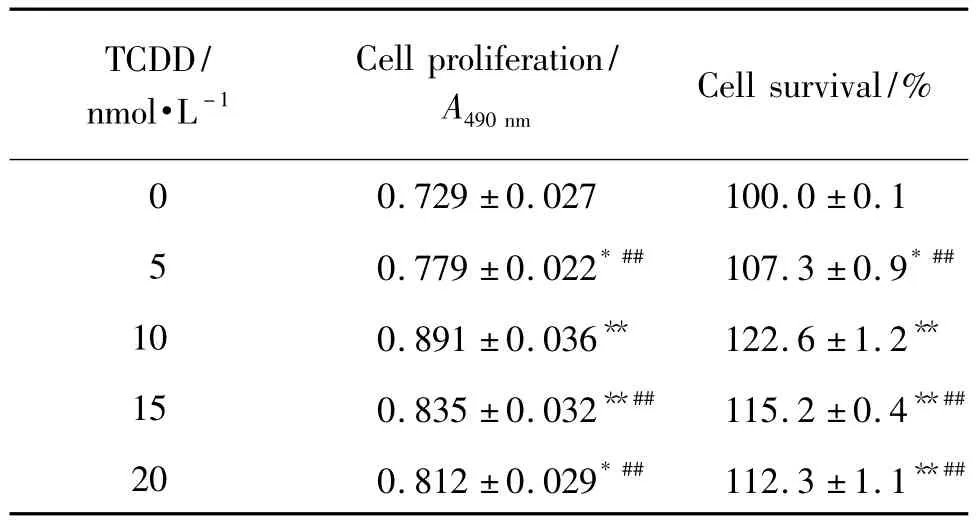
Tab.1 Effect of 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)on BRL-3A cell survival
2.2 TCDD对BRL-3A细胞凋亡的影响
2.2.1 TCDD对紫外线诱导的BRL-3A细胞凋亡的抑制作用
图1结果显示,无照射的溶剂对照组细胞凋亡率为(7.3 ±2.6)%(图 1A),TCDD 10 nmol·L-1组细胞凋亡率为(6.7±3.2)%(图1B),二者间无显著性差异。经紫外线照射2 min后,溶剂对照组细胞凋亡率为(26.4±5.0)%(图1C),与无照射的溶剂对照组相比显著增加(P<0.05);加入 TCDD 10 nmol·L-1共培养24h细胞的凋亡率为(12.2 ±3.2)%(图1D),显著低于照射的溶剂对照组(P<0.05),说明TCDD能够明显降低紫外线诱导的BRL-3A细胞凋亡。

Fig.1 Effect of TCDD on BRL-3A apopotosis induced by UV radiation detected by flow cytometry.A:BRL-3A cells cultured with DMSO for 24 h;B:BRL-3A cells cultured with TCDD 10 nmol·L - 1 for 24 h;C:BRL-3A cells treated with UV for 2 min and then cultured with DMSO for 24 h;D:BRL-3A cells treated with UV for 2 min and then cultured with TCDD 10 nmol·L -1 for 24 h.
2.2.2 TCDD对血清饥饿诱导的BRL-3A细胞凋亡的抑制作用
表2和图2结果显示,正常培养基中培养不同时间的溶剂对照组和TCDD 10 nmol·L-1组细胞的凋亡率无显著性差异。血清饥饿72和120 h后,溶剂对照组与TCDD 10 nmol·L-1组凋亡率均显著增加(P<0.01);TCDD 10 nmol·L-1+ 血清饥饿组细胞的凋亡率明显低于血清饥饿+溶剂对照组(P<0.05),表明TCDD对血清饥饿诱导的凋亡具有抑制作用。

Tab.2 Effect of TCDD on BRL-3A apoptosis induced by serum free culturing

Fig.2 Effect of TCDD on BRL-3A apopotosis induced by serum free culturing detected by flow cytometry.A:normal medium+DMSO for 72 h;B:normal medium+TCDD 10 nmol·L -1 for 72 h;C:serum free medium+DMSO for 72 h;D:serum free medium+TCDD 10 nmol·L - 1 for 72 h;E:normal medium+DMSO for 120 h;F:normal medium+TCDD 10 nmol·L - 1 for 120 h;G:serum free medium+DMSO for 120 h;H:serum free medium+TCDD 10 nmol·L -1 for 120 h.
2.3 TCDD对BRL-3A细胞Igf2 mRNA表达的影响
图3结果显示,溶剂对照组BRL-3A细胞的Igf2 mRNA表达相对量为 0.037 ±0.003,TCDD 10 nmol·L-1作用后,Igf2 基因的表达量显著增高(P<0.05),TCDD作用6和24 h时 Igf2基因的表达量分别比对照组增高1.12倍和1.67倍。且TCDD调节表达的程度与作用时间有关,TCDD作用6 h前Igf2 mRNA的表达量与TCDD作用时间呈正相关(r=0.982,P=0.018),TCDD 作用 6 h 之后Igf2 mRNA的表达增加趋势趋于平缓。

Fig.3 Effect of TCDD 10 nmol·L -1 on insulin-like growth factor 2(Igf2)mRNA expression in BRL-3A cells.±s,n=3.*P <0.05,compared with the 0 h group.
2.4 TCDD对BRL-3A细胞 IGF2蛋白表达的影响
图4 结果显示,溶剂对照组IGF2蛋白表达相对量为0.17 ±0.05,TCDD 10 nmol·L-1作用 6 和 24 h后,IGF2蛋白表达相对量分别为0.51 ±0.06,0.61 ±0.05,分别为溶剂对照组的3倍和3.6倍,有显著升高(P <0.05)。

Fig.4 Effects of TCDD on the expression of IGF2 protein in BRL-3A cells by Western blotting.Lane 1:solvent control group,lane 2:TCDD 10 nmol·L -1 for 6 h;lane 3:TCDD 10 nmol·L -1 for 24 h.
3 讨论
本研究结果显示TCDD能促进BRL-3A细胞增殖,并以 TCDD 10 nmol·L-1作用最强。TCDD 10 nmol·L-1对紫外照射和血清饥饿诱导的BRL-3A细胞凋亡均有明显抑制作用。
组织细胞的异常增殖和凋亡被认为与癌变和畸形发生相关[8]。本结果显示TCDD能刺激大鼠肝细胞增殖、抑制其凋亡,这可能是TCDD致畸和致癌作用的途径之一。
IGF2是一个重要的促细胞增殖的生长因子,其过度表达与肿瘤和先天畸形的发生相关[6,9]。TCDD作用24 h可引起BRL-3A细胞Igf2基因的表达显著增高——mRNA表达增高1.67倍,蛋白表达增高2.6倍。TCDD调节靶基因表达的主要作用途径是与芳香化烃受体结合,再与细胞核内的芳香化烃受体核转运体蛋白(Ah receptor nuclear translocator protein,ARNT)形成复合物,作用于靶基因上的二噁英反应元件(dioxin response element,DRE),实现上调或下调基因表达,而产生毒性作用[10-11]。TRANSFAC-TESS和MATCHTM是常用的在线转录因子预测软件[12],通过软件对Igf2基因进行分析并未发现该基因启动子上存在DRE。此外,TCDD作用于BRL-3A细胞所引起的Igf2基因mRNA增高的程度与IGF2蛋白上升的程度并不完全一致,这可能与蛋白翻译过程的各个环节还受到不同的调节有关。TCDD上调Igf2基因表达方式尚待进一步研究。
[1]Wells PG,Lee CJ,McCallum GP,Perstin J,Harper PA.Receptor- and reactive intermediate-mediated mechanisms of teratogenesis[J].Handb Exp Pharmacol,2010,(196):131-162.
[2]Marshall NB,Kerkvliet NI.Dioxin and immune regulation:emerging role of aryl hydrocarbon receptor in the generation of regulatory T cells[J].Ann N Y Acad Sci,2010,1183:25-37.
[3]Ikuta T, Namiki T, Fujii-Kuriyama Y,Kawajiri K.AhR protein trafficking and function in the skin[J].Biochem Pharmacol,2009,77(4):588-596.
[4]Mitchell KA,Wilson SR,Elferink CJ.The activated aryl hydrocarbon receptor synergizes mitogen-induced murine liver hyperplasia[J].Toxicology,2010,276(2):103-109.
[5]Hiden U,Glitzner E,Hartmann M,Desoye G.Insulin and the IGF system in the human placenta of normal and diabetic pregnancies[J].J Anat,2009,215(1):60-68.
[6]Cooper WN,Luharia A,Evans GA,Raza H,Haire AC,Grundy R,et al.Molecular subtypes and phenotypic expression of Beckwith-Wiedemann syndrome[J].Eur J Hum Genet,2005,13(9):1025-1032.
[7]Wang J, Zhao YY, Liu H,Li YH,Li GY,Sun KL,et al.The role of insulin-like growth factor-2 gene differ-entially methylated regions in TCDD-induced malformation[J].Chin J Med Genet(中华医学遗传学杂志),2007,24(2):162-166.
[8]Zabihi S, Loeken MR. Understanding diabetic teratogenesis:where are we now and where are we going?[J].Birth Defects Res A Clin Mol Teratol,2010,88(10):779-790.
[9]Pollak M.Insulin and insulin-like growth factor signalling in neoplasia[J].Nat Rev Cancer,2008,8(12):915-928.
[10]Lindén J,Lensu S,Tuomisto J,Pohjanvirta R.Dioxins,the aryl hydrocarbon receptor and the central regulation of energy balance[J].Front Neuroendocrinol,2010,31(4):452-478.
[11]El Gendy MA,Soshilov AA,Denison MS,El-Kadi AO.Harmaline and harmalol inhibit the carcinogen-activating enzyme CYP1A1 via transcriptional and posttranslational mechanisms[J].Food Chem Toxicol,2012,50(2):353-362.
[12]Li Y,Zhao Y,Li G,Wang J,Li T,Li W,et al.Regulation of neuronal nitric oxide synthase exon 1f gene expression by nuclear factor-kappaB acetylation in human neuroblastoma cells[J].J Neurochem,2007,101(5):1194-1204.
