骨髓间充质干细胞对致敏小鼠造血干/祖细胞移植植入的影响*
2012-11-07洪冬玲吴燕峰许吕宏方建培
洪冬玲, 吴燕峰, 许吕宏, 方建培△
(中山大学孙逸仙纪念医院 1儿科,2生物治疗中心,广东 广州 510120)
1000-4718(2012)01-0124-07
2011-04-14
2011-11-02
国家自然科学基金资金资助项目(No. 30872383)
△通讯作者 Tel: 020-81332213; E-mail: jpfang2005@163.com
#现工作单位:广东省人民医院儿科
骨髓间充质干细胞对致敏小鼠造血干/祖细胞移植植入的影响*
洪冬玲1#, 吴燕峰2, 许吕宏1, 方建培1△
(中山大学孙逸仙纪念医院1儿科,2生物治疗中心,广东 广州 510120)
目的前期的研究已经证实致敏小鼠造血干/祖细胞移植植入失败率高。本研究拟通过骨髓间充质干细胞(MSCs)进行干预,观察能否提高造血干、祖细胞移植的植入率。方法应用贴壁培养法体外培养正常小鼠骨髓MSCs,并分为6个实验组,包括实验组1:d11 MSCs干预的致敏组;实验组2: d0 MSCs干预的致敏组;实验组3:d11和d0 2次MSCs干预的致敏组;实验组4: 无MSCs干预的致敏小鼠对照组;实验组5:无MSCs干预的正常小鼠(非致敏小鼠)移植对照组;实验组6:无MSCs干预的正常小鼠不移植对照组。观察指标包括生存分析、移植效果分析(血象改变、骨髓细胞恢复及嵌合分析等)和移植物抗宿主病(GVHD)检测,最终评估MSCs干预对各实验组异基因造血干/祖细胞移植植入率的影响效果。结果与对照组(实验组4、5、6)比较,MSCs干预(实验组1、2、3)在2次异基因脾细胞注射法致敏的动物模型进行异基因造血干/祖细胞移植时,未能促进骨髓造血干/祖细胞移植的植入,也未能延长致敏动物移植后的生存时间。结论体内应用1×106MSCs干预,未能促进2次异基因1×106C57BL/6小鼠脾细胞输注法建立的重度致敏模型异基因造血干/祖细胞移植的植入。
骨髓间充质干细胞; 致敏小鼠; 造血干/祖细胞移植
不少血液系统的非肿瘤性疾病如重型地中海贫血、重型再生障碍性贫血等均需长期依赖输血,而造血干细胞移植(hematopoietic stem cell transplantation, HSCT) 是目前临床上根治此类疾病的唯一方法[1-4]。但移植前接受多次输血的受者其植入率明显降低;加用氟达拉滨的清髓预处理虽能彻底杀伤T、B免疫细胞等,也不能清除相关抗体及跨越HLA屏障[5]。如何促进造血干细胞在致敏受者植入是目前全球亟待解决的问题。骨髓间充质干细胞(mesenchymal stem cells, MSCs)是一类具有多向分化潜能的干细胞,并在免疫调节中发挥重要作用,已应用于包括严重移植物抗宿主病(graft-versus-host disease,GVHD)、组织修复工程、器官移植排斥以及自身免疫性疾病等的临床治疗[6]。目前大量实验结果均说明MSCs在细胞免疫及体液免疫中发挥重要的免疫调节作用[7-9],其免疫调节作用很大程度由其特定的环境影响因素决定,在正常小鼠体内主要体现以免疫抑制作用为主,提示应用MSCs可能会降低致敏受者的致敏程度,从而抑制致敏受者对异基因造血干细胞的免疫杀伤作用,有望成为治疗致敏受者移植排斥的新策略,但目前国内外均无相关具体的报道,值得进一步探讨。我们利用前期实验中建立的反复异基因脾细胞输注法致敏的小鼠模型,研究MSCs干预能否促进改善对其造血干/祖细胞移植植入体内外的影响。
材 料 和 方 法
1动物和主要试剂
无特定病原体(SPF级)的C57BL/6(H-2Db)及BALB/c(H-2Dd)小鼠,均为雄性,6~8周,体重18~20 g,由中山大学实验动物中心提供并饲养。DMEM/F12培养基、10 %优质胎牛血清、0.25%胰酶-EDTA购自Gibco;大鼠抗小鼠单克隆抗体anti-CD44-PE、anti-CD105-PE、anti-CD29-PE、anti-Sca-1-FITC、anti-CD34- FITC、anti-CD11b-FITC,anti-H-2Db-FITC、anti-CD3-FITC、anti-CD4-PE、anti-CD8-FITC和anti-CD19-PE 购自Bioscience。甲基纤维素半固体培养基购自Stem Cell。
2正常BALB/c小鼠骨髓MSCs的体外分离、培养及流式检测[10]
取材于正常BALB/c小鼠股骨和胫骨,制成单细胞悬液后,以DMEM/F12完全培养基(含青、链霉素各1×105U/L及胎牛血清10%)培养。48 h 后首次全量换液去除未贴壁细胞,以后每2~3 d 全量换液,大约4~6周。取融合达90%的第4~6代MSCs,以0.25%胰酶/EDTA消化成单细胞悬液,加入荧光标记的抗体anti-CD44-PE、anti-CD105-PE、anti-CD29-PE、anti-Sca-1-FITC、anti-CD34- FITC和anti-CD11b-FITC,应用流式细胞仪分析样本中细胞相应标记抗原的阳性表达率。
3致敏动物模型的建立
用同种异基因脾细胞输注法(参照已建立的方法[11]),即经尾静脉将C57BL/6(H-2Db)小鼠脾淋巴细胞输注到受者BALB/c小鼠体内使之致敏。具体步骤为:断颈处死C57BL/6小鼠,75%乙醇浸泡5 min,移到超净台上,无菌操作下开腹取脾脏,放入含磷酸盐缓冲液(phosphate buffered solution, PBS)无菌培养皿内,用一次性1 mL注射器抽取PBS反复冲洗到15 mL离心管内,获取脾细胞;离心沉淀细胞后,用生理盐水重悬细胞,调细胞计数为1×1010/L;分别于移植前14 d和7 d将1×106(0.1 mL)C57BL/6小鼠脾细胞经尾静脉输注到BALB/c小鼠。移植当天定为d0。
4MSCs干预的实验分组情况
MSCs的量为每只1×106,骨髓造血干/祖细胞的量为每只1×107,每组8只。前3组为采用不同组合的MSCs 干预组; 后3组为不同的对照组。实验组1:d11应用MSCs干预的致敏移植组;实验组2:d0应用MSCs干预的致敏移植组;实验组3:d11及d0共2次应用MSCs干预的致敏移植组;实验组4:无MSCs干预的致敏移植组;实验组5:无MSCs干预的正常(非致敏)移植组;实验组6:无MSCs干预的正常(非致敏)不移植组。
5骨髓移植
以C57BL/6小鼠作为供者,BALB/c小鼠作为受者。移植5 d前开始饮用含抗生素的饮用水(含庆大霉素3.2×105U/L和红霉素250 mg/L)。移植前4 h予 8 Gy [60Co]照射。分离C57BL/6小鼠股骨及胫骨的骨髓,将细胞浓度调为5×1010/L, 于照射后经尾静脉注射0.2 mL(1×107) 到上述各组BALB/c小鼠体内。
6移植指标的观察
6.1生存分析 移植后每天观察致敏模型的生存状况,观察至移植后28 d。记录死亡时间及绘制生存曲线。
6.2外周血象指标 移植后每周从各组动物尾静脉采血10 μL,并用KX-21血细胞计数仪(Sysmex)检测白细胞(white blood cell,WBC)、血红蛋白(hemoglobin,Hb)和血小板(platelet,PLT)的改变。
6.3骨髓干/祖细胞恢复 移植后每周处死1~3只各组小鼠,分离各组小鼠的股骨,计数每根股骨中骨髓细胞的数量;取2×104骨髓细胞置于1 mL甲基纤维素半固体培养体系进行集落培养,在37 ℃、体积分数5%CO2及饱和湿度的培养箱中培养7 d,计数CFU-GM,以细胞数多于40个为1个集落。
6.4移植后嵌合分析 分离各实验组小鼠的股骨,取其骨髓细胞经裂解红细胞后,予FITC标记大鼠抗小鼠H-2Db单抗于4 ℃避光孵育30 min,经PBS洗涤1次,应用FACScan流式细胞仪(Becton Dickinson)检测供者细胞在受者的嵌合情况。
7统计学处理

结 果
1正常小鼠骨髓MSCs的形态学观察
小鼠骨髓细胞接种于塑料培养瓶后, 24 h 后就见有细胞贴壁。48 h后首次全量换液去除未贴壁细胞,此时保留贴壁的细胞,该细胞为单个, 大部分形态呈圆形,为“原代细胞”。原代细胞培养3~4周左右,细胞开始快速增殖,每个集落中的细胞不断增殖呈“漩涡状”,再培养2~3周左右,每个小集落形成数百至上千个细胞的大集落,集落交界处出现重叠、融合。经胰酶消化后的MSCs呈圆形,胞体较大,传代24 h 内完全贴壁伸展,呈成纤维细胞样形态,传代后的MSCs形态逐渐单一。图1A、B分别为正常小鼠骨髓MSCs原代和第4代的细胞形态图。

Figure 1. Morphology of normal mouse bone marrow-derived MSCs(×50). A:primary;B:the forth passage.
图1正常小鼠骨髓源性MSCs的形态
2正常小鼠MSCs表面标志的流式检测
正常小鼠骨髓MSCs随着细胞传代数的增加,从第4代的MSCs开始已经表达较典型的MSCs流式标志:CD29+、CD44+、 CD105+、Sca-1+、CD34-和CD11b-,见图2。

Figure 2. Expression of the surface markers,CD29,CD44, CD105, Sca-1,CD34 and CD11b, in the mouse bone marrow-derived MSCs at passage 4.
图2小鼠骨髓MSCs第4代的表面标志CD29、CD44、CD105、Sca-1、CD34和CD11b的表达
3生存分析
如图3及表1显示经8 Gy [60Co]照射后,各实验组动物的生存情况。
其中致敏组(包括实验组1、2、3和4)与正常(非致敏)移植对照组(实验组5)间的差异有统计学意义(P<0.01),与正常(非致敏)不移植空白对照组(实验组6)间的差异也有统计学意义(P<0.05)。正常(非致敏)移植对照组(实验组5)说明在正常状态下的异基因造血干/祖细胞移植是成功的;而正常(非致敏)不移植空白对照组(实验组6)全部死亡,说明移植前予[60Co]照射是致死性;但与无MSCs干预(实验组4)相比,MSCs干预(实验组1、2和3)均未能促进致敏小鼠异基因造血干/祖细胞移植的植入(P>0.05)。

Figure 3. Survival cures of mice in Group 1~6.n=8.
图3各组动物的生存曲线
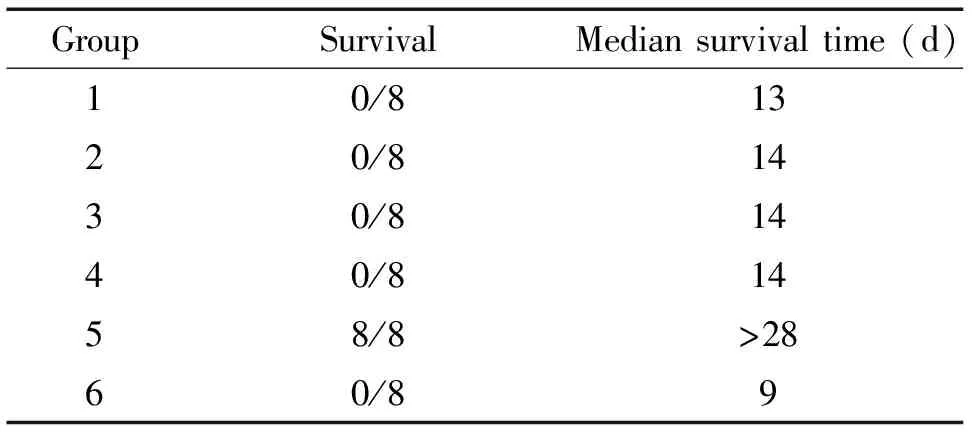
表1 各实验组的生存时间
4造血重建
4.1外周血象恢复 MSCs干预的致敏移植组(实验组1、2、3)与无MSCs干预的致敏移植组(实验组4)比较,在移植第1周WBC和PLT改变的两两比较中均有统计学意义(P<0.05),而Hb比较却P>0.05。移植后第2周发现,WBC、PLT和Hb差异却均无统计学意义(P>0.05);而不同的 MSCs干预组之间(实验组1、2和3)两两比较都未发现差异有统计学意义(P>0.05),见图4。

Figure 4. Blood recovery of mice in Group 1~6. A:hemoglobin(Hb);B:white blood cell(WBC);C:platelet(PLT).
图4各实验组移植后的血象结果
4.2移植后骨髓细胞的数量 表2显示各实验组受者骨髓细胞恢复情况。其中致敏组(实验组1、2、3和4)与非致敏组(实验组5和6)比较:第1周时致敏组与非致敏组中的移植组(实验组5)的比较中发现其差异无统计学意义(n=8,P>0.05),而与非致敏组中的不移植组(实验组6)的比较差异均有统计学意义(n=8,P<0.05);在移植后第2周时,致敏组1、2、3及4与非致敏移植实验组5差异均有统计学意义(n=8,P<0.01),说明致敏组骨髓被排斥,而非致敏移植组骨髓正在恢复。
表2受者骨髓细胞恢复情况

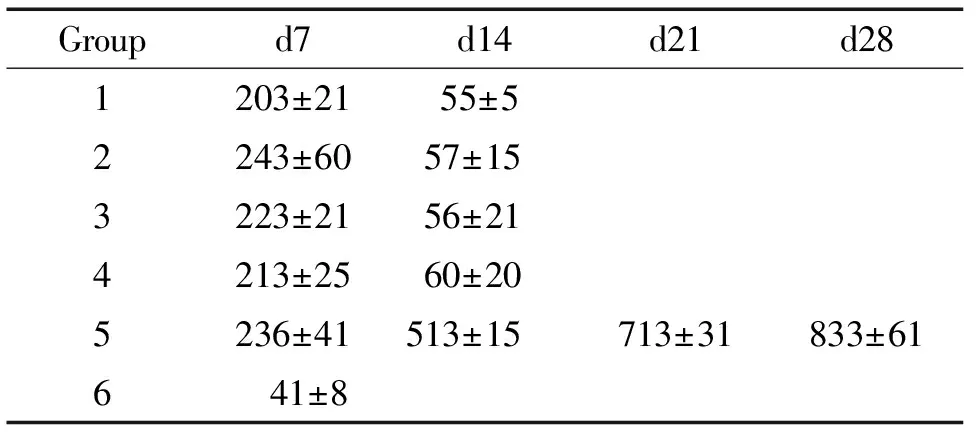
Groupd7d14d21d281203±21 55±5 2243±6057±153223±2156±214213±2560±205236±41513±15713±31833±616 41±8
4.3移植后恢复的骨髓细胞粒-巨噬细胞集落刺激单位(colony-forming unit-granulocyte macrophase,CFU-GM)功能检测
4.3.1非致敏组 单纯放射不移植组(实验组6)因致死性放射后骨髓衰竭,无CFU-GM细胞集落生成;正常移植组(实验5)第1及第2周的CFU-GM细胞集落分别为49.00±6.65和80.00±8.00,后者与同期正常小鼠(95.0±6.4)比较P>0.05,无统计学意义,说明正常移植组的造血干/祖细胞移植成功,骨髓细胞功能在进行性恢复。
4.3.2致敏组 无MSCs干预的致敏移植组(实验组4)与有MSCs干预的实验组(1、2及3)移植后的第1周CFU-GM数量分别为25.67±6.66、24.00±5.29、25.33±4.16及23.33±4.26,它们之间的两两比较差异均无统计学意义;但与正常小鼠照射移植组(实验组5)两两比较,差异均有统计学意义(P<0.01);说明致敏小鼠移植组无论MSCs干预与否,第1周骨髓虽然有植入但其功能是有缺陷的。而第2周无论是实验4或1、2及3组均未见CFU-GM细胞集落生成,而相对应同期出现了免疫排斥、小鼠移植失败死亡的表现,见图5。
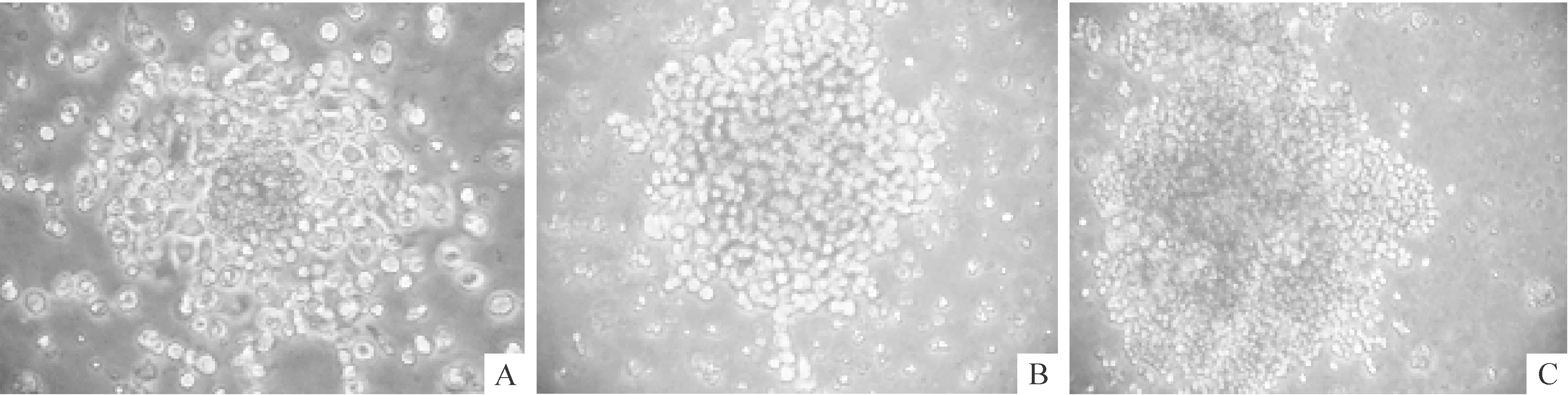
Figure 5. Colony-forming unit-granulocyte macrophage clonogenicity(×50).A:experimental group 3 (sensitized mice with MSC intervention);B:group 4 (sensitized mice without MSC intervention);C:group 5 (normal transplantion).
图5CFU-GM细胞集落
5移植后H-2Db嵌合分析
移植后第1周无论是致敏小鼠(包括MSCs干预或未干预的)和正常小鼠组骨髓细胞中均部分呈现供者来源的H-2Db阳性细胞,但程度稍有不同,其中致敏小鼠部分:实验组1、2、3及4分别为(38.15±4.80)%、(44.05±7.93)%、(50.16±1.98)%及(43.64±5.82)%,组间进行两两比较差异无统计学意义。但与同期非致敏部分[实验组5,(61.76±5.82)%]比较,差异有统计学意义。但在第2周正常小鼠组(实验组5)供者来源的H-2Db阳性细胞明显增多,为(90.97±6.47)%,说明骨髓在恢复,而致敏组[包括MSCs干预组(实验组1、2、3)和非MSCs干预组(实验组4)]均因骨髓细胞数过少,而没能进行H-2Db的检测,说明供者源性骨髓细胞受到排斥,MSCs的干预未能促进致敏小鼠异基因移植的植入和减少GVHD发生,未能延长致敏受者移植后的生存时间。
讨 论
有研究表明[12-14]: MSCs既可通过抑制T淋巴细胞的增殖,从而降低致敏过程中的细胞免疫反应,又可通过抑制B淋巴细胞分泌的抗体从而抑制体液免疫。虽然已有不少研究表明移植后输注MSCs可促进造血恢复及降低GVHD的发生,但MSCs于移植前干预是否可能降低致敏程度,促进其移植植入却有待探讨。在我们的体内活体实验中,于d11和(或)d0进行MSCs干预的实验结果表明:此策略不能延长致敏受者的生存时间。而进一步具体分析表明,移植后第1周无论MSCs干预与否,骨髓H-2Db检测结果发现,致敏小鼠的异基因骨髓均有短暂植入;但MSCs干预组血象中WBC、Hb及PLT的下降程度比无MSCs干预的致敏组低;到了第2周,无论是否进行过MSCs干预,致敏小鼠均出现明显贫血、脱毛及腹泻等,可能是GVHD,也可能是移植预处理的毒副作用;但随后的骨髓H-2Db检测证明移植物已被排斥,移植失败,不能造血重建,最终很快死亡。MSCs的干预未能促进致敏受者骨髓移植的植入。而Sudres等[15]报道在正常小鼠移植GVHD模型中,MSCs能在体外很好抑制致敏动物的淋巴细胞增殖,但在体内实验中却未能降低GVHD的发生,促进造血干/祖细胞移植的植入;其它报道亦认为虽然MSCs在体外对淋巴细胞的免疫调节作用以抑制为主,但到了体内该作用却丧失了,未出现促进造血干细胞移植的效果[13,16]。其原因如何?值得深入探讨。
而我们推测与如下原因有关:(1)可能与致敏模型即异基因脾细胞致敏的严重程度和所应用的MSCs剂量有关。我们采用的是1×106共2次(重度致敏)的致敏动物模型进行干预,同时已证实该种致敏程度下的移植100%是失败的。这本身仅仅代表临床情况的一种;临床实践工作中我们发现虽然致敏受者的移植成功率虽较非致敏受者低,但并非为0%。100%失败率的致敏模型足以证明其致敏程度是重度的,已经涉及到免疫记忆细胞等多方面因素,可能非单一干预手段所能解决。因此我们在今后的研究中提出分层干预理念,即:MSCs的干预应视致敏程度而有所不同,可进一步将致敏分为轻、中、重度和MSCs剂量分为低、中、高进行研究。(2)我们必须注意到体内MSCs与体外MSCs在表型及功能方面是有差别的,体外培养时往往是MSCs某一亚群得以优势生长增殖,而同一克隆的MSCs在生长过程中其基因表达、增殖能力、分化潜能及免疫表型也稍有差别,这说明MSCs体内和体外功能等方面可能是有差异的,这与MSCs状态、微环境具体情况密切相关[17-19]。(3)MSCs毕竟是成体干细胞,体积偏大,进入活体体内的数量有限,否则容易导致动物肺栓塞死亡等危险。(4)致敏程度与MSCs比例问题值得进一步探讨。本研究结果基本证实了对2次应用1×106异基因脾细胞致敏的小鼠动物模型来说,在这样的重度致敏程度下,于d11和(或)d0应用1×106MSCs对其造血干/祖细胞的移植的干预是不能起到促进其植入作用的,但该致敏程度与所用MSCs比例是否合适,有待进一步探讨。(5)与致敏机制密切相关。我们模拟临床上反复输血患者的致敏情况,应用异基因脾细胞进行动物致敏,研究表明主要是T、B淋巴细胞参与,涉及体液免疫及细胞免疫,而MSCs可以对T或B细胞的增殖起到抑制作用,但在实际致敏过程中可能涉及到记忆性T或B细胞等多种免疫细胞及多种因子的参与。MSCs的作用如何,以及MSCs进入致敏动物体内后如何受到致敏动物体内相关因子的“干预或引导”等也有待进一步研究。无论如何MSCs体现出的强大免疫调节作用及其低免疫原性,应用的安全性不容质疑,但需在策略方面例如分层干预等方面进一步探讨。
[1] Schrier SL, Angelucci E. New strategies in the treatment of the thalassemias[J]. Annu Rev Med,2005,56: 157-171.
[2] Krishnamurti L, Abel S, Maiers M, et al. Availability of unrelated donors for hematopoietic stem cell transplantation for hemoglobinopathies[J]. Bone Marrow Transplant, 2003,31(7): 547-550.
[3] Jaime-Perez JC, Ruiz-Arguelles GJ, Gomez-Almaguer D.Haematopoietic stem cell transplantation to treat aplastic anaemia[J]. Expert Opin Biol Ther, 2005,5(5): 617-626.
[4] La Nasa G, Argiolu F, Giardini C, et al. Unrelated bone marrow transplantation for β-thalassemis patients:the experience of the Italian Bone Marrow Transplant Group[J]. Ann N Y Acad Sci,2005,1054:186-195.
[5] Fang J, Huang S, Chen C, et al. Umbilical cord blood transplantation in Chinese children with beta-thalassemia[J]. J Pediatr Hematol Oncol,2004,26(3): 185-189.
[6] Le Blanc K,Ringden O. Immunomodulation by mesenchymal stem cell and clinical experience[J].J Inter Med,2007,262(5):509-525.
[7] Krampera M,Glennie S,Dyson J,et al. Bone marrow mesenchymal stem cells inhibit the response of naive and memory antigen-specific T cell to their cognate petide[J]. Blood, 2003,101(9):3722-3729.
[8] Bochev I,Elmadjian G,Kyurkchiev D, et al. bone marrow or adipose tissue differently modulate mitogen-stimulated B-cell immunoglobulin productioninvitro[J]. Cell Biol Int,2008,32(4):384-393.
[9] Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogeneic immune cell responses[J]. Blood,2005,105(4):1815-1822.
[10]Sung JH,Yang HM,Park JB, et al. Isolation and characterization if mouse mesenchymal stem cells[J]. Transplant Proc, 2008,40(8):2649-2654.
[11]Xu LH, Fang JP, Huang WG, et al.Marrow graft rejection by repeated transfusions of allogeneic donor spleen cells[J]. Bone Marrow Transplant, 2007,40(7):691-698.
[12]Rasmusson I, Le Blanc K,Sundberg B,et al. Mesenchymal stem cell stimulate antibody secretion in human B cells[J].Scand J Immunol,2007, 65(4): 336-343.
[13]Nauta AJ,Westerhuis G,Klingenberg AB,et al. Donor-derived mesenchymal stem cells are immuogenic in an allogeneic host and stimulate donor graft rejection in a nonmyeloablatice setting[J]. Blood,2006,108(6): 2114-2120.
[14]Prigozhina TB,Khitrin S, Elkin G, et al. Mesenchymal stromal cells lose their immunosuppressive potential after allotransplantation[J]. Exp Hematol,2008,36(10): 1370-1376.
[15]Sudres M,Norol F,Trenado A, et al. Bone marrow mesenchymal stem cells suppress lymphocyte proliferationinvitrobut fail to prevent graft-versus-host disease in mice[J]. J Immunol,2006,176(12):7761-7767.
[16]Eliopoulos N, Stagg J, Lejeune L, et al. Allogeneic marrow stromal cells are immune rejected by MHC class I- and class II-mismatched recipient mice[J]. Blood,2005,106(13): 4057-4065.
[17]Banfi A, Bianchi G, Notaro R,et al. Replicative aging and gene expression in long-term cultures of human bone marrow stromal cells[J]. Tissue Eng,2002,8(6) :901-910.
[18]Muraglia A, Cancedda R, Quarto R. Clonal mesenchymal progenitors from human bone marrow differentiateinvitroaccording to a hierarchical model[J]. J Cell Sci,2000,113(Pt 7):1161-1166.
[19]Tremain N, Korkko J, Ibberson D, et al. MicroSAGE analysis of 2,353 expressed genes in a single cell-derived colony of undifferentiated human mesenchymal stem cells reveals mRNAs of multiple cell lineages[J]. Stem Cells,2001,19(5): 408-418.
Effectofbonemarrowmesenchymalstemcellsonengraftmentofhematopoieticstem/progenitorcellsinsensitizedmice
HONG Dong-ling1, WU Yan-feng2, XU Lü-hong1, FANG Jian-pei1
(1DepartmentofPediatrics,2BiotherapyCenter,SunYat-senMemoryHospital,SunYat-senUniversity,Guangzhou510120,China.E-mail:jpfang2005@163.com)
AIM: To evaluate the effects of bone marrow-derived mesenchymal stem cells (MSCs) on engraftment of hematopoietic stem/progenitor cells in sensitized mice.METHODSMouse bone marrow-derived MSCs were cultured by adherent culture method. MSCs combined with or without hematopoietic stem/progenitor cells were implanted into the sensitized mouse model, which was established by allogeneic splenocyte transfusion, and were divided into 6 groups: MSC intervention groups, including sensitized mice with MSCs on day 11, sensitized mice with MSCs on day 0 and sensitized-mice with MSCs both on day 11 and day 0; control groups, including sensitized mice without MSC intervention, non-sensitized mice without MSC intervention and non-sensitized mice without MSCs or transplantation of hematopoietic stem/progenitor cells. The survivors were assessed after transplantation and hematopoietic recovery was monitored weekly including hematological change, immune function reconstruction, bone marrow cell recovery, chimera analysis and graft-versus-host disease development.RESULTSCompared with different control groups, MSC intervention did not prolong the survival rates of the sensitized model mice after lethal irradiation.CONCLUSIONUnder the experimental conditions, MSC combined with C57BL/6 bone marrow hematopoietic stem/progenitor cells fail to promote the growth of engraftment in C57BL/6 allogeneic splenocyte-sensitized BALB/c miceinvivo.
Bone marrow mesenchymal stem cells; Sensitized mice; Hematopoietic stem/progenitor cell transplantation
R457
A
10.3969/j.issn.1000-4718.2012.01.024
