胶质瘤细胞维甲酸代谢调控机制及其对细胞增殖的影响*
2012-07-31张继君谢思明林琛莅翁泽平钟雪云
张继君,谢思明,林琛莅,翁泽平,杜 展,王 超,钟雪云
(暨南大学医学院病理生理学教研室,广东 广州 510632)
恶性胶质瘤是成年人中最为常见的原发性脑肿瘤,尽管手术、放化疗技术不断发展,但胶质瘤的预后仍然较差。胶质瘤的预后情况与其分化程度密切相关,高级别的胶质瘤包括胶质母细胞瘤和间变性星形细胞瘤都具有较低的分化水平和较高的死亡率,尤其是胶质母细胞瘤病人中位生存时间还不到1年[1]。通过各种手段努力提高胶质瘤的分化水平已成为胶质瘤治疗的关键所在。
维甲酸是目前研究应用最为广泛的诱导分化剂之一,全反式维甲酸(all-trans retinoic acid,ATRA)联合三氧化二砷(arsenic trioxide,As2O3)已经成功应用于急性早幼粒细胞白血病的治疗并且取得显著的疗效[2],但是ATRA在实体肿瘤和其它类型白血病应用不多。维甲酸作用于人脑胶质瘤细胞能否诱导其分化,维甲酸在胶质瘤中合成过程又受到哪些因素的影响?这些都是值得我们深入探讨的问题。
醛脱氢酶1家族成员A1(aldehyde dehydrogenase 1 family member A1,ALDH1A1)将维甲酸的前体氧化成维甲酸[3-5],从而在维甲酸合成过程中发挥重要作用。KLF9(Krüppel- like transcription factor 9)属于17个KLFs家族成员之一,具有诱导神经球细胞分化,抑制神经球形成的能力[6]。前期研究已经证明KLF9在SWO-Z2细胞中有表达,ALDH1A1基因在SWO-Z2中相对高表达。最近的研究表明子宫内膜癌中KLF9的表达高低与恶性程度负相关,并且KLF9可以调控ALDH1A1基因的表达[7],在胶质瘤中是否有同样的调控关系目前还没有研究报道。本文通过小分子干扰实验来证明KLF9和ALDH1A1存在一定的调控关系,同时用ATRA处理SWO-Z2细胞观察其增殖分化能力变化,探讨维甲酸在胶质瘤中可能的合成调节过程,旨在研究胶质瘤细胞维甲酸的可能合成调控机制,以及维甲酸对胶质瘤细胞的增殖分化作用及其可能的机制。
材料和方法
1 主要材料与仪器
人脑胶质瘤细胞SWO-38由暨南大学医学院病理学教研室自建[8],SWO-Z2细胞从 SWO-38细胞系中通过单克隆形式分离获得[9];ATRA、9-cis RA和13-cis RA均购于 Sigma;改良型 RPMI-1640购自HyClone;CCK-8购自WST;Real-time PCR试剂盒购于 TaKaRa;KLF9抗体购于Santa Cruz;ALDH1A1抗体购于 Abcam;cyclin D1、cleaved PARP、Bcl-2、胶质纤维酸性蛋白(glial fibrillary acidic portein,GFAP)和内参照β-actin均购自CST;细胞裂解液及BCA蛋白定量试剂盒购于碧云天公司;ECL化学发光试剂购自Pierce;小分子干扰序列(si-RNA KLF9)由锐博公司设计合成;Real-time PCR引物由英俊公司合成;LipofectamineTM2000脂质体购于Invitrogen;垂直电泳槽及半干式电转移仪器均购自Bio-Rad。
2 方法
2.1 细胞培养 SWO-Z2细胞于5%CO2、37℃细胞培养箱中培养。培养基为改良型RPMI-1640培养液(加入10%胎牛血清、1×105U/L青霉素、100 mg/L链霉素)。取对数生长期、生长状态良好的SWO-Z2细胞(不含抗生素的培养基),以1.5 ×105cells/well接种于6孔板,24 h后细胞密度达到大约40%左右的汇合度。
2.2 siRNA-脂质体混合物的制备及转染 制备过程严格遵守脂质LipofectamineTM2000脂质体说明书要求,优化siRNA和脂质体的用量进一步提高转染效率。最终选用的siRNA浓度为50 nmol/L,稀释siRNA和LipofectamineTM2000转染试剂所选用的培养基均不含血清和抗生素,转染约6h后更换含有血清不含抗生素的培养基。
2.3 RT-PCR法检测SWO-Z2细胞维甲酸受体(retinoic acid receptors,RARs)mRNA 水平,以及KLF9被干扰后KLF9和ALDH1A1 mRNA表达 分别提取SWO-Z2细胞和转染24 h后SWO-Z2细胞的RNA,紫外分光光度仪测定RNA样品纯度和含量,逆转录试剂盒说明书提供的方法逆转录,逆转后的cDNA作为PCR的模板进行PCR扩增。RARα上游引物5'-GACCGGCTCTTGAGACATCC-3',下游引物5'-GGTGCTGGAGAGTGGTCAGA-3',产物长度为372 bp。RARβ上游引物 5'-GGAACGCATTCGGAAGGCTT -3',下游引物5'-GCAAGACGG ACTCGCAGTGT-3’,产物长度为383 bp。维甲类X受体 α(retinoid X receptor α,RXRα)上游引物 5'-TCCTTCTCCCACCGCTCCATC-3',下游引物 5'-CAGCTCCGTCTTGTCCATCT G-3',产物长度为169 bp。KLF9上游引物 5'-TGGCTGTGGGAAAGTCTATGG -3’,下游引物 5'-CTCGTCTGAGCGGGAGAACT-3’,产物长度为124 bp。ALDH1A1上游引物5’-CTCCTCTCACGGCTCTTCAC-3’,下游引物 5'-CCATGGTGTGCAAACTCAA C -3',产物长度为289 bp。阳性对照GAPDH上游引物5'-ACAGTCAGCCGCATCTTCTT -3’,下游引物 5'-GACAAGCTTCCCGTTCTCAG -3’,产物长度为259 bp。内参照β-actin上游引物5'-GTGGGGCGCCCCAGGCACCA -3',下游引物 5'-CTCCTTAATGTCACGCACGATTT-3’,产物长度为540 bp。PCR反应条件:95 ℃预变性3 min,95 ℃ 3 s,55.6 ℃ 6 s,72 ℃10 s,40 个循环,2-ΔΔCt法分析沉默效率。取 PCR 产物5 μL琼脂糖凝胶电泳,Bio-Rad凝胶电泳成像仪摄像,运用Quantity One软件对条带进行累计吸光度值(IA)测定,并计算目的基因与内参照基因条带灰度的相对比值[10]。
2.4 维甲酸对人脑胶质瘤细胞SWO-Z2的增殖抑制作用 应用CCK8试剂盒检测细胞增殖抑制率[11-13],SWO - Z2 细胞经 2.5%胰酶消化后,改良型RPMI-1640完全培养基制备2×107cells/L细胞悬液接种在96孔培养板中,每孔200 μL。24 h后处理组分别加入梯度浓度的9-cis RA、13-cis RA和ATRA,0.1%DMSO为对照组,每组浓度均设6个重复孔。72 h后每孔加入10 μL CCK-8溶液,加完试剂后轻轻敲击培养板混匀。37℃继续培养2~4 h后用酶联免疫检测仪在检测波长450 nm,参比波长630 nm处测得A值,取6个复孔的平均值,按公式计算增殖抑制率[增殖抑制率=(1-实验孔A值/对照孔A值)×100%],每组实验重复3次以上。
2.5 Western blotting法检测沉默48 h后 KLF9和ALDH1A1蛋白,以及ATRA作用SWO-Z2细胞72 h后 GFAP、cleaved PARP、Bcl-2和 cyclin D1的蛋白表达情况 按试剂盒上说明书要求提取全细胞蛋白:收集细胞,离心后弃培养基,PBS(pH=7.2~7.4)洗涤细胞,按照1×1012cells/L加入预冷的RIPA Buffer和PMSF混合液。BCA试剂盒测定蛋白浓度。每孔蛋白量30 μg于12%和5%聚丙酰胺凝胶上电泳,电泳条件:0.02A恒流30 min,0.04 A恒流100 min;转膜条件:0.35 A湿转60 min将蛋白转至PVDF膜。5%BSA室温封闭100 min后剪下包含目的蛋白的 PVDF膜,加入Ⅰ抗 Bcl-2(1∶1000)、cleaved PARP(1∶1000)、cyclin D1(1∶600)、GFAP(1∶500)和内参照 β -actin(1∶1000),4 ℃摇床孵育过夜,TBST洗膜每次10 min,共3次,HRP标记抗体Ⅱ抗(1∶5000)室温孵育1 h后TBST洗涤每次10 min,共3次。加强型化学发光液(ECL)发光,X光胶片暗室曝光、显影、洗片。BI2000灰度扫描分析条带IA进行统计学分析。
3 统计学处理
采用SPSS 13.0统计软件包进行统计分析,数据以均数±标准差()表示,进行两样本t检验和One-way ANOVA,以 P<0.05为差异有统计学意义。
结 果
1 KLF9 RNAi沉默后 KLF9和ALH1A1 mRNA的表达
RNAi干扰24 h real-time PCR结果显示,干扰后KLF9及ALDH1A1 mRNA水平与对照组相比明显下降(P<0.01)。有效的干扰浓度为50 nmol/L,干扰效率超过50%。2-ΔΔCt法计算干扰前后mRNA表达差异倍数,见图1。
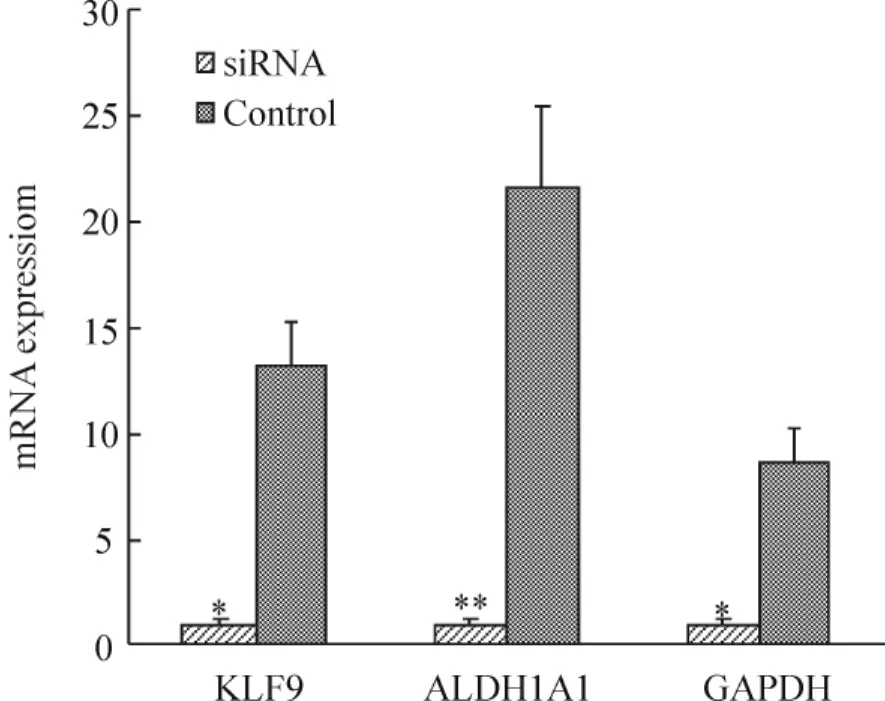
Figure 1.Expression levels of KLF9 and ALDH1A1 mRNA detected by real-time PCR after KLF9 silencing.GAPDH served as a positive control..n=3.*P<0.05,** P <0.01 vs control.图1 50 nmol/L RNAi沉默 KLF924 h后 KLF9和 ALDH1A1 mRNA的表达
2 KLF9沉默后KLF9和ALDH1A1蛋白的表达
小分子RNA干扰KLF9基因,有效浓度为50 nmol/L,48 h后Western blotting结果显示,KLF9蛋白(条带位于约32 kD)表达水平显著下降(P<0.05),ALDH1A1蛋白(条带位于约55 kD)表达也显著下降(P<0.01),见图2。

Figure 2.Down-regulation of KLF9 and ALDH1A1 protein expression in SWO-Z2 cells with KLF9 siRNA treatment..n=3.*P <0.05,** P <0.01 vs control group.图2 KLF9沉默48 h后KLF9和ALDH1A1蛋白的表达
3 不同的维甲酸对SWO-Z2细胞的增殖抑制作用
在加入3种不同维甲酸72 h后,细胞增殖能力在不同程度上受到抑制,而相同浓度和作用时间条件下,3种不同维甲酸对SWO-Z2细胞的增殖抑制作用不同,其中ATRA效果最佳,见图3。
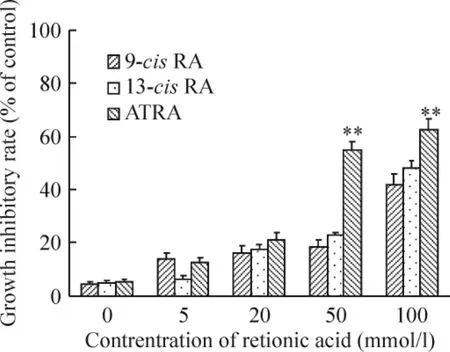
Figure 3.Chagnes of the three kinds of retinoic acid on proliferation of SWO-Z2 cells detected by CCK-8 assay..n=3.**P <0.01 vs 9 - cis RA or 13 - cis RA.图3 CCK-8法检测3种不同的维甲酸对SWO-Z2细胞增殖活性的影响
4 不同浓度的ATRA作用SWO-Z2细胞72 h后cyclin D1、cleaved PARP、Bcl-2和 GFAP 的变化
不同浓度ATRA(DMSO浓度<0.1%)分别处理SWO-Z2细胞72 h后 Western blotting结果表明,cleaved PARP蛋白表达上调(P<0.01),Bcl-2蛋白表达下降(P<0.05),cyclin D1蛋白表达也明显下调(P<0.05),细胞增殖能力下降甚至发生了凋亡,但GFAP在药物处理前后没有明显变化,说明ATRA并没有促进胶质瘤的分化,见图4。

Figure 4.Western blotting was used to analyze the expression of cleaved PARP,cyclin D1,Bcl-2 and GFAP in SWO-Z2 cells treated with different concentrations of ATRA for 72 h.1:control group;2:5 μmol/L ATRA;3:20 μmol/L ATRA;4:50 μmol/L ATRA..n=3.*P <0.05,** P <0.01 vs control group.图4 不同浓度ATRA处理SWO-Z2细胞72 h后cleaved PARP、Bcl-2、cyclin D1和 GFAP 蛋白的表达
5 SWO-Z2细胞及ATRA处理后维甲酸受体的表达
结果表明,3种不同维甲酸受体在SWO-Z2细胞中表达很低,条带非常弱,而且在不同浓度ATRA处理下3种受体mRNA表达几乎没有变化,见图5。

Figure 5.Real-time PCR detection for the expression of RARα,RARβ and RXRα in SWO-Z2 cells..n=3.图5 3种维甲酸受体在SWO-Z2细胞的表达以及ATRA对3种受体表达的影响
讨 论
近年来随着维甲酸能够成功治愈急性早幼粒细胞白血病,人们又不断研究维甲酸在其它实体肿瘤中的应用。恶性胶质瘤由于侵袭性强、易复发,且复发后病理级别上升和肿瘤异质性等自身独特的生物学特征,导致其治疗非常棘手。而传统手术切除、放化疗以及显微外科技术、免疫治疗和基因治疗等先进诊疗技术都未能显著的提高胶质瘤病人的5年生存率。维甲酸信号在调控胚胎发育中发挥重要作用,同时维甲酸信号调控异常是胶质瘤发病过程中的重要事件[5],所以研究胶质瘤中的维甲酸信号是进行胶质瘤诱导治疗方案的重要基础。
维甲酸在体内的合成主要包括两次氧化过程[14],其中ALDH1A1在维甲酸前体氧化成为维甲酸(第二次氧化)的步骤中发挥重要作用[3-4]。KLF9又称为基本转录元件结合蛋白,参与细胞生长发育、增殖分化以及细胞周期的调控,在维甲酸和血清两种分化信号存在下KLF9的表达上调发挥诱导神经球分化抑制神经球形成的能力[15]。我们前期基因芯片、实时定量PCR以及Western blotting结果(待发表)都表明ALDH1A1和KLF9基因在SWO-Z2细胞中高表达,所以维甲酸的合成代谢和KLF9基因的表达情况可能存在密切的关系。通过基因沉默证实KLF9是ALDH1A1的上游调控基因,并且正调控ALDH1A1基因的表达促进维甲酸的合成,胶质瘤细胞中存在维甲酸合成调控信号。但是不同浓度的ATRA对人脑胶质瘤细胞具有抑制增殖作用,并且抑制效率与ATRA浓度呈正相关,同时不同浓度ATRA对胶质瘤细胞的GFAP表达几乎没有变化,而抑制增殖作用相关蛋白发生相应变化,这些说明ATRA作用于人脑胶质瘤并没有诱导胶质瘤分化而是抑制胶质瘤的增殖甚至发生凋亡。
与胶质瘤相似,ATRA作用于实体肿瘤如非小细胞肺癌细胞[16]和肝癌细胞[17]会引起增殖抑制,凋亡标志物诱导表达,这些都说明ATRA在实体肿瘤中主要抑制肿瘤细胞增殖甚至发生凋亡。至于维甲酸在胶质瘤中发挥抑制增殖作用而没有诱导其分化的原因尚不清楚。维甲酸既然在胶质瘤中存在合成调节但是具有诱导分化的作用,主要的原因是维甲酸受体在神经系统中的表达比较低或者缺失导致其没有作用靶点。维甲酸受体包括两类,即 RARs和RXRs,其中前者是维甲酸发挥诱导分化作用的主要受体。我们进一步检测了SWO-Z2细胞中的3种维甲酸受体,结果表明维甲酸受体在胶质瘤细胞中比较低。而且在本研究中,不同浓度的ATRA作用于SWO-Z2细胞后,维甲酸受体表达几乎没有发生变化,可能的原因就是在细胞体外传代培养过程中,细胞对维甲酸的敏感性发生变异,因为有研究表明原代培养的胶质瘤细胞对维甲酸的敏感性高于胶质瘤细胞株[18]。
综上所述,一方面在人脑胶质瘤细胞中KLF9通过正调控ALDH1A1的表达促进维甲酸的合成;另一方面维甲酸作用于人脑胶质瘤细胞未能诱导分化而是引起肿瘤细胞的增殖抑制甚至发生凋亡,主要原因可能就是胶质瘤中的维甲酸受体表达较少且敏感性改变。本实验为利用维甲酸对胶质瘤细胞的增殖抑制作用发挥抗肿瘤作用提供有力证据,同时也为提高维甲酸受体对药物的敏感性从而应用维甲酸诱导治疗胶质瘤提供新的思路。
[1]Stupp R,Mason WP,van den Bent MJ,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].N Engl J Med,2005,352(10):987 -996.
[2]Wang ZY,Chen Z.Differentiation and apoptosis induction therapy in acute promyelocytic leukaemia[J].Lancet Oncol,2000,1(2):101 -106.
[3]Reijntjes S,Blentic A,Gale E,et al.The control of morphogen signalling:regulation of the synthesis and catabolism of retinoic acid in the developing embryo[J].Dev Biol,2005,285(1):224 -237.
[4]Maden M.Retinoic acid in the development,regeneration and maintenance of the nervous system[J].Nat Rev Neurosci,2007,8(10):755 -765.
[5]Campos B,Centner FS,Bermejo JL,et al.Aberrant expression of retinoic acid signaling molecules influences patient survival in astrocytic gliomas[J].Am J Pathol,2011,178(5):1953 -1964.
[6]Ying M,Sang Y,Li Y,et al.Krüppel- like family of transcription factor 9,a differentiation-associated transcription factor,suppresses Notch1 signaling and inhibits glioblastoma - initiating stem cells[J].Stem Cells,2011,29(1):20-31.
[7]Simmen FA,Su Y,Xiao R,et al.The Krüppel- like factor 9(KLF9)network in HEC-1-A endometrial carcinoma cells suggests the carcinogenic potential of dys-regulated KLF9 expression[J].Reprod Biol Endocrinol,2008,6(1):41.
[8]方 茅,杜 彬,钟雪云,等.EGCG通过下调COX-2和MMP-2表达抑制人脑胶质瘤细胞的迁移和侵袭[J].中国病理生理杂志,2010,26(10):1890 -1894.
[9]Zhong XY,Chen YX,Ye SF,et al.Establishment of two cell sublines from SWO-38 glioma cell:immunohistochemical and ultrastructural study[J].Int J Modern Cancer Ther,2000,3(2):34 -36.
[10]石 榴,李 理,袁伟锋,等.RNAi沉默 NF-κB p65对小鼠巨噬细胞细胞因子表达的影响[J].中国病理生理杂志,2011,27(7):1264 -1269.
[11]刘明华,任美萍,肖顺汉,等.复尔康注射液对肝癌HepG2细胞凋亡和VEGF表达的影响[J].中草药,2009,40(8):1288 -1290.
[12]辛培成,杨 圣,芦健民,等.CCK-8法检测兔筋膜成纤维细胞增殖活性之最佳测试条件研究[J].中外医学研究,2011,9(12):6 -8.
[13]熊建文,张镇西,肖 化.MTT法和CCK-8法检测细胞活性之测试条件比较[J].激光生物学报,2007,16(5):559-562.
[14]Farjo KM,Moiseyev G,Nikolaeva O,et al.RDH10 is the primary enzyme responsible for the first step of embryonic vitamin A metabolism and retinoic acid synthesis[J].Dev Biol,2011,357(2):347 -355.
[15]Ying M,Sang Y,Li Y,et al.KLF9,A differentiationassociated transcription factor,suppresses notch1 signaling and inhibits glioblastoma- initiating stem cells[J].Stem Cells,2010,29(1):20 -31.
[16]Lokshin A,Zhang H,Mayotte J,et al.Early effects of retinoic acid on proliferation,differentiation and apoptosis in non - small cell lung cancer cell lines[J].Anticancer Res,1999,19(6B):5251 -5254.
[17]Piao YF,Shi Y,Gao PJ.Inhibitory effect of all-trans retinoic acid on human hepatocellular carcinoma cell proliferation[J].World J Gastroenter,2003,9(9):2117 -2120.
[18]Bouterfa H,Picht T,Kess D,et al.Retinoids inhibit human glioma cell proliferation and migration in primary cell cultures but not in established cell lines[J].Neurosurgery,2000,46(2):419 -430.
