Zacopride增强心肌内向整流钾电流(IK1)效应的受体和信号转导通路*
2012-11-06刘清华许言午吴博威
刘清华, 许言午, 吴博威
(山西医科大学1病理生理教研室, 2生理教研室,3细胞生理学省部共建教育部重点实验室, 山西 太原030001;4上海中医药大学生物化学教研室,上海 201200)
1000-4718(2012)01-0006-05
2011-05-23
2011-11-09
国家自然科学基金资助项目(No. 30840038);山西省自然科学基金青年项目(No. 2009021043-2)
△通讯作者 Tel: 0351-4135067; E-mail: liuqh20041206@163.com
Zacopride增强心肌内向整流钾电流(IK1)效应的受体和信号转导通路*
刘清华1,3△, 许言午4, 吴博威2,3
(山西医科大学1病理生理教研室,2生理教研室,3细胞生理学省部共建教育部重点实验室, 山西 太原030001;4上海中医药大学生物化学教研室,上海 201200)
目的探讨5-HT4受体激动剂兼5-HT3受体阻断剂zacopride增强心肌内向整流钾电流(IK1)效应的受体和细胞信号转导机制。方法应用全细胞膜片钳技术记录大鼠心室肌细胞膜IK1电流,分别观察10 μmol/L 5-HT4受体阻断剂 RS23597-190、10 μmol/L 5-HT3受体激动剂间氯苯双胍(m-CPBG)、5 μmol/L PKA 抑制剂 KT5720、5 μmol/L PKC 抑制剂GF109203x 和 5 μmol/L PKG抑制剂 KT5823对zacopride 增强IK1的影响。结果10 μmol/L 5-HT4受体阻断剂RS23597-190本身可抑制IK1电流,在预先应用RS23597-190的基础上,1 μmol/L zacopride仍可明显激动IK1通道,使其内向电流(-100 mV)增强32.5% (P< 0.05)。10 μmol/L 5-HT3受体激动剂m-CPBG对IK1电流无明显影响,也不能逆转1 μmol/L zacopride对IK1的增强效应(P> 0.05)。此外,5 μmol/L PKA 阻断剂 KT5720能显著抑制1 μmol/L zacopride对IK1的增强效应(P< 0.05),而PKC 阻断剂GF109203x和PKG阻断剂KT5823则对1 μmol/L zacopride的效应无明显影响(P> 0.05)。结论Zacopride对IK1的增强作用可能经由PKA介导的信号转导通路,而不依赖于5-HT3和5-HT4受体。
内向整流钾通道; Zacopride; 受体,5-HT
Zacopride属苯甲酰胺衍生物,兼有5-羟色胺4(5-hydroxytryptamine 4,5-HT4)受体激动剂和5-羟色胺3(5-HT3)受体阻断剂作用,对实验动物具有促胃肠道动力和止吐作用[1-2]。我们在一项比较5-HT4受体激动剂致心律失常副作用的研究中发现 zacopride对正常大鼠心律和心功能均无明显影响。Zacopride对大鼠心室肌内向整流钾电流(inward rectifier K+current,IK1)表现出显著的增强作用,同时对Ito、ICa-L、INa等影响动作电位的主要离子流均无显著作用。IK1是心肌最主要的背景电流,参与静息电位的维持和心肌动作电位3期终末的复极。Zacopride增强IK1可以使细胞膜超极化,增大静息膜电位,并缩短动作电位时程,从而消除乌头碱、氯化钡中毒等因素引发的心律失常[3]。增强心室肌IK1有可能成为一条抗心律失常的新途径。由于5-HT受体广泛分布于中枢神经系统和外周组织,因此首先要明确zacopride增强IK1是经5-HT受体介导还是经受体外途径,亦或两者兼有。磷酸化是许多离子通道或转运体信号通路调节的重要机制和环节,IK1也不例外。多年来对IK1影响因素的研究表明,IK1受到PLC/ Ca2+/PKC和AC/cAMP/PKA信号转导系统的双重调节[4-6],而NO/cGMP/PKG信号系统对IK1的调节鲜有报道。Zacopride增强IK1的作用究竟受到何种信号系统的调节?本实验将采用全细胞膜片钳技术研究5-HT4受体阻断剂 RS23597-190, 5-HT3受体激动剂间氯苯双胍(m-chlorophenylbiguanide,m-CPBG)、PKA 抑制剂 KT5720、PKC 抑制剂GF109203x 和 PKG抑制剂 KT5823对zacopride增强IK1的影响,从而探讨zacopride增强IK1的受体与细胞信号转导机制。
材 料 和 方 法
1试剂及配制
1.1Zacopride hydrochloride、RS23597-190、m-CPBG、KT5720、GF109203x、KT5823和牛磺酸购自Tocris。胶原酶P购自德国Bochringer Mannhein。其余均为国内生产分析纯产品。
1.2台氏液(mmol/L) NaCl 140,KCl 5.4,NaH2PO40.33,HEPES 5.0,葡萄糖10,MgCl21.0,CaCl21.8,用NaOH调节pH至7.38。酶液为无钙台氏液中加入牛磺酸20,胶原酶70~100 mg/L。
1.3KB液(mmol/L) KOH 85,L-谷氨酸 50,KCl 30,牛磺酸 20,KH2PO430,MgCl21.0,HEPES 10,葡萄糖 10,EGTA 0.5,用KOH调节pH至7.4。
1.4IK1电极内液成分(mmol/L) KCl 150,HEPES 5,EGTA 5.0,ATP-K23.0,MgCl21.0,4-AP 5.0,ATP-Mg 1.0,用KOH调节pH至7.3;细胞外液在台氏液中加入CdCl20.5 mmol/L阻断ICa-L电流。
2分离单个心室肌细胞及记录IK1电流
选用健康成年SD大鼠(购自河北实验动物中心),雄性,220~250 g,术前15 min静脉注射肝素(1 000 U/kg),戊巴比妥钠(65 mg/kg)麻醉后颈动脉放血,迅速开胸取出心脏,置于4 ℃用100%氧气饱和的无钙台氏液中修剪,然后将心脏悬挂在Langendorff灌流装置上经主动脉逆行灌流。先用无钙台氏液灌流8~10 min,再用酶液循环灌流15~20 min。 灌流过程中保持37 ℃恒温,灌流压6.86 kPa,并持续通以100%氧气。待心室肌组织变大、变软后将其剪碎,置于KB 液中轻轻吹打得到分散的心室肌细胞,经150 μm孔径的滤网过滤后保存于KB液中。室温放置2~3 h后将存放于高钾KB液中的细胞逐步复钙。然后取几滴细胞悬液加入细胞池(约1 mL),平放在连有微操纵仪的倒置显微镜上静置10 min,待细胞充分贴壁后,用台氏液灌流,速度约2 mL/min。电极用玻璃毛细管经微电极拉制仪(Narishige,PP-83)分两步拉制而成,充灌电极内液后,电阻约2~5 MΩ。选取横纹清晰的心肌细胞进行实验。形成高阻抗封接后,用负压破膜,进行全细胞记录。离子电流信号经Axopatch 200B膜片钳放大器(Axon Instrument)、Digidate 1322A模数转换器及Pclamp8.0采集、贮存及分析。所有实验均在室温25 ℃下进行。电压钳方式下进行全细胞离子流记录。分别观察1 μmol/L zacopride 对IK1的增强效应,及10 μmol/L 5-HT4受体阻断剂 RS23597-190、10 μmol/L 5-HT3受体激动剂m-CPBG、5 μmol/L PKA 抑制剂 KT5720、5 μmol/L PKC 抑制剂GF109203x和5 μmol/L PKG抑制剂 KT5823对zacopride增强IK1的影响。
3统计学处理
结 果
1Zacopride增强IK1的受体通路
1.1Zacopride呈浓度依赖性增强IK1,1 μmol/L为其最适浓度[3], 5-HT4受体阻断剂RS23597-190(10 μmol/L)本身可抑制IK1,在此基础上,应用1 μmol/L zacopride仍可显著激动IK1通道,其内向电流(-100 mV)可增大32.5% [由(- 5.10 ± 0.46) pA/pF增大至(- 6.76 ± 0.60) pA/pF,P< 0.05],表明 zacopride对IK1的增强效应不是由5-HT4受体介导的,见图1。


图15-HT4受体阻断剂RS23597-190对zacopride增强IK1的影响
1.21 μmol/L zacopride可显著增强IK1,10 μmol/L 5-HT3受体激动剂m-CPBG对IK1电流无明显影响,也不能逆转1 μmol/L zacopride对IK1的增强效应(P> 0.05)。表明 zacopride增强IK1不通过5-HT3受体途径,见图2。


图25-HT3受体激动剂m-CPBG对zacopride增强IK1的影响
2Zacopride增强IK1的细胞信号转导通路
2.15 μmol/L PKA阻断剂 KT5720能完全逆转1 μmol/L zacopride对IK1的增强效应(P< 0.05),表明zacopride可能经由PKA信号系统增强IK1,见图3、5。

图3PKA阻断剂KT5720对zacopride增强IK1的影响
2.25 μmol/L PKC阻断剂GF109203x对1 μmol/L zacopride的效应无明显影响(P>0.05),提示PKC信号系统不参与zacopride对IK1的调节作用,见图4、5。


图4PKC阻断剂GF109203x对zacopride增强IK1的影响
2.35 μmol/L PKG阻断剂KT5823对1 μmol/L zacopride的效应无明显影响(P> 0.05),提示PKG信号系统也不参与zacopride对IK1的调节,见图5。
讨 论
5-HT受体广泛分布于中枢神经系统和外周组织,对外周组织多种器官的反应起重要作用,包括消化道、膀胱、心脏和肾上腺,在中枢神经系统如认知、情感、食欲调节、止吐和抗焦虑等方面也具有重要的作用。5-HT4受体激动剂作为促胃肠动力药可以促进胃排空、加快小肠和结肠蠕动[7];而5-HT3受体目前只有阻断剂具有临床应用价值,用于止吐和肠易激综合征[8]。但这些药物在发挥相应效应的同时其致心律失常副作用也引起了普遍担忧。已有的研究表明,5-HT4受体激动剂和5-HT3受体阻断剂潜在的致心律失常风险与其阻断延迟整流钾电流(IK)有关[9-10],使得复极延缓,QT间期延长,甚至发生致死性尖端扭转型室性心动过速(torsades de pointes, TDP)。Zacopride兼有5-HT4受体激动剂和5-HT3受体阻断剂作用,但在我们的研究中,zacppride对实验大鼠无明显致心律失常副作用,且具有抗心律失常的疗效,其离子机制为增强心室肌IK1,进而增大静息膜电位,加快动作电位3期复极[3]。 Zacopride对IK1的特异性作用是否通过5-HT受体介导?这类药物是否都具有相似的药理学作用?我们分别观察了5-HT4受体阻断剂 RS23597-190和5-HT3受体激动剂m-CPBG 对zacopride增强IK1的影响,发现两者均不能阻断zacopride对大鼠心室肌IK1的增强效应。刘清华等[11]报道另一5-HT4受体激动剂兼5-HT3受体阻断剂2-[1-(4-piperonyl)piperazinyl]benzothiazole致大鼠心律失常风险的电生理学机制为抑制IK1。综合本文结果,zacopride对IK1的增强作用很可能是其特有的,非5-HT受体依赖性的药理学作用。能否将IK1作为筛选安全促胃肠动力药和止吐药的新指标,将是我们下一步工作的方向。此外,5-HT4受体主要分布在心房组织,在多种动物种属中会介导心动过速和正性变力效应,提示内源性5-HT4受体激活在心律失常发生中起重要作用,会导致心房纤颤和猝死[12]。以往认为大鼠心室肌缺乏5-HT4受体[13],而最近的研究显示大鼠心室肌细胞有5-HT4受体mRNA表达,在心衰大鼠,其表达可上调4倍[14]。作为5-HT4受体激动剂,zacopride对心房的作用有待进一步研究;而其对大鼠心室肌细胞IK1的非受体依赖性激动效应,究竟是由于5-HT4受体缺如所致,抑或另有途径,也需进一步阐明。
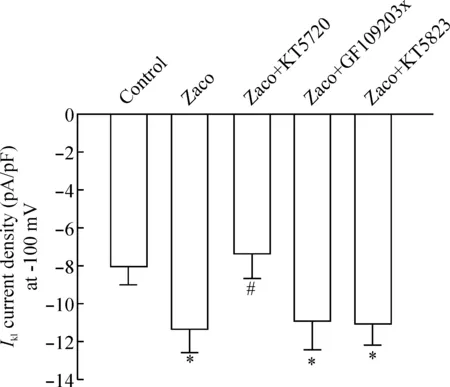
Figure 5. The effects of the inhibitors of PKA, PKC and PKG on the augmentedIK1induced by 1 μmol/L zacopride. Zaco:zacopride.*P< 0.05vscontrol;#P< 0.05vsZaco.
图5PKA、PKC和PKG阻断剂对zacopride增强IK1的影响
许多研究表明PLC/Ca2+/PKC和AC/cAMP/PKA信号系统在IK1调节中具有作用,但各家报道不一。如Fakler等[4]认为PKA 催化亚基可上调爪蟾卵母细胞IK1的表达,而PKC特异性激动剂可下调IK1。Koumi等[5]发现纯化的PKA 催化亚基下调内源性IK1。在人心肌细胞,内皮素(ET-1)对IK1的抑制作用可被PKC抑制剂staurosporine阻断,但PKA特异性抑制剂 KT5720对内皮素的作用无影响[6]。在我们的研究中,5 μmol/L KT5720可显著抑制zacopride对大鼠心室肌细胞IK1的增强作用,而PKC抑制剂GF109203X和PKG抑制剂KT5823并不能逆转zacopride对IK1的增强效应。这提示我们,zacopride对大鼠心室肌细胞IK1的增强效应很可能经由PKA信号系统介导,PKC和PKG信号系统不参与zacopride药理学作用的调节。到目前为止,尚没有公认的IK1选择性激动剂或阻断剂,这给IK1通道的研究带来困扰。Zacopride 对IK1的增强效应受PKA信号系统调节则可能为我们筛选IK1药理学工具药提供了思路和方向。
[1] Talley NJ. 5-hydroxytryptamine agonists and antagonists in the modulation of gastro-intestinal motility and sensation: clinical implications[J]. Aliment Pharmacol Ther, 1992,6(3):273-289.
[2] Costall B, Naylor RJ. Neuropharmacology of emesis in relation to clinical response[J]. Br J Cancer Suppl, 1992, 19: S2-S7.
[3] 刘清华, 吴博威, 张 杨,等. Zacopride增强心肌内向整流钾电流(IK1)发挥抗心律失常效应[J]. 中国病理生理杂志, 2010, 26(6):1041-1046.
[4] Fakler B, Brändle U, Glowatzki E, et al. Kir2.1 inward rectifier K+channels are regulated independently by protein kinases and ATP hydrolysis[J]. Neuron, 1994, 13 (6): 1413-1420.
[5] Koumi S, Wasserstrom JA, Ten Eick RE. β-Adrenergic and cholinergic modulation of inward rectifier K+channel function and phosphorylation in guinea-pig ventricle[J]. J Physiol, 1995, 486(Pt 3): 661-678.
[6] Kiesecker C, Zitron E, Scherer D, et al. Regulation of cardiac inwardly rectifying potassium currentIK1and Kir2.x channels by endothelin-1[J]. J Mol Med, 2006, 84(1): 46-56.
[7] De Ponti F. Pharmacology of serotonin: what a clinician should know[J]. Gut, 2004, 53(1): 1520-1535.
[8] Thompson AJ, Lummis SC. The 5-HT3receptor as a therapeutic target[J]. Expert Opin Ther Targets, 2007, 11(4):527-540.
[9] Potet F, Bouyssou T, Escande D, et al. Gastrointestinal prokinetic drugs have different affinity for the human cardiac human ether-a-gogo K(+) channel[J]. J Pharmacol Exp Ther, 2001, 299(3):1007-1012.
[10]Kuryshev YA, Brown AM, Wang L, et al. Interactions of the 5-Hydroxytryptamine 3 antagonist class of antiemetic drugs with human cardiac ion channels[J]. J Pharmacol Exp Ther, 2000, 295(2):614-620.
[11]刘清华, 张 杨, 林媛媛, 等. 5-HT4受体激动剂兼5-HT3受体阻断剂2-[1-(4-piperonyl)piperazinyl]-benzothiazole致心律失常机制探析[J]. 中国药理学通报, 2010, 26(4):461-465.
[12]Yusuf S, Al-Saady N,Camm AJ. 5-Hydroxytryptamine and atrial fibrillation:how significant is this piece in the puzzle?[J].J Cardiovasc Electrophysiol, 2003,14(2):209-214.
[13]Qvigstad E, Brattelid T, Sjaastad I, et al. Appearance of a ventricular 5-HT4receptor-mediated inotropic response to serotonin in heart failure[J]. Cardiovasc Res, 2005, 65(4):869 -878.
[14]Afzal F, Andressen KW, Mrk HK, et al. 5-HT4-elicited positive inotropic response is mediated by cAMP and regulated by PDE3 in failing rat and human cardiac ventricles[J]. Br J Pharmacol, 2008, 155(7):1005-1014.
Receptorandsignalingmechanismsinvolvedinzacopride-inducedpotentiationofIK1
LIU Qing-hua1, 3,XU Yan-wu4, WU Bo-wei2, 3
(1DepartmentofPathophysiology,2DepartmentofPhysiology,3KeyLaboratoryofCellularPhysiologyco-establishedbyMinistryofEducationofChinaandShanxiProvince,ShanxiMedicalUniversity,Taiyuan030001,China;4DepartmentofBiochemistry,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201200,China.E-mail:liuqh20041206@163.com)
AIM: To investigate the receptor and signaling mechanisms involved in the potentiation of inward rectifier K+current (IK1) induced by zacopride, a potent 5-HT3receptor antagonist and 5-HT4receptor agonist.METHODSThe whole-cell patch clamp technique was used to recordIK1. 5-HT4-receptor antagonist RS23597-190, 5-HT3-receptor agonistm-chlorophenylbiguanide (m-CPBG), PKA inhibitor KT5720, PKC inhibitor GF109203X and PKG inhibitor KT5823 were applied respectively to determine the regulatory mechanism ofIK1.RESULTSIn the presence of RS23597-190 at concentration of 10 μmol/L which inhibitedIK1, zacopride at concentration of 1 μmol/L still increasedIK1with the mean increment of 32.5% in inward current (at -100 mV,P<0.05). TheIK1increment induced by zacopride was not inhibited bym-CPBG at concentration of 10 μmol/L (P>0.05). Furthermore, PKA inhibitor KT5720 at concentration of 5 μmol/L reversed the effect of zacopride (P<0.05), while PKC inhibitor GF109203X and PKG inhibitor KT5823 both at concentration of 5 μmol/L didn’t influence the effect (P>0.05).CONCLUSIONZacopride potentiatesIK1via a PKA-mediated signaling pathway, which is independent on 5-HT4and 5-HT3receptors.
Inward rectifier K+current; Zacopride; Receptors,5-HT
R363
A
10.3969/j.issn.1000-4718.2012.01.002

中国病理生理学会2012年活动计划表
