骨形成蛋白-7对晚期糖基化终产物诱导大鼠腹膜间皮细胞上皮-间叶转化的影响
2012-11-06邵维斌夏春英冯松涛
邵维斌,朱 莉,顾 琳,夏春英,李 忻,荀 康,冯松涛
(江苏省镇江市第一人民医院肾脏内科,江苏镇江,212002)
腹膜纤维化和大量新生血管形成是导致长期腹膜透析患者腹膜功能衰竭的主要原因[1]。大量研究[2-3]表明:随着腹膜透析的进行,非生理性透析液尤其是晚期糖基化终产物(AGEs)、葡萄糖降解产物等可引起腹膜间皮细胞逐渐丧失上皮细胞表型,发生上皮细胞间质转化(EMT),这种发生EMT的腹膜间皮细胞具有浸润和迁移的能力,是导致腹膜纤维化和新生血管形成的关键环节[4],防止和逆转晚期糖基化终产物等引起的腹膜间皮细胞EMT对于防治长期腹膜透析患者腹膜功能衰竭具有重要意义。本研究探讨防治晚期糖基化终产物引起的腹膜间皮细胞EMT的方法。
1 材料与方法
1.1 原代大鼠腹膜间皮细胞的培养
大鼠腹膜间皮细胞分离、培养及鉴定,腹膜间皮细胞呈圆形、椭圆形、多边形等,融合后呈典型的铺路石样。免疫组化结果显示细胞角蛋白、波形蛋白阳性。取第3代细胞进行实验。
1.2 晚期糖基化终产物诱导大鼠腹膜间皮细胞上皮-间叶转化
第3代大鼠腹膜间皮细胞经含80 mmol/L AGEs-BSA的M 199培养基培养72h[5],以含80 mmol/L BSA的M199培养基为对照,正常大鼠腹膜间皮细胞呈铺路石状,在晚期糖基化终产物作用72 h后细胞出现明显的梭形或不规则形改变,似成纤维细胞,部分细胞出现互相交叉重叠现象。实时定量PCR(RT-PCR)检测结果显示,晚期糖基化终产物刺激后,大鼠腹膜间皮细胞α平滑肌肌动蛋白(α-SMA)mRNA表达水平增加而E-cadherin mRNA表达水平下降;Western印迹结果显示,晚期糖基化终产物刺激后,大鼠腹膜间皮细胞α-SMA蛋白表达水平增加,而 E-cadherin蛋白表达水平下降。与对照组及BSA组相比,具有统计学意义(P<0.05)。表明晚期糖基化终产物诱导大鼠腹膜间皮细胞上皮-间叶转化。
1.3 分组
对照组,含80 mmol/L AGEs-BSA的M199培养基;5ng/mL骨形成蛋白-7(BMP-7)组,含5 ng/mL和80 mmol/L AGEs-BSA(晚期糖基化终产物牛血清白蛋白)的M199培养基;10 ng/mL BMP-7组,含10 ng/mL 和80 mmol/L AGEs-BSA的M199培养基;晚期糖基化终产物诱导上皮-间叶转化的大鼠腹膜间皮细胞经上述各组培养基培养48 h后收集细胞,分别提取 RNA、蛋白。
1.4 RT-PCR检测 E-cadherin、α-SMA 、Ⅰ型胶原(Collagen I)、转化生长因子β1(TGF-β1)、血管内皮生长因子(VEGF)mRNA的表达
细胞总RNA抽提按Trizol试剂盒的方法进行,运用RT-PCR试剂盒(德国Qiagen)检测,反转录50℃20 min,E-cadherin 引物序列:正义链5′-ACCCCTGTTGGTGTCTTT-3′, 反义链 5′-TTCGGGCTTGTTGTCATTCT-3′。α-SMA 引物序列 :正义链 5′-GCTCTGTAAGGCGGGCTTTG-3′; 反义链5′-ACGAAGGAATAGCCACGCTCA-3′。CollagenI引物序列:正义链 5′-GGTAACGATGGTGCTGTCGG-3′, 反义链 5′-GGGACCTTGAACTCCAGCAG-3′。TGF-β1引物序列:正义链5′-CGAGGTGACCTGGGCACCATCC-3′,反义链 5′-CTGTGCTATTGCCTTGTC-3′。VEGF 引物序列:正义链 5′-TTACTGCTGTACCTCCAC-3′, 反义链5′-ACAGGACGGCTTGAAGATA-3′。 GAPDH 引物 序列:正义链 5′-TGAACGGGAAGCTCACTGG-3′, 反义链 5′-TCCACCACCCTGTTGCTGTA-3′。 HotStarTaq DNA多聚酶激活95℃15 min,E-cadherin反应条件:94℃变性30s,55℃退火30s,72℃延伸45 s,35个连续循环;-SMA反应条件:94℃变性30s,57℃退火30s,72℃延伸45 s,28个连续循环;CollagenI反应条件:94℃变性30s,57℃退火30s,72℃延伸45 s,29个连续循环。TGF-β1反应条件:94℃变性30s,55℃退火30s,72℃延伸45 s,35个连续循环。VEGF反应条件:94℃变性30s,55℃退火30s,72℃延伸45 s,40个连续循环。得出Ct值按公式2-△△Ct求出基因表达的相对变化量,然后进行各组间比较。
1.5 Western印迹法检测E-cadherin、α-SMA蛋白的表达
裂解处理后的大鼠腹膜间皮细胞,4℃1000 r/min离心10 min后取裂解液上清测蛋白浓度,取细胞裂解蛋白(约 30 μg)经 SDS-PAGE凝胶电泳后电转移至PVDF膜,5%脱脂奶粉封闭2 h,分别加入小鼠抗E-cadherin抗体(美国BD)、小鼠抗α-SMA抗体(丹麦,Dako)和小鼠抗β-actin抗体(美国CST)4℃过夜,洗膜后加辣根过氧化酶标记的大鼠抗小鼠IgG抗体(美国CST),37℃1.5 h,洗膜后加ECL试剂,X线自显影显示结果,分析光带的吸光度。
1.6 ELISA法测定细胞培养液中TGF-β1和VEGF
大鼠腹膜间皮细胞分组干预48 h和72 h后,离心收集细胞上清液,按ELISA试剂盒说明检测TGF-β1和VEGF蛋白水平。
2 结 果
2.1 RT-PCR检测E-cadherin 、α-SMA 、CollagenI、TGF-β、VEGF mRNA 表达结果
BMP-7作用48 h后,上皮-间叶转化的大鼠腹膜间皮细胞E-cadherin mRNA表达水平增加(图 1),而 α-SMA 、Collagen I、TGF-β、VEGF mRNA表达水平下降(图2~图5)。与对照组相比,具有统计学意义(P<0.05)。

图1 各组间皮细胞E-cadherin mRNA的相对表达量

图2 各组间皮细胞α-SMA mRNA的相对表达量
2.2 Western印迹测定E-cadherin、α-SMA 表达结果
BMP-7作用48 h后,上皮-间叶转化的大鼠腹膜间皮细胞E-cadherin蛋白表达水平增加(图6),而α-SMA蛋白表达水平下降(图7)。与对照组相比,差异具有统计学意义(P<0.05)。

图3 各组间皮细胞CollagenI mRNA的相对表达量

图4 各组间皮细胞TGF-β1 mRNA的相对表达量

图5 各组间皮细胞VEGF mRNA相对表达量

图6 各组间皮细胞E-cadherin蛋白的相对表达量
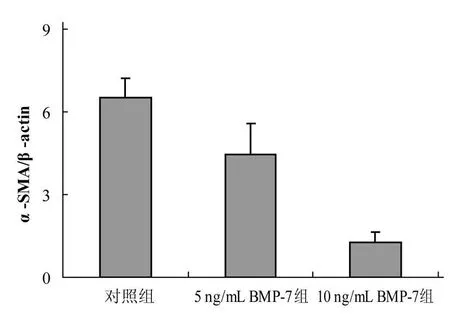
图7 各组间皮细胞α-SMA蛋白的相对表达量
2.3 ELISA 法测定TGF-β、VEGF蛋白表达水平
BMP-7作用48 h后,上皮-间叶转化的大鼠腹膜间皮细胞TGF-β、VEGF蛋白表达水平下降(图8~图9),与对照组相比,具有统计学意义(P<0.05)。

图8 各组间皮细胞TGF-β1蛋白的表达水平

图9 各组间皮细胞VEGF蛋白的表达水平
3 讨 论
腹膜透析是终末期肾功能衰竭的主要治疗方法之一,已进入临床30余年,随着其装置的不断改进,在我国越来越多慢性肾衰患者开始肾替代治疗时首选腹膜透析疗法。但是随着腹膜透析时间延长,由于非生理性透析液尤其是高浓度葡萄糖、葡萄糖降解产物、晚期糖基化终产物等可引起腹膜结构改变和腹膜功能衰竭,临床上出现超滤失败[6]。这是患者退出腹膜透析的主要原因之一,同时也制约了腹膜透析的应用和发展[7]。长期腹膜透析患者腹膜出现表层间皮细胞消失、大量新生血管形成及透明样血管病变、纤维化等病理改变,腹膜纤维化和大量新生血管形成是导致腹膜功能衰竭的主要原因。最近的研究[1-3,8-9]发现,随着腹膜透析的进行,腹膜透析患者腹膜间皮细胞逐渐丧失上皮细胞表型,同时获得肌纤维母细胞样的特性,即发生上皮-间叶转化。越来越多的证据表明[1,10],腹膜透析患者腹膜组织中肌纤维母细胞明显增多,这种细胞具有合成细胞外基质、细胞因子、生长因子及参与炎症反应的能力等特性,在各种修复及纤维化过程中起重要作用。研究[11-13]证明上皮-间叶转化在肾、肝、肺等器官纤维化中有重要的作用,本研究先前表明:高浓度葡萄糖能和晚期糖基化终产物诱导大鼠腹膜间皮细胞上皮-间叶转化[5,14],这种发生上皮-间叶转化上调了 TGF-β、VEGF 的表达,而 TGF-β、VEGF在腹膜透析时腹膜纤维化和腹膜新生血管形成过程中起重要作用,提示间皮细胞上皮-间叶转化可能是导致腹膜透析时腹膜纤维化和新生血管形成的关键环节。因而寻求防治间皮细胞上皮-间叶转化的有效方法,具有重要的临床意义。
本研究中探讨BMP-7对晚期糖基化终产物诱导大鼠腹膜间皮细胞上皮-间叶转化的影响。体外研究发现:BMP-7能上调上皮-间叶转化的大鼠腹膜间皮细胞E-cadherin表达和下调α-SMA、Collagen I表达,表明BMP-7能逆转晚期糖基化终产物诱导大鼠腹膜间皮细胞EMT。同时本研究还发现BMP-7能下调TGF-β、VEGF表达,而 TGF-β、VEGF在腹膜纤维化和腹膜新生血管形成过程中起重要作用。表明BMP-7可能具有防治腹膜透析时腹膜纤维化和腹膜新生血管形成作用。本研究结果为进一步探讨防治腹膜透析时腹膜功能衰竭的有效方法提供依据。
[1]Devuyst O,Margetts P J,Topley N.The pathophysiology of the peritoneal membrane[J].J Am Soc Nephrol,2010,21(7):1077.
[2]Vargha R,Endemann M,Kratochwill K.Ex vivo reversal of in vivo transdifferentiation in mesothelial cells grown from peritoneal dialysate effluents[J].Nephrol Dial Transplant,2006,21(10):2943.
[3]Aroeira L S,Aguilera A,Sánchez-Tomero J A,et al.Epithelial to Mesenchymal Transition and Peritoneal Membrane Failure in Peritoneal Dialysis Patients:Pathologic Significance and Potential Therapeutic Interventions[J].J Am Soc Nephrol,2007,18(7):2004.
[4]Yanez-Mo M,Lara-Pezzi E,Selgas R,et al.Peritoneal dialysis and epithelial-to-mesenchymal transition of mesothelial cells[J].N Engl J Med,2003,348(5):403.
[5]邵维斌,彭淑娟,夏春英,等.晚期糖基化终产物诱导大鼠腹膜间皮细胞上皮-间叶转化[J].实用临床医药杂志,2011,15(19):25.
[6]Brimble K S,Walker M,Margetts P J,et al.Meta-Analysis:Peritoneal Membrane Transport,Mortality,and Technique Failure in Peritoneal Dialysis[J].J Am Soc Nephrol,2006,17(9):2591.
[7]Gokal R.Peritoneal dialysis in the 21st century:an analysis of current problems and future developments[J].J Am Soc Nephrol,2002,13(Suppl 1):S104.
[8]Aroeira L S,Aguilera A,Selgas R,et al.M esenchymal con-version of mesothelial cells as a mechanism responsible for high solute transport rate in peritoneal dialysis:Role of vascularendothelialg rowth factor[J].Am J Kidney Dis,2005,46(5):938.
[9]Kim Y L.Update on mechanisms of ultrafiltration failure[J].Perit Dial Int,2009,29(Suppl 2):S123.
[10]Jimenez-Heffernan J A,Aguilera A,Aroeira L S,et al.Immunohistochemical characterization of fibroblast subpopulations in normal peritoneal tissue and in peritoneal dialysis-induced fibrosis[J].Virchows Arch,2004,444(19):247.
[11]Liu Y.New insights into epithelial-mesenchymal transition in kidney fibrosis[J].J Am Soc Nephrol,2010,21(2):212.
[12]Rippe B.Peritoneal angiogenesis in response to dialysis fluid[J].Contrib Nephrol,2009,163:60.
[13]Corvol H,Flamein F,Epaud R,et al.Lung alveolar epithelium and interstitial lung disease[J].Int J Biochem Cell Biol,2009,41(8-9):1643.
[14]邵维斌,荀康,李忻,等.高浓度葡萄糖诱导大鼠腹膜间皮细胞上皮-间叶转化[J].实用临床医药杂志,2010,14(17):4.
