辣椒素抑制胰腺癌裸鼠皮下移植瘤生长的实验研究
2012-11-06黄媛媛
黄媛媛
胰腺癌是一种恶性程度非常高的消化道肿瘤,早期诊断率低,中位生存期短[1,2]。吉西他滨作为晚期胰腺癌化疗的标准药物,在临床应用中疗效有限,根治术后辅助用药的中位生存时间仅为22.1个月[3,4]。同时有研究表明吉西他滨无明显抗胰腺癌转移的作用[5]。多药联合的化疗方案不但不能明显延长患者生存时间,而且增加了化疗的不良反应[6]。因此,这为临床上胰腺癌的治疗提出了严峻挑战:即寻求新的药物能有效抑制胰腺癌肿瘤生长从而更为有效治疗胰腺癌。传统中药在中国的基本医疗保健中占有重要地位,近年来,传统中药被广泛用于抗肿瘤的研究当中,是研发新的抗癌药物的热点[7]。辣椒素(capsaicin),其结构为反式8-甲基-N-香草基-丁-壬烯胺,是红辣椒中的一种活性成分。于1999年载入美国《药典》。研究表明,辣椒素可以通过抑制HeLa细胞增殖,有报道称辣椒素可以抑制前列腺癌裸鼠模型新生肿瘤的生长,另外Kim的研究发现辣椒素可以导致人结肠癌Ht-29细胞的凋亡[8~10]。然而辣椒素是否具有抑制胰腺癌细胞移植瘤增殖的效果目前尚不明了。
本实验在裸鼠移植瘤模型基础上研究辣椒素抑制胰腺癌肿瘤生长作用,探索其体内抗肿瘤的合适剂量,并探讨其分子机制。
材料与方法
1.药物和试剂:辣椒素(capsaicin,纯度>99%)购于美国Sigma公司,溶解于DMSO浓度<0.1%的生理盐水中。吉西他滨(gemcitabine)购于法国礼来公司,溶于生理盐水。Trizol试剂购于Invitrogen公司,cDNA第一链合成试剂盒购于Fermentas。兔抗人XIAP多克隆抗体购于美国Abcam公司,兔抗人NF-κB抗体购于美国Abcam公司。
2.细胞培养和实验动物:人胰腺癌细胞株BXPC-3购自美国组织培养库(ATCC)。细胞培养于37℃含5%CO2的培养箱中。使用添加有10%胎牛血清并100U/m l青霉素和100U/m l链霉素的DMEM培养基进行细胞培养,待贴壁生长至70%~80%时使用胰蛋白酶(GIBCO,USA)消化传代。6~8周龄BALB/c nu/nu雄性裸小鼠,体重20~22g,购于中国科学院上海实验动物中心。饲养于SPF屏障系统的洁净层流架内,室温控制在25±1℃,相对湿度40% ~60%。免疫缺陷裸鼠所用的食物、水、垫料均经过灭菌处理。
3.模型建造和实验方案:待细胞生长至对数期,用胰蛋白酶对其进行消化,用含10%胎牛血清的培养基进行中止消化并离心。离心后弃上清并用不含血清的1640培养基对细胞进行洗涤。再次离心后将细胞混匀于无血清的DMEM培养基中。将细胞悬液注射于裸鼠背部靠近后肢部位的皮下,每只注射约5×106个细胞。2周后,待肿瘤体积达到大约100mm3时,将裸鼠随机分成4组,分别为对照组(N,生理盐水)、吉西他滨组(GEM,100mg/kg)、低剂量组(辣椒素,10mg/kg)和高剂量组(辣椒素20mg/kg),每组8只。分组当天开始腹腔注射给药,3天1次,共8次。末次用药1周后处死裸鼠。用药前称量裸鼠体重并测量肿瘤短径和长径a和b,处死裸鼠前称量裸鼠体重并肿瘤长短经。肿瘤体积计算公式按照v=π/6×a2×b,a为长径,b为短径[11]。末次用药1周后用1%戊巴比妥钠腹腔注射麻醉裸鼠,取肿瘤组织称重。取部分组织置于4%多聚甲醛固定,石蜡切片后做免疫组化染色。留取部分新鲜组织保存于液氮中做RT-PCR。
4.免疫组织化学染色法检测NF-κB、XIAP和Ki-67:免疫组织化学检测凋亡抑制蛋白XIAP,核转录因子NF-κB和细胞增殖因子Ki-67。对制备的各组标本进行连续切片,所得石蜡切片进行常规二甲苯脱蜡,梯度乙醇水化,0.3%H2O2封闭,微波抗原修复,滴加正常山羊血清封闭液,室温10min;兔抗人 XIAP抗体(稀释度1∶600),NF-κB抗体(稀释度1∶500),Ki-67抗体(1∶300)4℃孵育过夜,PBS 洗涤后滴加HRP标记的二抗37℃ 30min,DAB显色3~5min,冲洗后苏木素复染,流水冲洗返蓝后脱水封片镜检。
5.总RNA提取及RT-PCR:(1)RNA提取:每块标本称取50~100mg置于液氮冷却的研钵中,加液氮后进行研磨,在磨碎的标本中加入1m l Triol试剂继续研磨;将磨好的组织移入到1.5ml的去酶EP管中,颠倒混匀30下,室温5min;加氯仿0.2ml,颠倒混匀 30 下,室温 10min;4℃,离心 12000r/min,15min;转上层水相约(400μl)于另一1.5m l EP管中,加等体积异丙醇,混匀,室温 10min;4℃,离心 12000r/min,10min,可见胶样物质于管壁;移去上清,加入预冷的DEPC水配制75%乙醇1ml,震荡后4℃离心7500r/min,5min;弃上清,超净台风机干燥10min,溶于20μl DEPC水中;紫外分光光度计测定RNA含量,并测定A260/A280值判断RNA质量。(2)cDNA合成:按照说明书的步骤,向经核酸酶处理的离心管中,依次加入:①总RNA 5μg;②随机引物1μl;③去除核酸酶的水,使总体积达到12μl;④5×反应缓冲液4μl;⑤RibolockTMRNase抑制剂(20U/μl)1μl;⑥10mmol/L dNTP 混合物 2μl;⑦RevertAidTMM-MuLV反转录酶(200U/μl)1μl。最终配成总体积为20μl的反应体系。然后将液体轻轻混匀后离心。按下面的温度和时间条件进行孵育:25℃ 5min,42℃ 60min,70℃5min。将所得产物直接扩增或置于-20℃短期保存。(3)引物:NF-κB和XIAP引物设计和合成均由上海捷瑞公司提供。所有引物序列和产物大小如表1所示。(4)PCR扩增:向每个PCR反应管中依次加入:模板RNA1μl;上下游引物(浓度为10μmol/L)各1μl,所用引物序列如表1所示;2×Master Mix 12.5μl,然后加 ddH2O 10.5μl。将混合物混匀后离心,置于Biorad(美国)扩增仪中进行扩增。取5μl扩增产物置于0.5%琼脂糖凝胶电泳并成像。
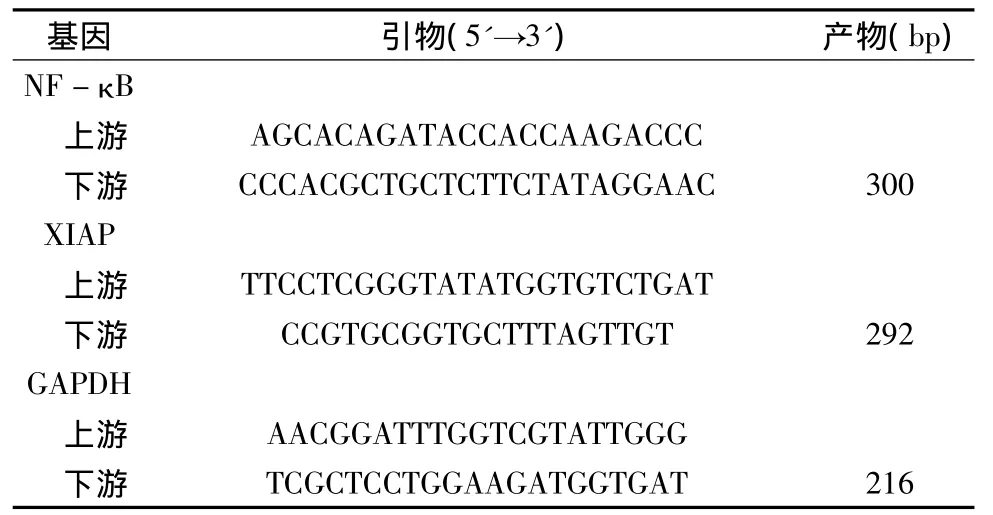
表1 RT-PCR所用的引物序列
6.统计学方法:应用Gel Pro3.2软件分析PCR电泳图像,应用 IPP(image-pro Plus 6.0,media cybernetics,silver spring,MD)软件分析免疫组化图片。实验数据采用均数±标准差(x±s)。所有数据采用SPSS 17.0软件ANOVA单因素方差分析,组与组之间比较采用S-N-K检验,P<0.05为差异有统计学意义。
结 果
1.各组肿瘤体积和裸鼠质量的变化:裸鼠随机分组当天各组的肿瘤平均体积为123.3±7.6mm3,各组裸鼠平均体重为21.6±1.1g,差异均无统计学意义。末次用药后1周,对照组瘤体平均体积为578.7±91.2mm3;低剂量辣椒素组的瘤体平均体积为375.8±35.2mm3,吉西他滨组的瘤体平均体积为344.3±22.5mm3,高剂量辣椒素组的瘤体平均体积为244.9±32.5mm3。与对照组相比,低剂量辣椒素组与吉西他滨组的瘤体平均体积均明显小于对照组 (P<0.05),但高剂量辣椒素抑制肿瘤的作用更为明显,与其他各组相比,差异均有统计学意义(P<0.05)。
2.辣椒素降低 NF-κB、XIAP和 Ki-67的表达量:应用IPP软件对免疫组化图片进行分析,各组肿瘤组织中NF-κB和P-gp蛋白的表达量以累积光密度值的形式表示。各组累积光密度值为:NF-κB,N 组(6634±372),G 组(7123±271),L-CAP组(5322±79),H-CAP组(3883±126),与对照组和吉西他滨组相比,低剂量和高剂量辣椒素组可显著下调NF-κB的表达量,差异有统计学意义(P<0.05)。XIAP,N 组(3887±337),GEM组(4347±67),L-CAP组(3122±121),H -CAP组(1215±106),与其他各组相比,低剂量和高剂量辣椒素组可显著下调XIAP的表达量,差异均有统计学意义(P<0.05)。各组中Ki-67表达量的变化(图1):在400倍光镜下随机选择10个视野,Ki-67增殖指数按以下公式计算:Ki-67阳性细胞数/细胞总数×100%。结果显示:与对照组相比(63.0±3.2),低剂量辣椒素组 Ki-67 表达量(44.0 ±2.6)显著下降(P <0.05);H -CAP组(21.0±1.2)与GEM组(35.0±1.4)相比,差异有统计学意义(P<0.05)。高剂量辣椒素抑制细胞增殖因子Ki-67的表达的效果更显著,与其他各组比较,差异有统计学意义(P <0.05)。
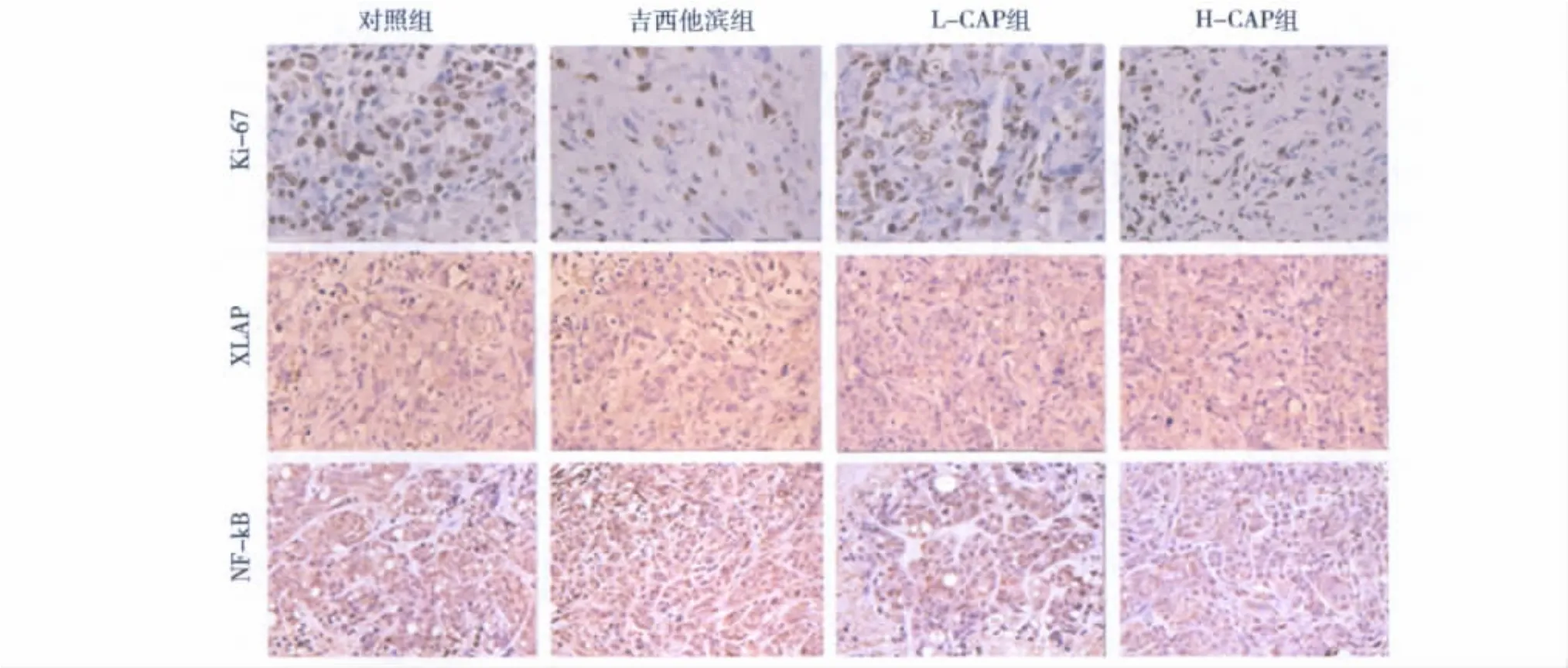
图1 免疫组化法检测各组裸鼠瘤体中NF-κB、XIAP和K i-67的表达(×400)
3.辣椒素对NF-κB和XIAPmRNA的表达的影响:辣椒素可以显著下调NF-κB和XIAPmRNA的表达量(图2)。与其他各组相比,低剂量和高剂量辣椒素组NF-κB mRNA的表达量显著下降,差异均有统计学意义(P<0.05);与其他两组相比低剂量和高剂量辣椒素组XIAPmRNA的表达量显著下降,差异均有统计学意义(P<0.05)。
讨 论
核转录因子NF-κB是一种重要的生物分子,它参与细胞的多种生理病理过程,包括免疫反应、免疫耐受、炎症反应、细胞增殖以及细胞凋亡、肿瘤形成等[12]。因此,一些以NF-κB为分子靶点的抗肿瘤研究取得了一定的进展,Patel等[13]报道辣椒素可以通过抑制NF-κB的活性减少恶性黑色素瘤的增殖。本课题在前人应用辣椒素抗癌的研究的基础上,探讨辣椒素对胰腺癌的抗肿瘤作用,研究结果显示,在基因和蛋白水平,对照组和吉西他滨组NF-κB均呈高表达,而低剂量和高剂量辣椒素组,其表达量均下降。辣椒素可以抑制NF-κBmRNA和蛋白的表达,导致核转录因子NF-κB表达量下降。
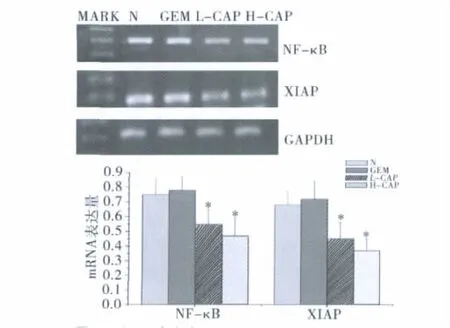
图2 各组肿瘤中NF-κB和XIAPm RNA的表达量的变化
细胞凋亡是细胞的程序性死亡,肿瘤细胞中凋亡抑制蛋白的过量表达是其恶性增殖的原因之一,当某种因素引起细胞的凋亡紊乱时就会发生肿瘤。介导细胞的凋亡的信号通路有两种:线粒体通路和死亡受体通路,而胱天蛋白酶家族(caspases)是贯穿于这两条通路的关键分子,他们在细胞凋亡过程中发挥重要的作用。XIAP就是一种凋亡抑制蛋白,它可以通过直接与 caspase-3、caspase-7和 caspase-9结合,从而抑制细胞凋亡[14]。研究表明,NF-κB和XIAP的高表达是肿瘤产生耐药的原因之一,通过降低二者的表达量可以有效逆转肿瘤的耐药性,从而增强化疗效果[15]。在吉西他滨化疗后,胰腺癌组织中 NF-κB和XIAP的表达量均增高,而通过联合中药大黄素后下调二者的表达量可以增强吉西他滨的化疗效果[15]。另有报道称通过下调NF-κB的表达量和抑制其转录活性可以抑制mdr1基因的表达,最终使P-gp的表达量和功能下降,从而达到逆转乳腺癌细胞系MCF-7的化疗耐药。本课题研究结果显示,对照组和吉西他滨组NF-κB和XIAP均呈高表达,而低剂量和高剂量辣椒素组表达量显著下降。辣椒素(capsaicin,反式8-甲基 -N-香草基 -丁 -壬烯胺),作为食物和传统药物已有几千年的历史。裸鼠移植瘤动物模型研究显示,高剂量辣椒素的肿瘤抑制作用明显高于吉西他滨组和低剂量组。此现象提示,在体内实验中,辣椒素具有确切的抗肿瘤效果,高剂量辣椒素(20mg/kg)的抗肿瘤效果优于低剂量辣椒素(10mg/kg),其差异具有统计学意义(P<0.05)。
总之,辣椒素具有抑制胰腺癌细胞裸鼠移植瘤增长的作用,其机制是通过抑制核转录因子NF-κB的表达,从而下调凋亡抑制蛋白XIAP的表达来实现的。
1 Lillemoe KD.Currentmanagementofbile duct injury[J].Br JSurg,2008,95(4):403-405
2 Rivera F,Lopez-Tarruella S,Vega-VillegasME,et al.Treatment of advanced pancreatic cancer:from gemcitabine single agent to combinations and targeted therapy[J].Cancer Treat Rev,2009,35(4):335-339
3 Tempero MA,Behrman S,Ben-Josef E,etal.Pancreatic adenocarcinoma:Clinical Practice Guidelines in Oncology[J].JNatl Compr Canc Netw,2005,3(5):598-626
4 Oettle H,Post S,Neuhaus P,et al.Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer:a randomized controlled trial[J].JAMA,2007,297(3):267-277
5 贾林,袁世珍.细胞毒药物(Gemcitabine)治疗人胰腺癌裸鼠胰腺原位移植癌的实验研究[J].中华肝胆外科杂志,2002,8(9):557-559
6 Kralidis E,Aebi S,Friess H,et al.A phase II study of raltitrexed and gemcitabine in patientswith advanced pancreatic carcinoma[J].Br JCancer,2005,92(3):445-448
7 Li-Weber M.Targeting apoptosis pathways in cancer by Chinese medicine[J].Cancer Lett,doi:10.1016/j.canlet.2010.07.015
8 del Castillo- Olivares A,Yantiri F,Chueh PJ,et al.A drug- responsive and protease-resistant peripheral NADH oxidase complex from the surface of HeLa S cells[J].Arch Biochem Biophys,1998,358(1):125-140
9 Mori A,Lehmann S,O'Kelly J,etal.Capsaicin,a componentof red peppers,inhibits the growth of androgen - independent,p53 mutant prostate cancer cells[J].Cancer Res,2006,66(6):3222 -3229
10 Chu -SK,Won HP,Jun YP,et al.Capsaicin,a spicy component of hot pepper,induces apoptosis by activation of the peroxisome proliferator-activated receptor gamma in HT-29 human colon cancer cells[J].JMed Food,2004,7(3):267-273
11 Kong R,Sun B,Jiang H,et al.Downregulation of nuclear factorkappaB p65 subunit by small interfering RNA synergizes with gemcitabine to inhibit the growth of pancreatic cancer[J].Cancer Lett,2010,291(1):90-98
12 Neumann M,Naumann M.Beyond IkappaBs:alternative regulation of NF-kappaB activity[J].FASEB J,2007,21(11):2642-2654
13 Patel PS,Yang S,Li A,et al.Capsaicin regulates vascular endothelial cell growth factor expression by modulation of hypoxia inducing factor-1alpha in humanmalignantmelanoma cells[J].JCancer Res Clin Oncol,2002,128(9):461 -468
14 Shiozaki EN,Shi Y.Caspases,IAPs and Smac/DIABLO:mechanisms from structural biology [J].Trends Biochem Sci,2004,29(9):486-494
15 Wang ZH,Chen H,Guo HC,et al.Enhanced antitumor efficacy by the combination of emodin and gemcitabine against human pancreatic cancer cells via downregulation of the expression of XIAP in vitro and in vivo[J].Int JOncol,2011,39(5):1123 -1131
