Jurkat细胞Kv1.3钾通道的基本电生理学特性及动力学特征
2012-11-06代中华谭晓秋程秀丽曹济民
代中华 谭晓秋 闫 莉 程秀丽 祝 红 郝 维 曹济民
Kv1.3通道属于电压门控钾离子通道Shaker家族成员之一,其主要功能是参与细胞膜的复极化过程,在可兴奋细胞中维持细胞的兴奋性,同时也参与了非可兴奋细胞的生理功能调节,例如调节T淋巴细胞增殖和凋亡[1,2]。Kv1.3 通道在 T 淋巴细胞以及 T淋巴细胞性白血病细胞系(例如Jurkat细胞)上也广泛分布。淋巴细胞的离子通道活动与其免疫功能的关系近年来受到了免疫学界的关注[3,4]。由于淋巴细胞悬浮生长且体积较小,记录其通道电流有相当的技术难度,这给淋巴细胞电生理学研究带来了一定困难,从而影响了这一领域的进展。本工作通过技术改进,以Jurkat细胞为模型,通过调整细胞电极内液成分和选择使用特异性的通道阻断剂来改进电流记录方法,从而得到纯净、稳定的Kv1.3通道电流,并且对其基本特性和动力学进行了初步研究。
材料与方法
1.细胞株和试剂:Jurkat E6-1细胞系购自北京协和医学院基础学院细胞中心。Kv1.3通道的特异性阻断剂stichodactyla向日葵神经毒素(stichodactyla helianthus neurotoxi,ShK)购自Bechem公司,TRAM-34(1-[(2-cholrophenyl)dephenylmethyl]-1H-pyrazole)购自Sigma公司。其他试剂均为国产分析纯。
2.细胞处理:选择生长状态和细胞膜折光性良好的Jurkat E6-1细胞,用0.05%胰蛋白酶处理3min,加入胎牛血清(FBS)终止消化,1000r/min离心5min。弃上清液,加入浴液吹散细胞。取适量的细胞至浴槽中,等待5~10min细胞沉降至浴槽底,进行下一步实验。
3.全细胞记录:毛细玻璃管购自 Sutter Instrument公司。采用微管电极拉制仪(P-97,Sutter Instrument)进行玻璃微电极拉制,电极在灌充电极液后入液电阻为5~7MΩ。电流信号经膜片钳放大器(EPC-10,德国 HEKA公司)放大,2kHz低通滤波,经12位A/D-D/A转换器转换后在专用软件系统Patchmaster记录并储存于计算机硬盘内。采样频率为10kHz,适当补偿串阻后的入口阻抗≤10MΩ。全细胞记录采用负压破膜方式进行。浴液组成:NaCl 150mmol/L,KCl 5mmol/L,CaCl22.5mmol/L,MgCl21mmol/L,葡萄糖 10mmol/L,4-羟乙基哌嗪乙磺酸(HEPES)10mmol/L,pH 7.4。电极液成分:天冬氨酸钾(aspartic acid potassium)130mmol/L,MgCl25mmol/L,HEPES 10mmol/L,pH 7.2。另配制100mmol/L 乙二醇双(2-氨基乙基醚)四乙酸(EGTA)备用。
4.统计学方法:数据采用均数±标准差(x±s)表示,膜片钳数据分析采用Clampfit 10.1软件进行分析,图像处理采用OriginPro 8.0 软件,数据统计采用 SPSS 10.0 进行,P <0.05为差异有统计学意义。
结 果
1.Kv1.3通道的电流记录:本实验采用全细胞记录模式,保持钳制电位于-80mV,接近Jurkat细胞的静息电位。结果显示,当电极内液为上述成分(不含EGTA)时,记录到的电流具有明显的电压依赖性,电流幅度随着去极化电压的增加而增大(图1A)。通道被激活后电流在短时间内达到最大值后会持续开放,且开放时间较长,无明显失活(图1A)。该电流是一个混合电流,可能有钙激活钾通道电流的掺入。为了获得较为纯净的Kv1.3电流,笔者向电极内液中加入EGTA(5mmol/L)已去除电流的钙离子依赖成分,采用同样的方式记录全细胞电流。得到的钾电流同样具有电压依赖性,但电流在达到最大值后会形成一个峰电流,呈现较慢的失活,并且通道开放时间也较长(图1B,对照)。在浴液中加入Kv1.3特异性阻断剂ShK(100pmol/L)后,电流被抑制,证明记录到的电流为Kv1.3通道电流(图1B,ShK)。
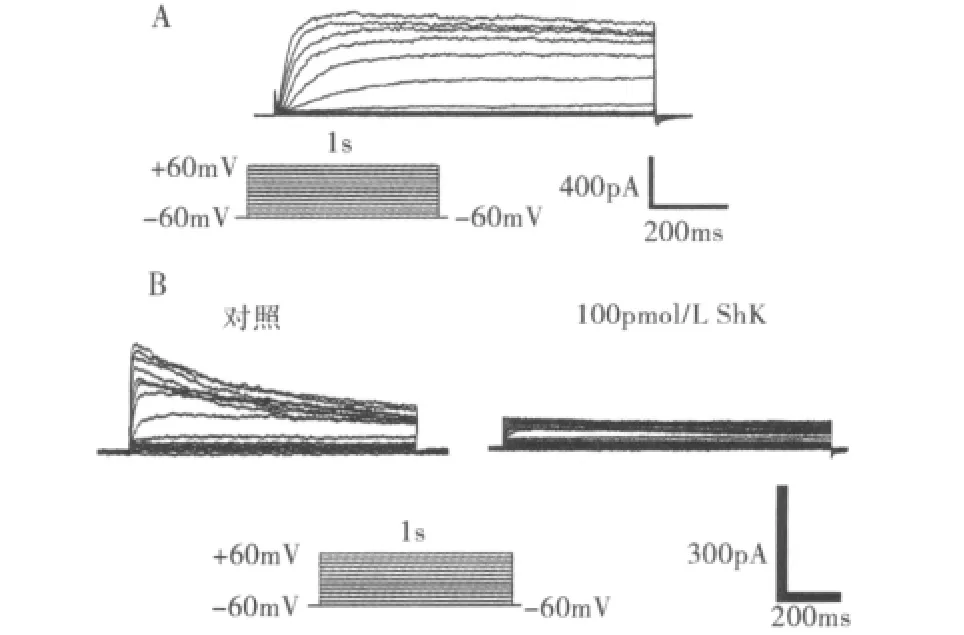
图1 用全细胞模式记录的Jurkat细胞Kv1.3通道电流
为进一步鉴定复合电流中掺杂电流的成分,在浴液中加入Kv1.3通道特异性抑制剂ShK(100pmol/L)并采用不含EGTA的电极内液,记录到的电流如图2A所示。再向浴液中加入中等电导钙激活钾通道KCa1.3的特异性阻断剂芳基甲烷-34(triarylmethane-34,TRAM-34)(20nmol/L)后电流被抑制(图2B),表明所掺杂的电流为KCa1.3。
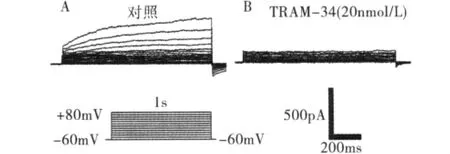
图2 Jurkat细胞Kv1.3电流的鉴别
2.Jurkat细胞Kv1.3通道的动力学特性分析:为进一步了解Kv1.3通道的动力学特性,分别绘制了Kv1.3通道的失活曲线和恢复(复活)曲线。制作失活曲线时,将膜电位钳制在-80mV持续12.5s,再给予一个-70~+60mV的步阶电压刺激,持续5s,然后给予+40mV的测试电压,以记录通道的失活情况,最后再将膜电位钳制在-80mV持续12.5s。制作复活曲线时,将膜电位钳制在-80mV持续5s后,给予+40mV的刺激电压持续5s,然后将膜电位钳制在-80mv持续不同的时间{持续时间t随着步阶n而逐渐延长,t1=20ms,t2=40ms,tn=[20+20 ×1.5(n-2)]ms,3≤n≤20},再给予 +40mV 的测试电压持续1s记录通道恢复情况,最后将膜电位钳制在80mV持续至100ms(图3)。
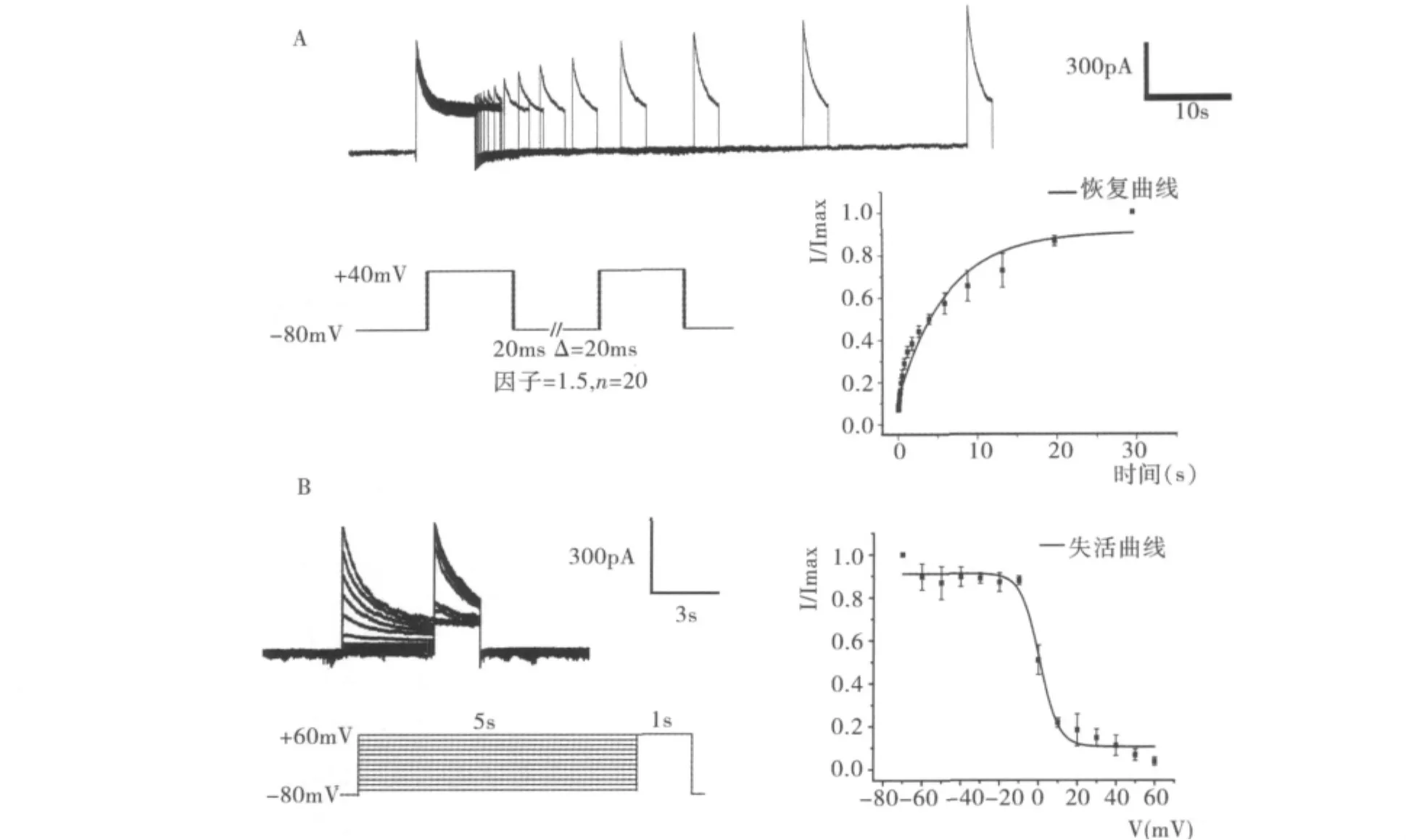
图3 Jurkat细胞Kv1.3通道的动力学特性
为进一步了解Kv1.3通道特性,同时计算了τact和 τin,其中 τin=622.49 ± 93.90ms,τact=6.47 ±2.44ms。结果表明,Jurkat细胞的Kv1.3通道具有快速激活(毫秒级)、缓慢失活(数百毫秒级)和缓慢复活(秒级,τrec=6.14s)的动力学特征。
讨 论
钾离子通道在维持T淋巴细胞的生理功能方面发挥着重要的作用,而Kv1.3通道为T淋巴细胞上主要的钾通道,它参与了细胞膜复极化、胞内钙信号的调节、T淋巴细胞活化和细胞凋亡等一系列重要的生理过程[5]。Kv1.3 通道激活阈值为 -60mV,在-10 ~0mV 时达到稳态,单通道电导为10 ~12pS[6]。已有文献报道,Kv1.3通道已经成为治疗自身免疫性疾病(如多发性硬化、银屑病、1型糖尿病等)的靶点。此外,Kv1.3在T淋巴细胞免疫突触形成以及维持其钙离子浓度的稳定方面发挥着重要的作用[7]。因此,记录到稳定、纯净的电流是研究淋巴细胞电生理学特性的前提和基础。此外,Jurkat细胞是T淋巴细胞性白血病细胞系,其离子通道的变化目前所知甚少,本工作的目的之一是初步观察Jurkat细胞Kv1.3通道的功能特征。
鉴于Jurkat细胞体积较小,开展全细胞记录有技术困难的原因,笔者在试验中将玻璃微电极的尖端拉得较细。若电极尖端口径过大(电极入液电阻在4 MΩ左右),会在负压吸引时对细胞造成较大的机械性损伤,甚至使细胞变形、死亡,或将细胞吸入到玻璃微电极中。若电极尖端口径较小(电极入液电阻在12MΩ以上),在电极贴附细胞后进行负压吸引,虽然很容易形成高阻抗封接,但之后进一步给予负压进行破膜却比较困难,即使破膜以后也容易自行封闭从而使串阻过大影响记录结果。经过多次尝试,我们发现玻璃微电极在注满电极内液后入液电阻在5~7MΩ时为最佳的尖端口径,其兼顾了高阻抗封接以及封接后的负压破膜两方面的成功率。
电极内液成分对通道电流的记录结果具有显著的影响。电极内液中EGTA的有无直接关系到Kv1.3电流的记录结果。因为虽然电极内液的成分配方中不含Ca2+,但配方中其他的盐成分中含有微量的Ca2+,并且若盛装去离子水的容器选择不当(如选用软质玻璃容器),容器壁中的离子也会渗入到去离子水中,其中也包括Ca2+,以上两种情况使电极内液中掺杂的Ca2+浓度足以激活细胞中的其他通道(如钙激活钾通道)从而使记录结果为复合电流,不能记录到纯净的Kv1.3电流。经反复验证,复合电流中的掺杂电流具有钙依赖性并能够被KCa3.1特异性阻断剂TRAM-34阻断,因此可认定为掺杂电流主要为KCa3.1电流。为了剔除KCa3.1,需在电极内液中加入EGTA(5mmol/L)来螯合Ca2+,从而真正达到电极内液无钙状态,才能记录到单一的Kv1.3电流,同时结果也经过了特异性阻断剂ShK的验证。
经通道动力学分析得知,Kv1.3通道表现出快速激活(τact=6.47 ±2.44ms)、缓慢失活(τin=622.49 ±93.90ms)和缓慢复活(τrec=6.141s)的特性,这也为实验中刺激方案的设计提供了依据。值得注意的是,与其他通道相比,Kv1.3通道复活时间较长,完全复活需要25s,如此长的恢复时间可能与通道功能相关且少见有文献报道。
本文仅描述了Jurkat细胞Kv1.3通道电流的记录心得和动力学特征,并不代表正常T淋巴细胞Kv1.3通道的情况,读者在借鉴本文时应注意。
1 Qiu M,Campbell T,Breit S.A potassiuMion channel is involved in cytokine production[J].Clin Exp Immuonl,2002,130(1):67 - 74
2 Ohya S,Niwa S,Yanagi A,et al.Involvement of dominant-negative spliced variants of the intermediate conductance Ca2+-activated K+channel,K(Ca)3.1,in immune function of lymphoid cells[J].Biol Chem,2011,286(19):16940-16952
3 Fabian B,Peter G,Barbara R,et al.Biomedical nanoparticlesmodulate specific CD4+T cell stimulation by inhibition of antigen processing in dendritc cells[J].Nanotoxicology,2011,5(4):606 -621
4 George CK,Heike W,Christime B,et al.K+channels as targets for specific immunomodulation[J].Trends Pharmacol Sci,2004,25(5):280-289
5 Lina H,Michael P,Qiong J,et al.Characterization of the functional properties of the voltage- gated potassium channel Kv1.3 in human CD4+T lymphocytes[J].Immunol,2010,179(7):4563 -4570
6 李桂阳,王焱.动脉粥样硬化、T淋巴细胞、Kv1.3通道三者相关性的研究进展[J].使用 心脑肺血管病杂志,2010,5(18):680-682
7 Stella A,Lisa N,Ashleigh S,etal.Localization of Kv1.3 channels in the immunological synapse modulates the calcium response to antigen stimulation in T lymphocytes[J].Immunol,2009,183(10):6296 -6302
