HPLC法测定盐酸吉西他滨的有关物质
2012-11-04赵军军李孝壁马平平孔双华杨宝海王春玲
赵军军 李孝壁 马平平 孔双华 杨宝海 王春玲
江苏豪森医药研究院有限公司,江苏连云港 222000
HPLC法测定盐酸吉西他滨的有关物质
赵军军 李孝壁 马平平 孔双华 杨宝海 王春玲
江苏豪森医药研究院有限公司,江苏连云港 222000
目的改进盐酸吉西他滨有关物质的测定方法。方法采用迪马 C8(250 mm×4.6 mm,5μm)色谱柱,梯度洗脱检查,流速为1.0 mL·min-1,检测波长275 nm。结果在0.005~2.402μg/mL范围线性关系良好,相关系数r>0.999(n=5),重复性试验的RSD<0.000 5%(n=6)。结论本方法简单、准确、重现性好,可用于盐酸吉西他滨的有关物质检查。
盐酸吉西他滨;有关物质;HPLC
盐酸吉西他滨(gemcitabine hydrochloride)化学名2-脱氧-2,2-盐酸二氟脱氧胞苷(β-异构体),是一种阿糖胞苷类似物,属于新型抗嘧啶核苷酸代谢化疗药物,属细胞周期特异性抗代谢类药物,主要作用于DNA合成期的肿瘤细胞,即S期细胞。在一定条件下,可以阻止G1期向S期的进展;具有抗瘤谱广、作用机制独特、毒性反应低、与其他化疗药物无交叉耐药且毒性反应无叠加等特点。在过去的临床工作中,笔者观察到盐酸吉西他滨是疗效较好而毒副反应较少的化疗药物之一[1-2]。有关物质直接反映药品的安全性,本研究采用高效液相色谱法[3-4]对有关物质[5-6]的检查进行了详细的研究。
1 仪器与试剂
仪器:电子分析天平,梅特勒XS105;Agilent 1200系列(G1311A四元泵,G1329A自动进样器,G1316A柱温箱,G1314B VWD,G1315D DAD);Agilent化学工作站;色谱柱:辛烷基硅烷键合硅胶为填充剂(迪马C8250 mm×4.6 mm,5μm)。
试剂:磷酸二氢钠(NaH2PO4·2H2O)、磷酸均为分析纯是国药集团化学试剂股份有限公司生产;纯化水由本公司生产;甲醇为色谱纯,德国MERCK公司生产。
2 试验过程与结果
2.1 色谱条件(表1)
照高效液相色谱法,用辛烷基硅烷键合硅胶为填充剂(迪马C8250 mm×4.6 mm,5μm);以磷酸二氢钠溶液(称取15.6 g磷酸二氢钠(NaH2PO4·2H2O)溶解在900 mL水里,加2.5 mL磷酸,加水稀释至1 000 mL,摇匀)作为流动相A,甲醇为流动相B;进行梯度洗脱;检测波长为275 nm;流速为每分钟1 mL。

表1 色谱条件
2.2 系统专属性试验
配制含有α-异构体的系统适用性溶液,作为溶液A,量取20 μL进样,RRT=0.7处能检测到α-异构体;称取盐酸吉西他滨(含有3’-盐酸吉西他滨差向异构体)配制成浓度为2 mg/mL的溶液,作为溶液B,量取20μL进样,在RRT=0.9处能检测到3’-盐酸吉西他滨差向异构体;称取胞嘧啶标准品配制成0.05 mg/mL的溶液,作为溶液C,量取20μL进样;精密称取盐酸吉西他滨标准品配制成1 mg/mL的溶液,置于90℃水浴中加热4 h,静置,冷却至室温,作为溶液D,量取20μL进样,在RRT=1.9处能检测到热降解杂质;精密称取盐酸吉西他滨标准品配制成1 mg/mL的溶液,移取2 mL至20 mL量瓶中,加入9 mL 30%双氧水,静置3 d,作为溶液E,量取20μL进样,在RRT=0.8处能检测到氧化杂质;溶液A 2 mL+溶液B 2 mL+溶液C 0.5 mL+溶液D 2 mL+溶液E 2 mL混合作为溶液F,精密量取溶液F 20μL进样,考察各杂质与吉西他滨的的分离情况。各杂质的分离情况见表2。专属性图见图1。
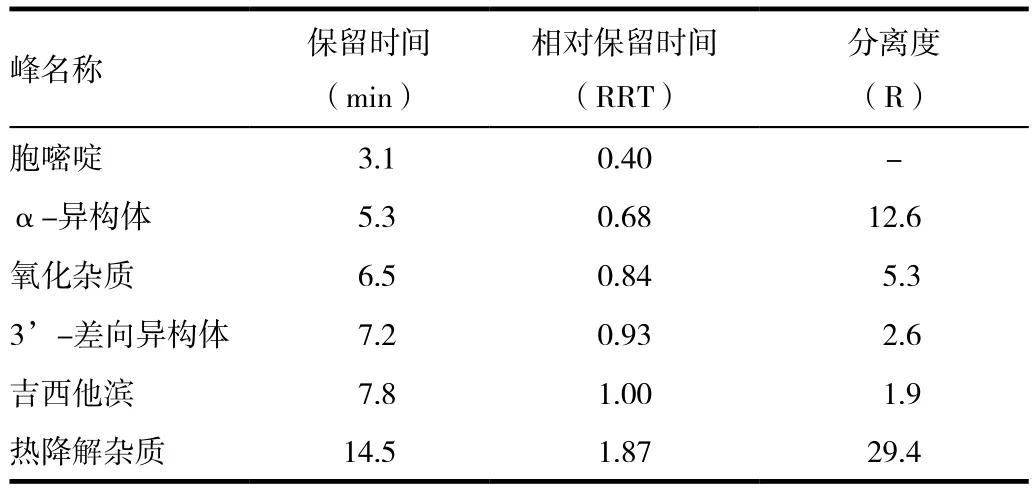
表2 方法专属性试验结果
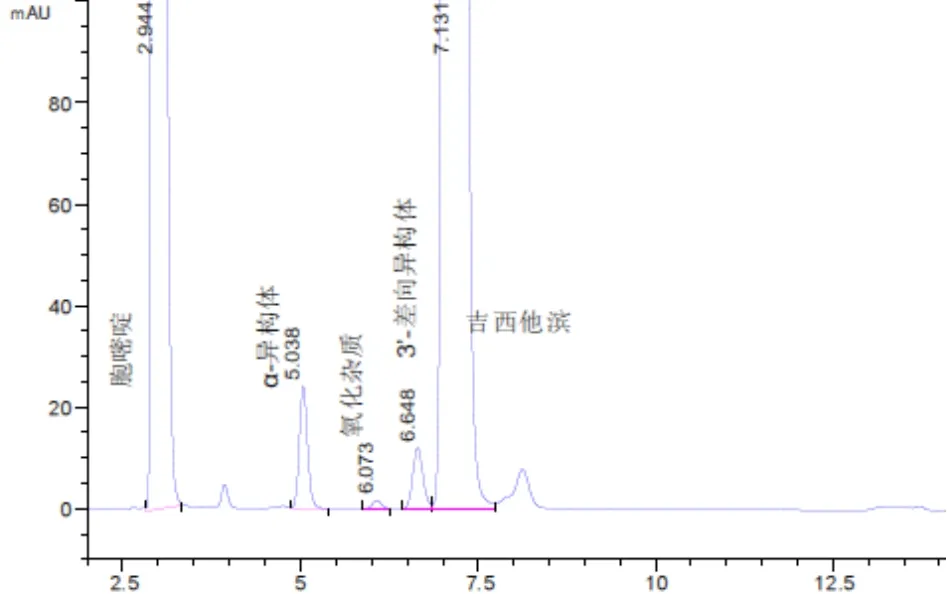
图1 方法专属性色谱图
2.3 定量限与检测限
分别配制每毫升中约含盐酸吉西他滨2 mg、胞嘧啶0.2 mg、α-异构体1 mg的溶液,逐步稀释,进样,至信噪比(S/N)为3左右为检测限,至信噪比为10左右为定量限; 配制每毫升中约含盐酸吉西他滨(含有3’-盐酸吉西他滨差向异构体)2 mg的溶液,进样至3’-盐酸吉西他滨差向异构体信噪比为3左右为检测限,至信噪比为10左右为定量限。见表3。

表3 检测限与定量限
2.4 线性关系试验
按照标准限度浓度配制线性试验溶液,胞嘧啶在0.005~2.402μg/mL,α- 异构体在 0.011~2.156μg/mL,3’-差向异构体在0.023~2.774μg/mL,测定结果线性相关系数皆不小于0.999,说明本方法线性良好。见表4。
2.5 重复性
精密称取盐酸吉西他滨样品50 mg,置于25 mL量瓶中,用水溶解并稀释到刻度,摇匀;平行6份,按照所确定的方法进行测定。见表5。

表4 线性关系
2.6 溶液稳定性
取盐酸吉西他滨适量,用水溶解并稀释制成每毫升约含2 mg的溶液。考察溶液在24 h的稳定性。见表6。
2.7 方法耐用性
按下表所列将缓冲溶液的pH值,缓冲溶液与甲醇比例,柱温,柱批次进行微小的变化,精密量取盐酸吉西他滨系统适用性溶液20μL进样,察看主峰的保留时间RT,计算理论塔板数N,拖尾因子T,盐酸吉西他滨和α-异构体的分离度R察看方法的耐用性。见表7。
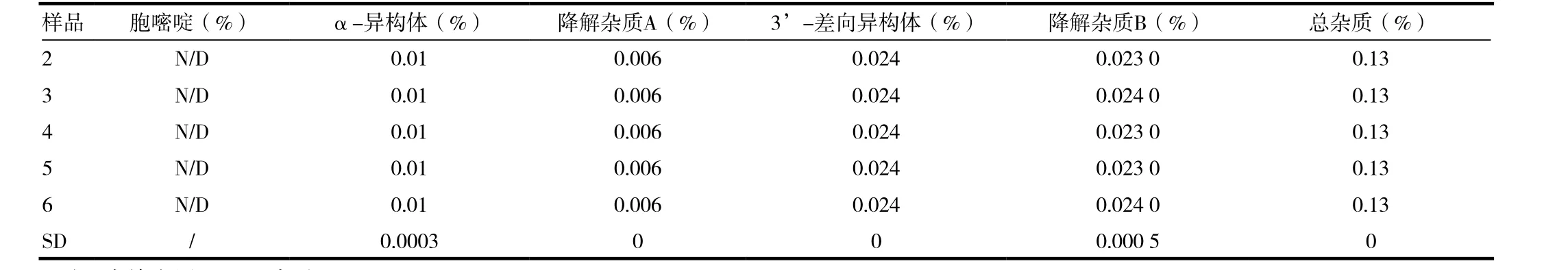
表5 重复性试验结果

表6 溶液稳定性试验结果
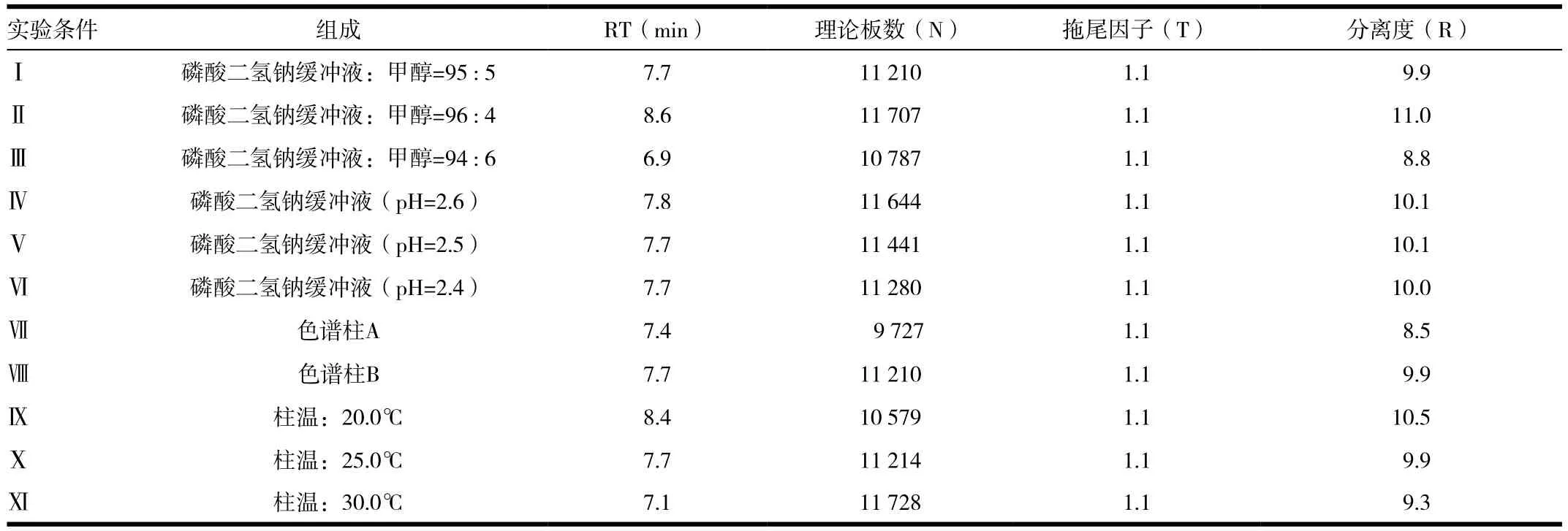
表7 方法耐用性
3 讨论
本研究建立了有关物质的测定方法,并通过对杂质的专属性、检测限、定量限、线性范围、重复性、溶液稳定性、方法耐用性等项目的考察,充分说明本研究确定的方法能有效准确地测定盐酸吉西他滨中可能存在的有关物质。
[1]李留树,王如良.非小细胞肺癌的治疗进展[J].解放军保健医学杂志,2011,3:199-200.
[2]陈新谦,金有豫,汤光.新编药物学[M].北京:人民卫生出版社,2004:675-676.
[3]刘文英.药物分析[M].北京:人民卫生出版社,2006:81-84.
[4]张数秀,曹志胜,惠秋莎.最新药品注册工作指南[M].北京:中国医药科技出版社,2007:64-70.
[5]国家药典委员会.中国药典二部附录[M].北京:化学工业出版社,2010:54.
[6]国家食品药品监督管理局.化学药物杂质研究技术指导原则//药品研究技术指导原则[S].北京:中国医药科技出版社,2010:155.
Determination of gemcitabine hydrochloride and its related substances by HPLC
ZHAO Junjun LI Xiaobi MA Pingping KONG Shuanghua YANG Baohai WANG Chunling
Jiangsu Hansoh Medicine Research Institute Co.,Ltd,Lianyungang 222000,China
ObjectiveTo improve the determination of related substances in gemcitabine hydrochloride.MethodsThe determination was carried out on a Dikma C8(250 mm×4.6 mm,5μm)column with gradient elution.The detection wavelength of UV detector was 275 nm.ResultsThere was a good linearity over the range of 0.005-2.402μg/mL with a the correlation coefficient higher than 0.999(n=5).The RSD for repeatition was less than 0.0005%(n=6).ConclusionThe method was simple,accurate and good reproducibility,which can be used for the determination of related substances for gemcitabine hydrochloride.
Gemcitabine hydrochloride;Related substances;HPLC
R-33
B
2095-0616(2012)18-106-03
2012-06-05)
