相似因子法评价氟康唑胶囊体外溶出度
2012-11-02丘文嘉姚美村
丘文嘉,姚美村
(1.广州市药品检验所,广东 广州 510160;2.中山大学 药学院,广东 广州 510000)
氟康唑属于双唑类衍生物,是一种常用的广谱抗真菌药物,主要用于治疗深部真菌感染、全身性真菌感染、全身性念珠菌病或有发生念珠菌感染倾向的患者。氟康唑胶囊原研厂为辉瑞公司,国内氟康唑胶囊生产厂家很多,2006年已有近60家。由于原研制剂一般为国际制药公司开发研制,在质量水平及其控制上有严格的要求,仿制药只有质量和原研制剂相同或相似,才能保证其用药的有效性和安全性。溶出度是评价药物质量的一个重要内在指标,是一种模拟口服固体制剂在胃肠道中崩解和溶出的体外试验法,它已成为评价固体制剂生物利用度的体外方法,作为制剂质量控制的一种手段,其目的是使不同厂家生产的同一品种能达到一定程度的生物等价,它能有效区分同一种药物生物利用度的差异。本文选取了一批原研单位的胶囊制剂作为参比制剂A,与两批国内不同厂家的制剂(B和C)作比较,同时进一步模拟人体内环境,实验以日本“药品品质再评价”工程在溶出度研究中拟定的模拟人体消化道内体液的3种基本介质为溶出介质测定溶出度曲线,运用相似因子法进行评价,旨在通过考察国产仿制制剂与原研参比制剂体外溶出度曲线是否相似,从而考察药品的内在质量,希望能通过此种评价方法找到我国国内固体制剂与进口原研制剂内在品质上的差距,为国内生产企业有效地提高药品内在质量探索出一条新路。
1 仪器与试剂试药
药物溶出度试验仪(天大天发科技有限公司),紫外可见分光光度计(HITACHI公司),温度计(江苏省海门县瑞祥玻璃厂),酸度计(METTLER TOLEDO公司),氟康唑对照品(中国药品生物制品检定所提供,批号:100314-200503,纯度100%)。所用试剂均为分析纯。
2 溶出度测定
2.1 溶出介质
A 0.1mol/L盐酸溶液(盐酸9→1000,为《中国药典》2010年版溶出度测定介质),B水,C pH6.8磷酸盐缓冲液(取磷酸二氢钾3.4g和无水磷酸氢二钠3.55g,加水适量使溶解后,定容至1000mL,再用水稀释1倍,即得)。
2.2 溶出度测定
分别取三种溶出介质(规格50mg,500mL;规格100mg,1000mL)为溶出介质,照溶出度测定法(《中国药典》2010年版二部附录XC第一法),在转速50转的条件下,将样品随机取样6粒,分别在5,15,20,30,45,60min吸取溶液5mL,用0.45μm微孔滤膜滤过,同时补充同体积同温度溶出介质。取续滤液在261nm波长处测定吸光度A,同时取氟康唑对照品,按对照品比较法,计算出各时间点的累积溶出度(同时取两粒空白胶囊进行校正试验)。
2.3 数据处理及分析判断
美国FDA和日本药局方推荐的相似因子比较法基本假设是试验制剂与参比制剂的累积溶出度的平方和最小,f2为:

当用于不同来源制剂间比较时,若两组曲线相似,f2因子应≥50;当用于同一来源制剂间比较时(批间/批内差异、各种变更等),f2因子应≥65。普通制剂若15min内溶出量均达85%以上,则无需进行曲线比较,认为两制剂溶出行为相似。
3 结果分析
(1)0.1mol/L盐酸溶液介质中,三个厂家的溶出曲线度情况:

可知在15min时参比制剂厂家A和国产厂家B的制剂累积溶出度均达85%以上,可认为在该条件下,A与B的溶出曲线度情况相似,厂家C的制剂15min累积溶出度未达85%,且溶出量与厂家A的相差15%以上,则认为在该条件下,A和C的溶出曲线不一致。
(2)在水介质中,三个厂家的溶出曲线度情况:
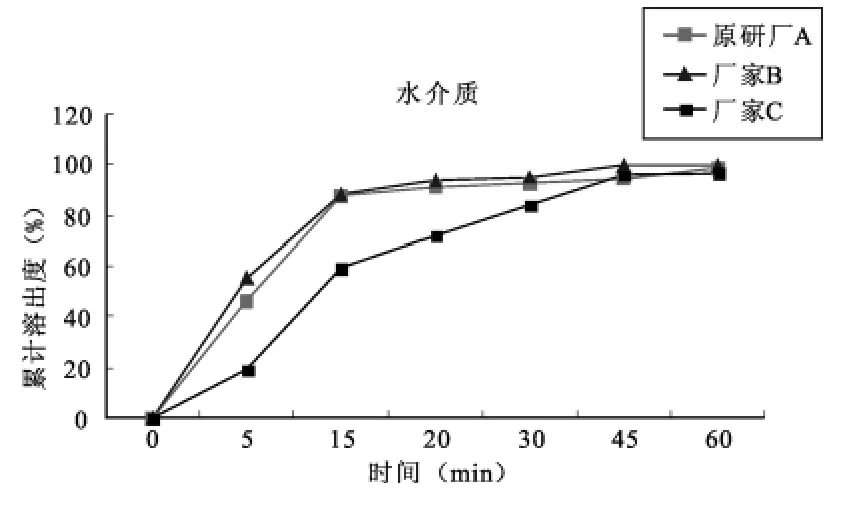
可知在15min时参比制剂厂家A和国产厂家B的制剂累积溶出度均达85%以上,可认为在该条件下,A与B的溶出曲线度情况相似,厂家C的制剂15min累积溶出度未达85%,且溶出量与厂家A的相差15%以上,则认为在该条件下,A和C的溶出曲线不一致。
(3)pH6.8磷酸盐缓冲液介质中,三个厂家的溶出曲线度情况:
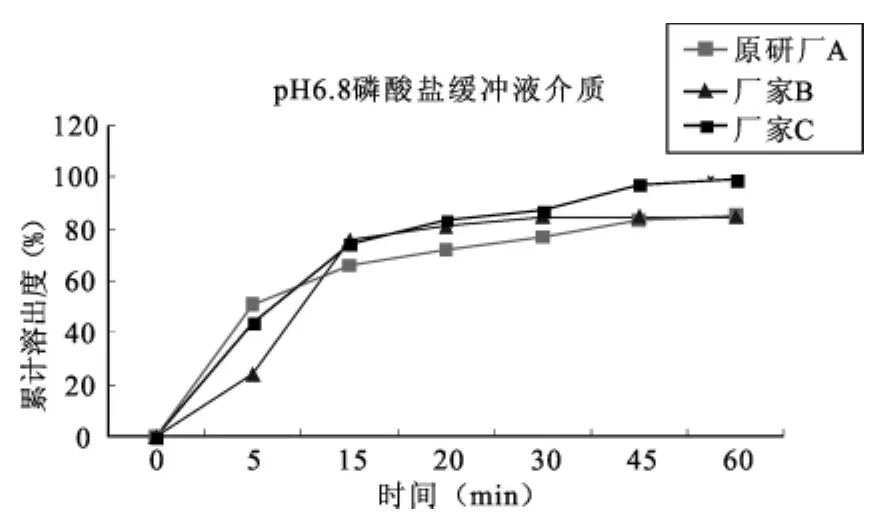
可知在15min时参比厂家A和国产厂家B,C的制剂累积溶出度均未达85%以上,则需要进一步比较A、B、C的溶出曲线情况,计算相似因子f2,考察A和B,A和C是否相似:代入相似因子公式计算,A和B相似因子f2为45,A和C相似因子f2为47,则在此条件下A厂家的溶出情况与B和C的均不一致。
4 讨论
(1)在0.1mol/L盐酸溶液和纯水两种介质中,原研厂家A与仿制厂家B的溶出行为均一致,与仿制厂家C的溶出行为不一致,表明仿制厂家B的溶出行为还是与原研厂较为接近的。但在pH6.8磷酸盐缓冲液介质中,原研厂家A与仿制厂家B和仿制厂家C的溶出行为均不一致,可能与氟康唑胶囊在这种介质中的溶解性不如在其他两种介质中有关,也表明pH6.8磷酸盐缓冲液介质对该品种溶出行为的区分更有分辨力。
(2)溶出度是衡量口服固体制剂质量的重要研究和检验项目,其检测方法和数据的准确性至关重要。一般而言,空胶囊吸收度在0~0.005范围内可以认为无干扰,而本实验中氟康唑胶囊在261nm处有较大的吸收,对溶出度测定具有一定的干扰,为了分析各厂家空胶囊在261nm附近的吸收情况,在检测条件下让空胶囊溶解,按检测程序过滤,并在200~400nm处作扫描图谱,发现该溶液在261nm处有小的吸收。固本实验在验证各厂家溶出情况时,随行做了空白胶囊试验,并扣除空白胶囊吸光度,以求实验结果的准确性。
(3)对于认为相似的曲线,f2应接近100。一般情况下,f2值高于50(50~100),则两条曲线可确认为相同性或等价性,当两药物15min时溶出度均达85%以上时,一般认为该条件下药物在人体中不存在生物利用度问题,两药物的溶出情况相似。
[1]国家药典委员会.中国药典(二部)[S].北京:中国医药科技出版社,2010:547-548.
[2]张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40(12):940-950.
[3]谢沐风.改善溶出度评价方法,提高固体药物制剂水平[J].中国医药工业杂志,200,36(7):447-451.
[4]蔡建华.胶囊壳影响氟康唑胶囊剂溶出度测定考察[J].海峡药学,2009,21(3):221-223.
[5]潘晓鸥,李健,宋毅,等.氟康唑胶囊溶出度检查方法改进[J].中国抗生素杂志,2004,29(6):383-384.
