联合应用共刺激通路阻断剂诱导小鼠记忆性心脏移植耐受的研究
2012-10-30解百宜陈继冰夏俊杰王永志梁华齐忠权
解百宜 陈继冰 夏俊杰 王永志 梁华 齐忠权
在临床器官移植中,移植受者由于初次移植、输血、怀孕以及持续暴露于共生性病原微生物[1-2]等多种原因,外周血中有40﹪~ 50﹪的T细胞有记忆性的表型,对移植物初次及再次移植的存活时间造成重大影响[3-4]。目前认为同种反应性记忆性T细胞(memory T cell,Tm)在此过程中发挥核心作用,主要包括CD4+和CD8+Tm两大类。Tm是免疫系统中抵御外来病原体的重要组成部分,然而在器官移植中却成为重要的障碍,甚至可以在移植术后马上攻击、损伤移植物[5-7]。由于Tm的激活对共刺激通路及Th1型细胞因子的依赖较低,故传统的阻断效应性T细胞激活的方法疗效很差,所以如何阻止Tm参与排斥反应成为研究热点。结合CD4+和CD8+Tm激活分别依赖于OX40/OX40L及LFA-1/ICAM-1的特点[8-9],本研究拟先阻断Tm激活再诱导移植物耐受,来探索诱导记忆性移植耐受的新方法。
材料与方法
一、实验动物
C57BL/6(H-2b)和BALB/c(H-2d)小鼠,雌性,8~12 周龄,体质量 (20 ± 2) g,购自中科院上海斯莱克实验动物有限公司。
二、注射及荧光抗体
CTLA4Ig、Anti-CD40L(MR-1)、Anti-LFA1(M17/4)和Anti-OX40L(RM134L)单克隆抗体及其同型对照抗体,购自黎巴嫩Bioexpress公司。流式细胞学检测用PE anti-CD44和FITC anti-CD62L及其同型对照抗体,购自美国Biolegend公司,流式细胞仪为德国Partec公司生产Cyflow Space型。
三、皮肤预致敏模型及脾脏T细胞提取
以BALB/c小鼠为供体,C57BL/6小鼠为受体进行背部全层皮肤移植(皮片为圆形,直径>1.2 cm)。皮肤移植4周后,取受体鼠脾脏,用红细胞裂解液裂解红细胞后过尼龙毛柱(Wako,日本),分离出T细胞。
四、记忆性心脏移植模型
将2×106个预致敏BALB/c小鼠脾脏T细胞从尾静脉过继转移给未处理C57BL/6小鼠,第2天以BALB/c小鼠为供体,采用套管法进行颈部异位的心脏移植[10],构建记忆性心脏移植模型。分别在移植第0、2、4和6天从腹腔给予共刺激通路阻断剂的治疗,包括anti-LFA1(0.1 mg)、CTLA 4 Ig(0.25 mg)、anti-CD40L(0.25 mg) 及anti-OX 40L(0.25 mg),对照组注射多种同型对照,二联用药组联合应用CTLA4Ig和anti-CD40L,四联用药组联合应用CTLA4Ig、anti-CD40L、anti-LFA-1和anti-OX40L。移植术后由颈部搏动情况判断移植物是否存活,搏动停止即判断为完全排斥。
五、移植心脏的病理学检测
于移植术后第10天取移植物心底部分,用10﹪甲醛溶液固定,做石蜡切片(5 μm)后进行H&E染色,光镜下观察。器官排斥程度参照ISHLT标准[11-12]进行判定,并进行组间的比较。
六、混合淋巴细胞反应(Mixed Lymphocyte Reaction,MLR)
取各组小鼠脾脏T细胞。然后取BALB/c小鼠的脾脏,制成脾细胞悬液后用40 g/ml的丝裂霉素处理。将上述两种细胞按供体:受体=1:10的比例进行混合淋巴细胞反应,培养 3 d,每只鼠平行做三复孔,通过BrdU法(Chemicon,美国)对各组增殖程度进行测定。
七、实时定量 RT-PCR(qRT-PCR)
取各组移植物标本的心尖部分提取RNA,经过逆转录PCR得到cDNA样本。之后取2 μL逆转录产物(每个样本三复孔,每孔2 μL),用实时定量PCR对其进行分析(ABI stepone系统,西班牙Biosystems公司)。以Syber Green I和-actin为参照,检测各组移植物中 IL-2、IFN-、IL-10和Foxp3基因的表达量。引物序列如下:-actin forward 5’-CATCCGTAAA ACCTCTATGCCAAC-3’,and reverse 5’-ATGGAGCCACCGATCCACA-3’;IFN-forward 5’-CGGCACAGTCATTGAAAGCCTA-3’,and reverse 5’-GTTGCTGATGGCCTGATTGTC-3’;IL-2 forward 5’-GGAGCAGCTGTTGATGGACCTAC-3’,and reverse 5’-AATCCAGAACATGCCGCAGAG-3’;IL-10 forward 5’-GACCAGCTGGACAACATACTGCTAA-3’;and reverse 5’-GATAAGGCTTGGCAACCCAAGTAA-3’;Foxp3 forward 5’-CAGCTCTGCTGGCGAAAGTG-3’;and reverse 5’-TCGTCTGAAGGCAGAGTCAGGA-3’。
八、统计学分析
采用 GraphPad Prism® (GraphPad,Inc,CA)进行统计学分析。生存期分析使用Kaplan-Meier法。MLR及realtime-PCR检测结果组间比较采用t检验,以P< 0.05为差异有统计学意义。
结 果
一、皮肤预致敏模型中Tm含量检测
本研究为了检测同种异体皮肤预致敏诱导Tm产生的能力,分离皮肤移植4周的B6小鼠脾脏T细胞,用PE-anti-CD44和FITC-anti-CD62L单抗标记后进行流式细胞仪检测,发现未处理的小鼠脾脏中Tm占6.52﹪(图1a),而预致敏小鼠为26.5﹪(图1b),表明皮肤预致敏可以诱导受者鼠体内分化出大量具有记忆性表型的T细胞。
二、记忆性模型中移植物生存期比较
为了诱导记忆性心脏移植耐受,本研究联合应用多种共刺激通路阻断剂进行干预,分别为CTLA4Ig+anti-CD40L(二联用药)组、CTLA 4 Ig+anti-CD40L+anti-LFA 1+anti-OX 40L(四联用药)组及对照组(各组n= 6),发现对照组平均存活5.17 d,二联用药组平均存活10.33 d,四联用药组均> 100 d。只有四联用药组可诱导移植物长期耐受(图2)。
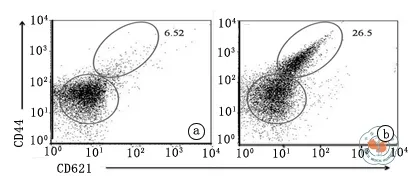
图1 未处理小鼠与皮肤移植4周的小鼠脾脏T细胞的流式细胞仪检测
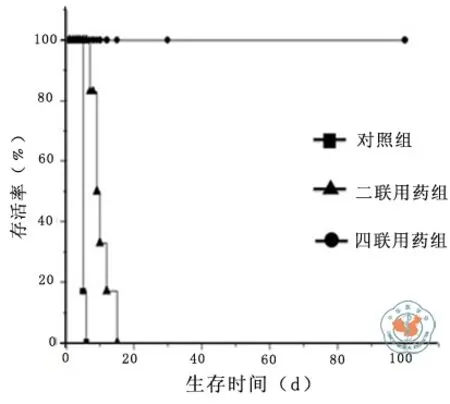
图2 记忆性模型中移植物生存期比较(n = 6)
三、记忆性心脏移植耐受机制的研究
为了研究四联用药组诱导记忆性心脏移植耐受的机制,本研究重新构建记忆性心脏移植模型,各组用抗体治疗10 d后处死。取移植物心底部分,对比各组移植物排斥等级;心尖部分用于检测各组排斥相关细胞因子表达水平;取脾脏并提取T细胞,一部分用来检测Tm表达水平,剩余部分通过MLR检测各组细胞免疫水平的差别。
(一)各组移植物排斥等级评分
参照ISHLT标准进行判定,对照组均为4级(图3a,b),二联用药组为 3B 级 (图3c,d),四联用药组为0级(图3e,f )。说明四联用药组可完全阻止移植物的淋巴细胞浸润,二联用药组和对照组则发生严重的移植排斥反应。
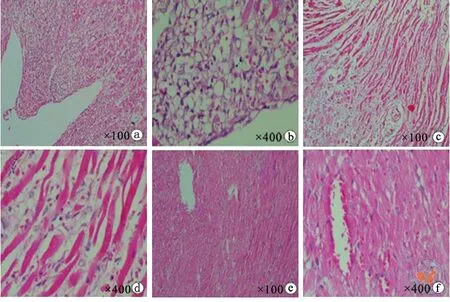
图3 各组移植物排斥等级评分
(二)各组脾脏中Tm表达水平
通过流式细胞术检测,只有对照组出现CD44高表达峰(图4),说明对照组有Tm持续浸润,而治疗组Tm表达缺失。
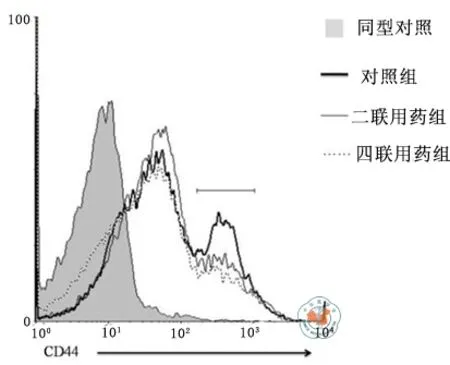
图4 各组脾脏中Tm表达水平
(三)各组细胞免疫水平比较
从MLR结果可以看出,对照组与二联用药组的吸光度均> 0.6,明显高于四联用药组(吸光度 < 0.4,t= 5.045,P= 0.001,表1),说明二联用药组基本上对记忆性移植排斥反应无效,而四联用药则可明显减弱了受体鼠记忆性免疫应答(图5)。

表1 脾细胞混合淋巴细胞反应的增值程度

图5 各组细胞免疫水平比较
(四)各组移植物中排斥相关细胞因子表达水平
通过qRT-PCR检测,相对于对照组,二联用药组的IL-2、IFN-γ和Foxp3基因的相对表达量较低,并且四联用药组比二联用药组更低(图6a,b,c);四联用药组IL-10表达水平明显高于其它两组(图6d)。说明相对于对照组而言,二联用药组降低了移植物中细胞免疫的水平,但未诱导调节性T细胞表达;而四联用药组在降低移植物中细胞免疫水平的同时,未能诱导Foxp3表达,但可诱导了大量IL-10分泌性Tr1细胞的表达。
讨 论
开发共刺激通路阻断剂是临床诱导移植物供者特异性耐受的重要研究方向,其中CTLA4Ig已完成人源化,并进入三期临床试验阶段。这一类药物属于生物制剂,具有作用位点准确、效果明显和副作用小的特点。联合应用CTLA4Ig、anti-CD40L两种药物虽然可诱导初次移植心脏和胰岛等耐受[13-14],但对记忆性移植排斥模型无治疗效果,这主要是由于两类细胞的存在,即不依赖于CD4+T细胞的同种异体反应性CD8+T细胞[15-16]和Tm[17],而前者即为受者体内CD8+Tm的主要来源。在最近几年的研究中,人们发现某些共刺激通路阻断剂可以起到特异性阻断的效果,例如anti-LFA-1可以抑制同种反应性CD8+T细胞的激活及增殖[18-20],anti-OX40L可以通过阻断DC与Tm间的OX40L/OX40途径,抑制CD4+Tm的激活[21-22]。本研究则是在此基础上联合应用上述四种共刺激通路阻断剂,研究其抗排斥治疗的效果,将皮肤移植4周小鼠脾脏的T细胞过继性转移到同系小鼠体内后进行心脏移植,借此建立记忆性同种异体排斥模型,并分组给予不同的治疗方式。通过对各组移植物生存期和病理学的观察分析(图2,3),发现四联用药可明显地对抗记忆性移植排斥,取得理想的治疗效果。
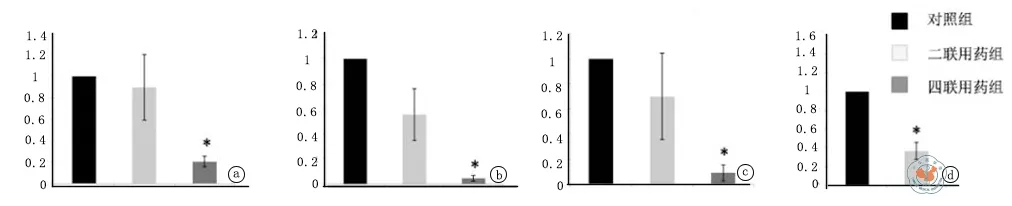
图6 各组移植物中相关基因表达水平
Tm形成后会归巢到二级淋巴组织,包括效应性Tm和中枢性Tm两种,分别主要存在于脾脏和引流淋巴结中。两种Tm在同种异体记忆性排斥中都可发挥重要作用,且效应性Tm的作用更强[23]。为了研究四联用药的对抗记忆性移植排斥机制,检测了各组的脾脏和移植物。在治疗试验中,发现细胞过继转移10 d后对照组脾脏存在大量的Tm,说明Tm注射到体内后会首先归巢到脾脏并有一定程度的自体增殖。而用药组脾脏Tm表达明显减少(图4),这很可能是由于过继转移的Tm无法被激活或激活后效应受到抑制而凋亡所致。由于Tm细胞只需要TCR信号(但有MHC限制性)即可以激活,故应用anti-OX40L和anti-LFA1试图分别阻止CD4+和CD8+Tm细胞的增殖和分化,该想法在脾细胞MLR(图5)和移植物中IL-2和IFN-γ表达水平检测(图6 A,B)时得到验证,充分说明四联用药强大的抑制同种反应性Tm的效果,使Tm在体内(不论在脾脏还是在移植物中)处于克隆无能或AICD(activation induced cell death)状态。
单纯联合应用CTLA4Ig和anti-CD40L可诱导初次心脏移植的耐受,是由于在移植物局部可诱导形成大量的CD4+CD25+Foxp3+调节性T细胞[24]。2006年Ito等[25-26]报道OX40L/OX40途径的激活会通过分泌IFN-γ而抑制IL-10分泌性Tr1细胞的形成,还有抑制Foxp3+T细胞功能的作用。结合上述研究成果,检测移植物中Foxp3和IL-10的表达水平,发现四联用药组的移植物局部Foxp3+调节性T细胞的表达并未增加(图6C),但Tr1细胞的表达水平却明显增加(图6D),说明在记忆性排斥模型中诱导耐受的机制与初次移植不同,是以大量诱导 Tr1细胞为主,这也解释了为什么在某些特殊体质的移植受者(如初次移植、输血和怀孕以及特殊感染)单纯阻断效应性T细胞而无法诱导有效耐受了[27-29]。
综上所述,联合四种共刺激通路阻断剂可以在抑制移植物Th1型细胞因子表达的同时诱导大量Tr1细胞表达,并以此削弱Tm诱导的机体细胞免疫水平,清除体内的Tm,从而达到延长记忆性同种异体心脏移植生存期、降低排斥反应的效果。2008年Minamimura等[30]报道阻断效应性T细胞应答的同时联合使用清除性anti-CD 122,清除CD8+CD122+Tm治疗序贯模型中的皮肤移植,取得长期耐受的效果,也可能是一种有前景的抑制记忆性移植排斥的方法;另外我们发现再次移植受者体内还存在另一个重要的破坏移植物耐受形成的因素,就是记忆性体液免疫应答[31],集中反应在序贯模型中心脏移植物的存活时间更短(2 d之内),目前有一些可能有效的作用靶点被发现,如记忆性B细胞高表达CD44、CD27等,有待于进一步的探索与验证。
1 Burrows SR, Khanna R, Burrows JM, et al. An alloresponse in humans is dominated by cytotoxic T lymphocytes (CTL) cross-reactive with a single Epstein-Barr virus CTL epitope: implications for graft-versus-host disease[M]. J Exp Med, 1994, 179(4):1155-1161.
2 Burrows SR, Silins SL, Khanna R, et al. Cross-reactive memory T cells for Epstein-Barr virus augment the alloresponse to common human leukocyte antigens:degenerate recognition of major histocompatibility complex-bound peptide by T cells and its role in alloreactivity[J]. Eur J Immunol, 1997, 27(7):1726-1736.
3 Douek DC, McFarland RD, Keiser PH, et al. Changes in thymic function with age and during the treatment of HIV infection[J]. Nature, 1998, 396(6712):690-695.
4 McFarland RD, Douek DC, Koup RA, et al. Identification of a human recent thymic emigrant phenotype[J]. Proc Natl Acad Sci USA, 2000, 97(8):4215-4220.
5 Valujskikh A, Li XC. Frontiers in nephrology:T cell memory as a barrier to transplant tolerance[J]. J Am Soc Nephrol, 2007, 18(8):2252-2261.
6 Bingaman AW, Farber DL. Memory T cells in transplantation: generation, function, and potential role in rejection[J]. Am J Transplant, 2004, 4(6):846-852.
7 Lakkis FG, Sayegh MH. Memory T cells: a hurdle to immunologic tolerance[J]. J Am Soc Nephrol, 2003,14(9):2402-2410.
8 Maxwell JR, Weinberg A, Prell RA, et al. Danger and OX40 receptor signaling synergize to enhance memory T cell survival by inhibiting peripheral deletion[J]. J Immunol, 2000, 164(1): 107-112.
9 Ni HT, Deeths MJ, Li W, et al. Signaling pathways activated by leukocyte function-associated Ag-1-dependent costimulation[J]. J Immunol, 1999, 162(9):5183-5189.
10 Matsuura A, Abe T, Yasuura K. Simplified mouse cervical heart transplantation using a cuff technique[J].Transplantation, 1991, 51(4):896-898.
11 Billingham ME, Cary NR, Hammond ME, et al. A working formulation for the standardization of nomenclature in the diagnosis of heart and lung rejection: Heart Rejection Study Group. The International Society for Heart Transplantation[J]. J Heart Transplant, 1990, 9(6):587-593.
12 Winters GL, Marboe CC, Billingham ME. The International Society for Heart and Lung Transplantation grading system for heart transplant biopsy specimens:clarification and commentary[J]. J Heart Lung Transplant,1998, 17(8):754-760.
13 Corbascio M, Ekstrand H, Osterholm C, et al. CTLA4Ig combined with anti-LFA-1 prolongs cardiac allograft survival indefinitely[J]. Transpl Immunol, 2002, 10(1):55-61.
14 Corbascio M, Mahanty H, Osterholm C, et al. Antilymphocyte function-associated antigen-1 monoclonal antibody inhibits CD40 ligand-independent immune responses and prevents chronic vasculopathy in CD40 ligand-deficient mice[J]. Transplantation, 2002,74(1):35-41.
15 Trambley J, Bingaman AW, Lin A, et al. Asialo GM1(+)CD8(+) T cells play a critical role in costimulation blockade-resistant allograft rejection[J]. J Clin Invest,1999, 104(12):1715-1722.
16 Williams MA, Trambley J, Ha J, et al. Genetic characterization of strain differences in the ability to mediate CD40/CD28-independent rejection of skin allografts[J]. J Immunol, 2000, 165(12): 6849-6857.
17 Vu MD, Clarkson MR, Yagita H, et al. Critical, but conditional, role of OX40 in memory T cell-mediated rejection[J]. J Immunol, 2006, 176(3):1394-1401.
18 Oderup C, Malm H, Ekberg H, et al. Costimulation blockade-induced cardiac allograft tolerance: inhibition of T cell expansion and accumulation of intragraft CD4(+)Foxp3(+) T cells[J]. Transplantation, 2006,82(11): 1493-1500.
19 Malm H, Pahlman C, Veress B, et al. Combined costimulation blockade prevents rejection of allogeneic islets in mice[J]. Scand J Immunol, 2006, 64(4):398-403.
20 Richards DM, Zhang N, Dalheimer SL, et al. Allopeptidespecific CD4(+) T cells facilitate the differentiation of directly alloreactive graft-infiltrating CD8(+) T Cells[J].Am J Transplant, 2007, 7(10):2269-2278.
21 Demirci G, Amanullah F, Kewalaramani R, et al.Critical role of OX40 in CD28 and CD154-independent rejection[J]. J Immunol, 2004, 172(3):1691-1698.
22 Yuan X, Salama AD, Dong V, et al. The role of the CD134-CD134 ligand costimulatory pathway in alloimmune responses in vivo[J]. J Immunol, 2003, 170(6): 2949-2955.
23 Oberbarnscheidt MH, Ng YH, Chalasani G. The roles of CD8 central and effector memory T-cell subsets in allograft rejection[J]. Am J Transplant, 2008, 8(9):1809-1818.
24 Wekerle T, Kurtz J, Bigenzahn S, et al. Mechanisms of transplant tolerance induction using costimulatory blockade[J]. Curr Opin Immunol, 2002, 14(5):592-600.
25 Ito T, Wang YH, Duramad O, et al. OX40 ligand shuts down IL-10-producing regulatory T cells[J]. Proc Natl Acad Sci U S A, 2006, 103(35):13138-13143.
26 Vu MD, Xiao X, Gao W, et al. OX40 costimulation turns off Foxp3+Tregs[J]. Blood, 2007, 110(7):2501-2510.
27 Cecka JM. Living donor transplants[J]. Clin Transpl,1995:363-377.
28 Kupiec-Weglinski JW. Graft rejection in sensitized recipients[J]. Ann Transplant, 1996, 1(1): 34-40.
29 Baid S, Saidman SL, Tolkoff-Rubin N, et al. Managing the highly sensitized transplant recipient and B cell tolerance[J]. Curr Opin Immunol, 2001, 13(5):577-581.
30 Minamimura K, Sato K, Yagita H, et al. Strategies to induce marked prolongation of secondary skin allograft survival in alloantigen-primed mice[J]. Am J Transplant,2008, 8(4): 761-772.
31 Sanz I, Wei C, Lee FE, et al. Phenotypic and functional heterogeneity of human memory B cells[J]. Semin Immunol, 2008, 20(1):67-82.
