苏丹红Ⅰ免疫亲和柱的研制与鉴定
2012-10-27朱立鑫裘雪梅陈兴龙刘仁荣徐富勇
朱立鑫,裘雪梅,陈兴龙,刘仁荣,*,徐 玲,徐富勇
(1.江西科技师范学院生命科学学院,江西 南昌 330013;2.南昌大学生命科学与食品工程学院,江西 南昌 330047)
苏丹红Ⅰ免疫亲和柱的研制与鉴定
朱立鑫1,2,裘雪梅1,陈兴龙1,2,刘仁荣1,*,徐 玲1,徐富勇1,2
(1.江西科技师范学院生命科学学院,江西 南昌 330013;2.南昌大学生命科学与食品工程学院,江西 南昌 330047)
以羧基化的琼脂糖凝胶4FF为载体,采用碳化二亚胺法偶联抗苏丹红Ⅰ(SudanⅠ)单克隆抗体,制备苏丹红Ⅰ免疫亲和柱(IAC)。将SudanⅠ样品过免疫亲和柱,乙腈洗脱后以高效液相色谱法(HPLC)检测,紫外检测波长为478nm,流动相为0.1%甲酸水溶液-乙腈-0.1%甲酸乙腈溶液-丙酮(体积比为21.25:3.75:60:15)。抗SudanⅠ单克隆抗体免疫亲和柱以0.3g带羧基的琼脂糖凝胶4FF与1mg SudanⅠ单抗偶联,柱容量为1.6μg。辣椒粉以0.25~3mg/kg水平添加SudanⅠ标准品,平均回收率为44.52%~77.40%,相对标准偏差为4.6%~8.3%。信噪比(RSN)为3:1时的最低检测限为15ng/mL。本实验成功制备出苏丹红免疫亲和柱。
苏丹红;免疫亲和柱;高效液相色谱
苏丹红Ⅰ(SudanⅠ)是人工合成的属于非离子型脂溶性偶氮类化合物中的一种有机染色剂[1],由于其价格低廉,染色效果好,常被广泛地应用于工业产品中[2-3]。动物实验表明苏丹红Ⅰ具有潜在的致癌性,能导致膀胱、肝脏、脾脏等器官肿瘤[4-5],被国际癌症研究机构(International Agency for Research on Cancer,IARC)归为3类致癌物,已被禁止作为食品添加剂使用[6-9]。
目前,各国学者建立了多种检测苏丹红Ⅰ的方法,主要有酶联免疫吸附实验法(ELISA)[7-10]、液相色谱法(LC-UV-VIS)[11]和液质联用法(LC-MS)[5]。还有一些方法,如毛细管胶束电泳色谱法联紫外检测器法(MEKC-UV)[2]、液相色谱电喷雾联质谱仪法(LC-ESI-MS)[12]、分子印迹聚合物的固相萃取联高效液相色谱法(MIP-SPE-HPLC)[13]、高效液相色谱联电化学法(HPLC-EC)[14]、电化学法(CPE)[15]和毛细管液相色谱-电喷雾串联四极杆加速飞行时间质谱(CLC-ES-QO-MS)[16]等,ELISA法检测苏丹红的最低检测限小于1ng/mL,HPLC法的最低检测限小于10μg/kg,LC-MS法的最低检测限小于10μg/L。ELISA法快速、灵敏,对样品纯度要求低,但干扰因素多,重复性差,常用于大批量样品的检测[17];EC检测法灵敏度较差;HPLC、LC-MS、LC-MS/MS灵敏、准确,但对样品纯度要求较高,检测前必须对样品进行净化处理,常规净化法步骤繁杂,且需使用大量有机溶剂,危害操作人员的身体健康。免疫亲和柱净化法是利用抗原抗体高度特异性亲和吸附作用,使固定在载体上的抗体能快速特异地将苏丹红Ⅰ从样品中分离,并同时完成净化和浓缩步骤。
本实验以羧基化的琼脂糖凝胶4FF为载体,制备苏丹红Ⅰ免疫亲和柱,并净化加标样品,通过HPLC-UV对净化效果进行鉴定。免疫亲和柱简便、快速、高效的样品前处理方式,为HPLC、MS等精确检测各种样品提供了良好的基础。
1 材料与方法
1.1 材料与试剂
辣椒粉 市售;抗SudanⅠ单克隆抗体小鼠腹水、羧基化的Sepharose 4FF 实验室自制。
SudanⅠ、碳化亚胺盐酸盐(EDC·HCl) 美国Sigma公司;乙腈、甲醇(色谱纯) 上海陆都化学试剂厂;丙酮(色谱纯) 汕头市西陇化工厂有限公司;实验用水为Millipore制备的超纯水。
PBS缓冲液: NaCl 8.0g、 Na2HPO4·12H2O 2.9g、KCl 0.2g、KH2PO40.2g,用蒸馏水溶解并定容至1000mL。
1.2 仪器与设备
5804R离心机 德国Eppendorf公司;Lambda 35紫外分光光度计 Perkin Elmer公司;PowerPac Basic Power Supply蛋白质电泳仪 美国Bio-Rad公司;凝胶成像系统 英国Syngene公司;ZHWY-200B恒温培养振荡器 上海智城分析仪器制造有限公司;Agilent 1100高效液相色谱 美国安捷伦公司;超纯水仪 美国Millipore公司。
1.3 方法
1.3.1 SudanⅠHPLC检测方法的建立[18]
HPLC条件:C18反相色谱柱ODS Hypersil (2.1mm×100mm,5μm);进样量:20μL;流速:1mL/min;柱温:30℃;紫外检测器:478nm;流动相:A相、B相体积比25:75 (A:0.1%甲酸的水溶液、乙腈体积比85:15,B:0.1%甲酸的乙腈溶液、丙酮体积比80:20)。
SudanⅠHPLC检测方法的标准曲线绘制:20μL不同质量浓度的SudanⅠ标准溶液(先用N,N-二甲基甲酰胺配成1mg/mL,然后用乙腈稀释成4000、3000、2000、1000、500、250、125、62.5、31.25ng/mL)用 HPLC检测,每个质量浓度重复进样3次,根据峰面积绘制标准曲线。以RSN为3:1时的苏丹红质量浓度作为最低检测限。
1.3.2 抗SudanⅠ单克隆抗体小鼠腹水的制备[17]、纯化和鉴定[19-20]
抗SudanⅠ单克隆抗体小鼠腹水的制备参考文献[17],其纯化和鉴定参考[19-20]方法进行。
1.3.3 抗SudanⅠ单克隆抗体琼脂糖凝胶4FF的制备
将羧基化的的琼脂糖凝胶4FF置于砂芯漏斗中,用蒸馏水冲洗,真空泵抽干,称取1g,加入1mg抗SudanⅠ单抗、EDAC和超纯水,于室温,180r/min振荡反应12h。以此同时,用氨基化苏丹红与抗SudanⅠ单抗做对照,观察反应偶联效果。然后再加入pH 8.0 0.1mol/L Tris-HCl封阻缓冲液,继续反应3h。
将偶联有单抗的琼脂糖凝胶4FF,先用PBS洗3次,然后用pH 3.6 0.1mol/L醋酸缓冲液含0.5mol/L NaCl和pH 8.0、0.1mol/L Tris-HCl缓冲液含0.5mol/L NaCl交替洗至少3次,再用PBS洗3次,最后用0.2g/L NaN3的PBS洗2次,将凝胶保存于4℃,0.2g/L NaN3的PBS中。
将偶联有氨基化苏丹红的琼脂糖凝胶4FF,先用0.01mol/L HCl洗至少3次,每次振荡混匀,以1000r/min离心3min,弃上清;再用乙腈和PBS缓冲液分别洗3次,方法同上。然后,将其加入PB S缓冲液,4℃保存。
1.3.4 免疫亲和柱净化样品
将保存于4℃、0.2g/L NaN3-PBS中的抗SudanⅠ单抗-Sepharose 4FF平衡至室温后脱气,装柱后,先用PBS缓冲液平衡;然后以20%乙腈-PBS作为上样缓冲液,上样一次;再用PBS缓冲液清洗至少10倍柱床体积,以1滴1~2s速度过柱;最后用3.0mL乙腈洗脱,收集洗脱液。立即将柱子用PBS缓冲液清洗至少3次,然后用pH 3.6、0.1mol/L醋酸缓冲液含0.5mol/L NaCl和pH 8.0、0.1mol/L Tris-HCl缓冲液含0.5mol/L NaCl交替洗至少3次,再用PBS缓冲液洗3次,将凝胶保存于4℃、0.2g/L NaN3的PBS中。
1.3.5 免疫亲和柱性能的测定和IAC条件的优化
1.3.5.1 上样缓冲液的选择
取0.3g 抗SudanⅠ单抗-Sepharose 4FF装柱,共3批,每批4支,同时上样1.8μg SudanⅠ标准品,上样缓冲液分别为8mL 15%、20%、25%、30%乙腈-PBS,3.0mL乙腈洗脱,HPLC检测洗脱液。
1.3.5.2 洗脱液体积的选择
取抗SudanⅠ单抗的Sepharose 4FF亲和柱6支(共3批,每批6支),同时上样,上样量为1.8μg SudanⅠ标准品,然后分别用0.5、1.0、1.5、2.0、2.5、3.0mL乙腈洗脱,收集洗脱液,并用HPLC检测。
1.3.5.3 免疫亲和填料装柱量、上样量与柱容量的关系
填料装柱量与柱容量的关系:取1支柱子(共3批,每批1支),用0.6g 抗SudanⅠ单抗的Sepharose 4FF装柱,上样量为1.8μg SudanⅠ标准品,用3.0mL乙腈洗脱并吹干,收集洗脱液,用HPLC检测。
上样量与柱容量的关系:取0.3g抗SudanⅠ单抗的Sepharose 4FF装柱,4支(共3批,每批4支),上样量分别为1、2、3、4μg SudanⅠ标准品,用3.0mL乙腈洗脱,分别收集洗脱液,并用HPLC检测。
柱容量的测定:取1支柱子(共3批,每批1支),用0.3g 抗SudanⅠ单抗的Sepharose 4FF装柱,上样量为1.8μg SudanⅠ标准品,用3.0mL乙腈洗脱,收集洗脱液,并用HPLC检测。
1.3.5.4 免疫亲和柱稳定性的测定
洗脱液对免疫亲和柱的影响:取0.3g 抗SudanⅠ单抗的Sepharose 4FF装柱,上样量为1.8μg SudanⅠ标准品,洗脱并收集洗脱液。柱子平衡和再生后,再重复以上步骤两次。用HPLC检测洗脱液。
1.3.6 辣椒粉样品加标回收率实验
称取1g辣椒粉阴性样品(经HPLC和ELISA法检测都为阴性),分别加入250、500、1000、2000、3000ng SudanⅠ标准品,每个浓度做3个平行样;加入5mL乙腈,然后振荡(或超声)10min,离心15min,取上清3.6mL浓缩至1mL左右,接着再用乙腈定容至1.6mL,再加6.4mL PBS,混匀后,用定性滤纸过滤。然后取滤液6.6mL过免疫亲和柱(每支用0.3g抗SudanⅠ单抗的Sepharose 4FF装柱,柱容量约为1000ng)。
2 结果与分析
2.1 SudanⅠHPLC检测方法的建立
在本实验条件下,SudanⅠ的HPLC保留时间为7.973min,如图1所示。

图1 4000ng/mL SudanⅠ标品的HPLC色谱图Fig.1 HPLC chromatogram of Sudan I standard at 4000 ng/mL
分析不同质量浓度的标准溶液HPLC检测结果,在质量浓度为31.25~4000ng/mL时,峰面积与SudanⅠ质量浓度呈线性关系,且标准曲线方程为y=0.07422.6395(R2=0.9998)。该方法的最低检测限为15ng/mL(RSN= 3:1)。
2.2 小鼠腹水中SudanⅠ单抗纯化效果的评价
2.2.1 辛酸-硫酸铵法纯化腹水中单抗的回收率
使用紫外分光光度计紫外扫描小鼠腹水和腹水纯化后抗体中蛋白质量浓度分别为27.29mg/mL和7.17mg/mL,它们体积分别为4.0mL和4.05mL,蛋白回收率为26.60%。
2.2.2 抗SudanⅠ单克隆抗体纯度的测定

图2 抗SudanⅠ单克隆抗体纯化前后SDS-PAGE电泳图Fig. 2 SDS-PAGE pattern of ascites and purified anti-Sudan I monoclonal antibody
由图2可知,原始腹水的蛋白成分复杂,经纯化后的抗体蛋白较单一,说明抗体纯度较高。
2.2.3 纯化后抗SudanⅠ单抗活性的测定
采用间接非竞争ELISA,以BSA-SudanⅠ3μg/mL为检测抗原包被,原始腹水和纯化后抗体在相同比例稀释下,在光密度值为1.2时,原始腹水和纯化后的单抗效价分别为1:1.28×105、1:6.4×104,对比可知,单抗纯化的活性回收率较高。
2.3 抗SudanⅠ单克隆抗体免疫亲和柱的制备
氨基化苏丹红和抗SudanⅠ单克隆抗体在相同的条件下分别与羧基化的琼脂糖凝胶4FF反应,若氨基化苏丹红偶联效果很好,说明在此条件下偶联上的单抗量也较多。
偶联有氨基化苏丹红的羧基化琼脂糖凝胶4FF,经洗净后,由凝胶颜色的深浅可看出,在EDAC终质量浓度为19mg/mL,17℃、180r/min振荡反应12h时偶联效果好。
2.4 免疫亲和柱性能的测定和IAC条件的优化
2.4.1 上样缓冲液和上样方式的选择
SudanⅠ难溶于水,为增加其溶解量,用乙腈等有机溶剂溶解,但有机溶剂又会破坏单抗的活性,因此需探寻上样缓冲液中乙腈比例与SudanⅠ回收率的关系,尽可能地使SudanⅠ与固定的单抗结合,其关系,如图3所示,上样缓冲液为20%乙腈-PBS时,SudanⅠ回收率最大。

图3 上样缓冲液与SudanⅠ回收率的关系Fig. 3 Effect of loading buffer concentration on recovery rate of Sudan I
2.4.2 洗脱液体积的选择
取0.3g抗SudanⅠ单抗的Sepharose 4FF装柱量,上样量为1.8μg SudanⅠ,SudanⅠ回收率与乙腈洗脱液关系。如图4所示,SudanⅠ回收率在洗脱液乙腈的体积从0.5~1.0mL时,出现剧增,从1.0~3.0mL时,增幅较小。故本实验选择3.0mL乙腈作为洗脱液。
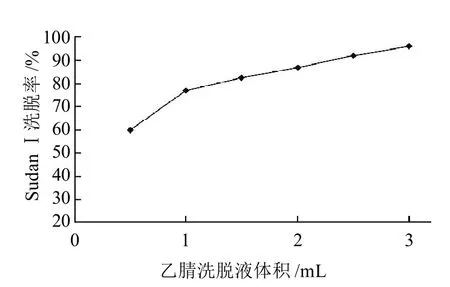
图4 洗脱液体积与SudanⅠ洗脱率的关系Fig. 4 Effect of eluent dose on elution rate of Sudan I
2.4.3 免疫亲和柱填料装柱量、上样量与柱容量的关系
免疫亲和柱填料装柱量与柱容量的关系:0.6g抗SudanⅠ单抗-Sepharose 4FF,上样量为2 μg SudanⅠ时,1mL乙腈洗脱,SudanⅠ回收率为43.93%,比装柱量为0.3g的回收率低。原因是装柱量增大,增加柱床高度,从而也增加了SudanⅠ吸附距离,在洗脱液体积为1.0mL时,并不能完全把结合上的SudanⅠ洗脱,最终导致低于0.3g装柱量的回收率。
上样量与柱容量关系:同批免疫亲和填料0.3g,仅上样量不同,用3mL乙腈洗脱后,经HPLC检测,发现上样量和柱容量的关系。柱容量的测定:0.3g免疫亲和填料,在优化条件下,即SudanⅠ上样量为1.8μg,20%的乙腈-PBS作为上样缓冲液,仅上样一次,测得柱容量为1582.8ng,SudanⅠ回收率为87.93%。由图5可知,在3mL乙腈洗脱下,SudanⅠ上样量达到2μg时,再增加上样量,测出的柱容量基本上保持稳定。
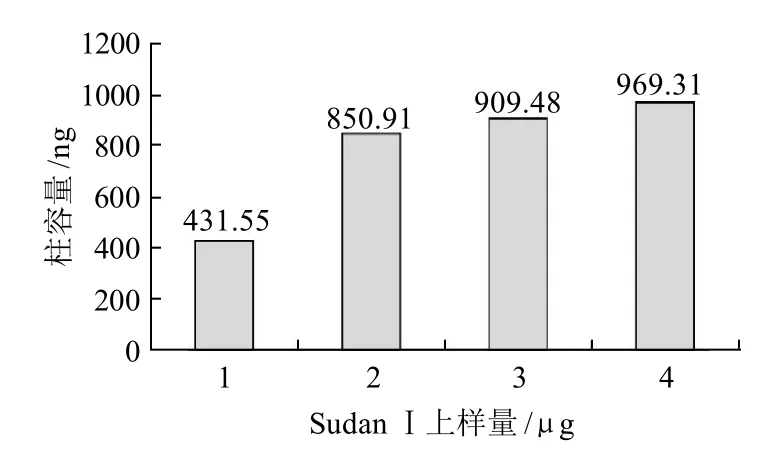
图5 SudanⅠ上样量与柱容量的关系Fig. 5 Effect of loading amount of Sudan I on IAC capacity
2.4.4 免疫亲和柱稳定性的测定
免疫亲和柱每次上样量为1.8μg,仅上样一次,上样缓冲液为25%乙腈-PBS,3.0mL乙腈作为洗脱液。第一次上样,清洗,洗脱后,立即再生,接着重复此步骤两次,以消除保存方法和保存时间对免疫亲和填料的影响,考察洗脱液对免疫亲和填料中单抗的破坏程度。如图6所示,每使用一次,SudanⅠ回收率约降低12%,即柱容量降低216ng,说明免疫亲和柱稳定性较好,可以重复使用。

图6 免疫亲和柱稳定性与SudanⅠ回收率的关系Fig. 6 Effect of number of repeated uses on recovery rate of Sudan I
2.5 辣椒粉样品加标回收率实验

表1 辣椒粉样品SudanⅠ标品加标回收实验Table 1 Recovery rates of Sudan I in chili powder samples spiked with Sudan I standard
选用柱容量约为1000ng的免疫亲和柱进行样品加标回收实验。将加有不同量SudanⅠ标准品的辣椒粉样品,经乙腈提取并用PBS缓冲液稀释至20%乙腈-PBS后,过免疫亲和柱,用建立的HPLC法检测洗脱液中SudanⅠ的含量,由表1可知,测得辣椒粉中SudanⅠ的回收率为44.52%~77.40%,变异系数为4.6%~8.3%,表明苏丹红Ⅰ免疫亲和柱研制成功。
3 讨 论
采用碳化亚二胺法,以本实验室制备的羧基化琼脂糖凝胶4FF为载体与抗苏丹红Ⅰ单抗偶联,成功地制备了苏丹红Ⅰ免疫亲和柱。免疫亲和柱柱容量约为1600ng。通过样品加标回收实验表明,在加标量未超过柱容量时,苏丹红Ⅰ回收率大于70%,最低检测限为15ng/mL(RSN=3:1)。苏丹红Ⅰ免疫亲和柱经多次使用后,苏丹红Ⅰ回收率每次降低12%,说明免疫亲和柱基本稳定,能重复利用。由于羧基化琼脂糖凝胶的制备和辛酸-硫酸铵法纯化的单抗,不同批次有所差别,使免疫亲和柱柱容量在微小范围内波动,但苏丹红Ⅰ回收率几乎不变。苏丹红的物理吸附性强,易吸附于免疫亲和柱的筛板和柱壁上,且上样量大时,吸附上的苏丹红也相应的增多,吸附的苏丹红经有机溶剂和超声处理仍难以洗脱,导致实际上样量偏低,从而使回收率远低于真实值。因此,羧基化琼脂糖凝胶4FF活化率的提高,单抗的偶联条件和苏丹红上样条件(上样缓冲液的盐浓度和pH值、上样体积、洗脱速度、温度)的进一步优化,增加苏丹红结合率降低物理性吸附率,以及制备高亲和力的抗苏丹红Ⅰ单抗,为增大柱容量、提高苏丹红回收率提供可能。
目前,国内外均无抗苏丹红免疫亲和柱研制的报导,本实验成功制备的抗苏丹红Ⅰ免疫亲和柱填补了这份空白。免疫亲和柱特异性强、简便快速、安全、回收率高的样品净化处理方式,为高效液相色谱-质谱仪准确、快速地检测各种苏丹红样品提供了良好的基础,显示了很好的应用前景。
[1] HABIBI M H, HASSANZADEH A, MAHDAVI S. The effect of operational parameters on the photocatalytic degradation of three textile azo dyes in aqueous TiO2suspensions[J]. Journal of Photochemistry and Photobiology A, 2005, 172(1): 89-96.
[2] MEJIA E, DING Yongsheng, MORA M F, et al. Determination of banned Sudan dyes in chili powder by capillary electrophoresis[J]. Food Chemistry, 2007, 102(4): 1027-1033.
[3] ZHANG Yuping, ZHANG Yijun, GONG Wenjun, et al. Rapid separation of Sudan dyes by reverse-phase high performance liquid chromatography through statistically designed experiments[J]. Journal of Chromatography A, 2005, 1098: 183-187.
[4] STIBOROVA M, MARTINEK V, RYDLOVA H, et al. Sudan I is a potential carcinogen for humans: evidence for its metabolic activation and detoxication by human recombinant cytochrome P450 1A1 and liver microsomes[J]. Cancer Research, 2002, 62(20): 5678-5684.
[5] REBANE R, LEITO I, YURCHENKO S, et al. A review of analytical techniques for determination of Sudan Ⅰ—Ⅳ dyes in food matrixes[J].Journal of Chromatography A, 2010, 1217: 2747-2757.
[6] HE Limin, SU Yijuan, FANG Binghu, et al. Determination of Sudan dye residues in eggs by liquid chromatography and gas chromatography-mass spectrometry[J]. Analytica Chimica Acta, 2007, 594: 139-146.
[7] HAN Dan, YU Meng, KNOPP D, et al. Development of a highly sensitive and specific enzyme-linked immunosorbent assay for detection of Sudan Ⅰ in food samples[J]. Journal of Agricultural and Food Chemistry, 2007, 55: 6424-6430.
[8] WANG Yuzhen, WEI Dapeng, YANG Hong, et al. Development of a highly sensitive and specific monoclonal antibody-based enzyme-linked immunosorbent assay (ELISA) for detection of Sudan I in food samples[J]. Talanta, 2009, 77: 1783-1789.
[9] XU Ting, WEI Keyi, WANG Jia, et al. Development of an enzymelinked immunosorbent assay specific to Sudan redⅠ[J]. Analytical Biochemistry, 2010, 405, 41-49.
[10] JU Chunmei, TANG Yong, FAN Huiying, et al. Enzyme-linked immunosorbent assay (ELISA) using a specific monoclonal antibody as a new tool to detect Sudan dyes and Para red[J]. Analytica Chimica Acta,2008, 621: 200-206.
[12] CALBIANI F, CARERI M, ELVIRI L, et al. Development and in-house validation of a liquid chromatography-electrospray-tandem mass spectrometry method for the simultaneous determination of Sudan Ⅰ, SudanⅡ, Sudan Ⅲ and Sudan Ⅳ in hot chilli products[J]. Journal of Chromatography A, 2004, 1042: 123-130.
[13] ZHAO Chuande, ZHAO Ting, LIU Xiaoyan, et al. A novel molecularly imprinted polymer for simultaneous extraction and determination of Sudan dyes by on-line solid phase extraction and high performance liquid chromatography[J]. Journal of Chromatography A, 2010, 1217:6995-7002.
[14] CHAILAPAKUL O, WONSAWAT W, SIANGPROH W, et al. Analysis of Sudan Ⅰ, Sudan Ⅱ, Sudan Ⅲ, and Sudan Ⅳ in food by HPLC with electrochemical detection: comparison of glassy carbon electrode with carbon nanotube-ionic liquid gel modified electrode[J]. Food Chemistry, 2008, 109(4): 876-882.
[15] LIN Huogang, LI Gang, WU Kangbing. Electrochemical determination of Sudan Ⅰ using montmorillonite calcium modified carbon paste electrode[J]. Food Chemistry, 2008, 107(1): 531-536.
[16] CALBIANI F, CARERI M, ELVIRI L, et al. Accurate mass measurements for the confirmation of Sudan azo-dyes in hot chilli products by capillary liquid chromatography-electrospray tandem quadrupole orthogonal-acceleration time of flight mass spectrometry[J]. Journal of Chromatography A, 2004, 1058: 127-135.
[17] 裘雪梅, 刘仁荣, 徐玲, 等. 苏丹红Ⅰ单克隆抗体的制备及其间接竞争ELISA检测[J]. 食品科学, 2010, 31(18): 258-261.
[18] GB/T 19681—2005食品中苏丹红染料的检测方法 高效液相色谱法[S].
[19] 郭雪梅. 建立 IAC-HPLC 检测红曲米中的桔霉素[D]. 南昌: 南昌大学, 2007.
[20] 萨姆布鲁克J, 弗里奇E F, 曼尼阿蒂斯T. 分子克隆实验指南[M]. 2版. 北京: 科学出版社, 2002: 880-887.
Preparation and Identification of Sudan I Immunoaffinity Column
ZHU Li-xin1,2,QIU Xue-mei1,CHEN Xing-long1,2,LIU Ren-rong1,*,XU Ling1,XU Fu-yong1,2
(1. College of Life Science, Jiangxi Science and Technology Normal University, Nanchang 330013, China ;2. College of Life Science and Food Engineering, Nanchang University, Nanchang 330047, China)
A Sudan I immunoaffinity chromatographic column (IAC) was prepared by carbodiimide method, in which a modified Sepharose 4FF containing carboxyl group was used as the carrier to couple with a monoclonal antibody against Sudan I. A reversed-phase HPLC method was established to determine Sudan I using a mobile phase composed of 0.1% formic wateracetonitrile-0.1% formic acetonitrile-acetone (21.25:3.75:60:15, V/V) at a flow rate of 1 mL/min. The detection wavelength was 478 nm. The retention time of Sudan I was found to be 7.97 min. The prepared IAC column as a conjugate between 0.3 g of Sepharose 4FF and 1 mg of purified anti-Sudan I monoclonal antibody showed a capacity of 1.6μ g. The average recovery rates of Sudan I from chili powder spiked with Sudan I standard at levels varying from 0.25 to 3 mg/kg was 44.52%~77.40% with relative standard deviation of 4.6%~8.3%. The detection limit was 15 ng/mL based on a signal-to-noise ratio of 3:1. Therefore, a Sudan I IAC column has been prepared successfully.
Sudan I;immunoaffinity column;high performance liquid chromatography (HPLC)
O658;TS207.3
A
1002-6630(2012)15-0252-05
2011-06-02
江西省教育厅科技专项(GJJ10595)
朱立鑫(1986—),男,硕士研究生,研究方向为食品生物技术。E-mail:zhulixin007@163.com
*通信作者:刘仁荣(1969—),男,教授,博士,研究方向为食品安全检测。E-mail:lilirenrong@hotmail.com
