基于HPLC的苏丹红检测中光学诱导异构现象的探究
2016-10-31邵明华江晨舟张驰中傅佳萍王利娟
邵明华,江晨舟,张驰中,傅佳萍,王利娟
(上海安谱实验科技股份有限公司,上海 201608)
基于HPLC的苏丹红检测中光学诱导异构现象的探究
邵明华,江晨舟*,张驰中,傅佳萍,王利娟
(上海安谱实验科技股份有限公司,上海 201608)
采用岛津LC-20AB液相色谱仪,SPD-M20A二极管阵列检测器,CNW Athena C18-WP(4.6 mm×150 mm,5 μm)色谱柱,柱温为30 ℃,以乙腈-水(体积比为88∶12)为流动相,进行等度洗脱,流速为1.0 mL/min,在500 nm处对苏丹红Ⅰ-Ⅳ进行分析,并深入研究了其光学诱导异构现象。研究结果表明:苏丹红Ⅰ-Ⅳ在0.10~20.00 mg/L的浓度范围内均有良好的线性关系,相关系数为1.0000;苏丹红Ⅰ和Ⅱ不能发生光学诱导异构,苏丹红Ⅲ和Ⅳ能够发生光学诱导异构;苏丹红光学诱导异构是一个可逆的变化,在没有光照的情况下可以发生逆转;苏丹红标准溶液比固体的苏丹红标准品更易发生光学诱导异构;在0~60 ℃的温度范围内,温度的变化对苏丹红光学诱导异构的影响不大;光照对苏丹红的光学诱导异构有显著影响,影响程度为棕色进样瓶>日光照射=7 W节能灯照射;浓度对苏丹红的光学诱导异构也有显著影响,浓度越高,异构趋于稳定的时间越长,在0.50~20.00 mg/L的浓度范围内,苏丹红Ⅲ异构平衡时的异构率为5.324%~5.787%,苏丹红Ⅳ异构平衡时的异构率为5.121%~5.507%。该研究对苏丹红检测方法的研究和应用具有重要的参考价值。
HPLC,苏丹红,光学诱导异构
苏丹红是一类人工合成的脂溶性偶氮染料,包括苏丹红Ⅰ、Ⅱ、Ⅲ和Ⅳ 4种类型,其结构式如图1所示。苏丹红主要作为工业染料被用于纺织品、橡胶、塑料、油漆等的着色[1]。由于苏丹红处理过的食品颜色鲜艳且不易褪色,一些不法食品企业会把它添加到食品中,这种行为已被我国及欧盟等国家严令禁止。研究表明,苏丹红可以通过多种途径接触人体,并透过生物膜进入血液,再随血液循环分散到全身各组织细胞,进入体内的苏丹红代谢产物主要为胺类及萘酚类物,具有潜在的致癌性、遗传毒性及致敏性[2-3],因此检测相关产品中苏丹红的含量,预防其对人体可能造成的伤害具有重要的意义。目前,苏丹红的检测方法有分光光度法[4]、薄层色谱法[5-6]、电化学法[7]、酶联免疫法[8]、液相色谱法[9-14]、气相色谱-质谱联用法[15-16]、液相色谱-质谱联用法[17-18]及毛细管电泳法[19]等,这些方法的灵敏度、选择性和分析通量存在差异,但国际上对苏丹红的检测方法主要还是高效液相色谱法(HPLC)。近几年对苏丹红的检测有一些新的发现,出现了一些关于检测到苏丹红Ⅲ和Ⅳ分别有两个色谱峰的“多峰”现象的报道[20],并将出峰时间较早的峰称为“快峰”,出峰时间较晚的峰称为“慢峰”,认为“快峰” 是苏丹红Ⅲ和Ⅳ的异构体[20]。多峰现象可以用异构体的原理来解释,根据苏丹红的结构特征,其异构体的产生理论上包括三种形式:光学诱导异构、质子异变异构和旋转异构,本文主要对苏丹红的光学诱导异构现象进行了探究,这对于苏丹红检测方法的研究和应用具有重要的参考价值。

图1 苏丹红Ⅰ~Ⅳ的结构式Fig.1 Structure formula of Sudan Ⅰ~Ⅳ
1 材料与方法
1.1材料与仪器
苏丹红Ⅰ~Ⅳ标准品、HPLC级乙腈、丙酮、水上海安谱实验科技股份有限公司。
LC-20AB液相色谱仪配有SPD-M20A二极管阵列检测器日本岛津公司;XS105DU天平瑞士梅特勒公司。
1.2实验方法
1.2.1高效液相色谱条件色谱柱:CNW Athena C18-WP(4.6 mm×150 mm,5 μm);流动相:乙腈-水(体积比为88∶12),流速1.0 mL/min;柱温30 ℃;进样量10.0 μL;检测波长500 nm。
1.2.2标准曲线的绘制分别称取苏丹红Ⅰ、Ⅱ、Ⅲ及Ⅳ标准品各10 mg(精确到0.0001 g),用适量的丙酮溶解后用乙腈稀释成浓度为0.10、0.50、1.00、5.00、20.00 mg/L的标准溶液。各取10.0 μL标准溶液进行HPLC检测,根据保留时间,以峰面积对苏丹红的浓度作图,绘制标准曲线。
1.2.3苏丹红光学诱导异构实验设计取苏丹红Ⅰ~Ⅳ的标准品,采用即用即配的方式制备三组浓度为5.00 mg/L的混标(制备过程中用锡箔纸包裹以避光),再按照以下方式处理:第一组避光6 h后按照设定的色谱条件进行HPLC检测;第二组光照6 h后进行HPLC检测;第三组先光照6 h,然后用铝箔纸包裹避光24 h,再进行HPLC检测。另外,分别配制浓度为5.00 mg/L的苏丹红III标准溶液和苏丹红Ⅳ标准溶液,光照6 h后进行HPLC检测,并对两种溶液HPLC检测中出现的快峰和慢峰进行全波段扫描,绘制光谱图。
1.2.4苏丹红谱图中杂质峰的确认配制浓度为1.00、5.00、20.00 mg/L的苏丹红Ⅰ~Ⅳ的混标,于光照下分别暴露0、6、12、24、36、48、60 h后进行HPLC检测。
1.2.5苏丹红标准品处理方式对光学诱导异构的影响对苏丹红Ⅰ~Ⅳ的标准品,采用三种方式处理:第一组即用即配,制备浓度为20.00 mg/L的混标,即时进行HPLC检测;第二组与第一组一样,先配制20.00 mg/L的混标,然后将之盛放在2 mL的透明进样瓶中光照12 h,再进行HPLC检测;第三组先将苏丹红Ⅰ~Ⅳ的标准品分别光照12 h,然后称样配成20.00 mg/L的混标,再进行HPLC检测。
1.2.6温度对苏丹红光学诱导异构的影响将5.00 mg/L的苏丹红Ⅰ~Ⅳ的混标在0、25、40、50、60 ℃下光照24 h后进行HPLC检测。
1.2.7进样瓶对苏丹红光学诱导异构的影响将20.00 mg/L的苏丹红Ⅰ~Ⅳ的混标分别盛放于2 mL的棕色进样瓶和透明进样瓶中,光照20 h后进行HPLC检测。
1.2.8光照方式对苏丹红光学诱导异构的影响选择日光照射和7 W节能灯照射两种光照方式对1.00 mg/L的苏丹红Ⅰ~Ⅳ的混标光照12 h,再进行HPLC检测。
1.2.9浓度对苏丹红光学诱导异构的影响配制0.10、0.50、1.00、5.00、20.00 mg/L的苏丹红Ⅲ和Ⅳ的混标,分别光照0、3、6、12、24、36、48、60 h后进行HPLC检测,并根据异构情况计算光学异构率,光学异构率(%)=光学异构后快峰峰面积/异构前的原主峰峰面积×100。
2 结果与分析
2.1标准曲线的建立
HPLC检测结果表明:在设定的色谱条件下,苏丹红Ⅰ、Ⅱ、Ⅲ和Ⅳ都有较好的出峰和响应,基线较平,出现基线波动的位置,其波峰的峰高都低于3倍基线噪音,故不予定性和定量考虑。根据色谱检测结果,以峰面积y对苏丹红的浓度x做标准曲线,经过回归分析,4种苏丹红标准品在0.10~20.00 mg/L的浓度范围内均有良好的线性关系,其线性相关系数均为1.0000。四种苏丹红的回归方程和相关系数如表1所示。

表1 苏丹红Ⅰ~Ⅳ的回归方程和线性相关系数
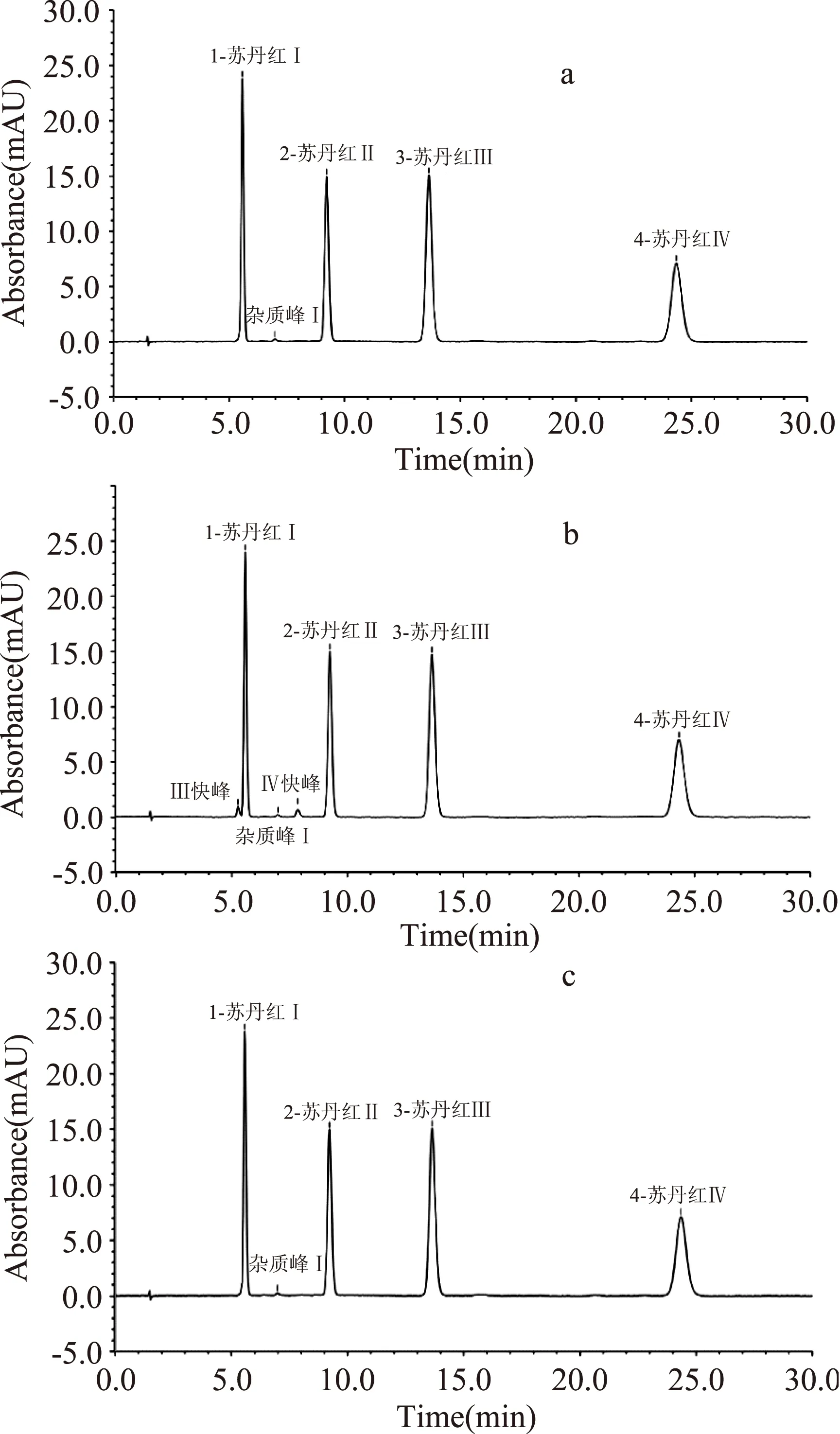
图2 不同处理方式下5.00 mg/L的苏丹红Ⅰ~Ⅳ的混标HPLC色谱图Fig.2 HPLC chromatogram of 5.00 mg/L Sudan Ⅰ~Ⅳ mixed standard solution under different treatments 注:(a)避光6 h;(b)光照6 h;(c)光照6 h再避光24 h。
2.2苏丹红Ⅲ和Ⅳ光学诱导异构实验验证
由图2a结合单标定性结果可知,在设定的色谱条件下,避光处理6 h的苏丹红Ⅰ、Ⅱ、Ⅲ、Ⅳ出峰效果较好,出峰时间分别为5.498、9.074、13.211、23.481 min,分离度达到要求,能够进行定性和定量检测。对比光照处理图2b和避光处理图2a的苏丹红Ⅰ~Ⅳ混标的图谱发现,光照6 h后色谱图中多了两个色谱峰,参考Mölder K[20]的叫法,将其称为“快峰”。单标定性结果表明:出峰时间为5.273 min的峰为苏丹红Ⅲ的快峰,出峰时间为7.843 min的峰为苏丹红Ⅳ的快峰。相应的,将出峰时间为13.211 min的峰称为苏丹红Ⅲ的慢峰,出峰时间为23.481 min的峰称为苏丹红Ⅳ的慢峰。苏丹红Ⅰ和Ⅱ的出峰情况没有变化,可能没有发生光学诱导异构,或异构量太少低于仪器的检测限。对比图2c和图2b发现,将光照处理6 h后的苏丹红再避光24 h后,色谱图中的两个快峰又都全部消失了。这就初步得出了苏丹红光学诱导异构现象的存在。为了进一步检验快峰、慢峰各自的性质,对苏丹红Ⅲ和Ⅳ的快峰、慢峰分别进行了全波段光谱扫描,结果如图3、图4所示。根据光谱图分析可知苏丹红Ⅲ和Ⅳ各自的快峰和慢峰在190~800 nm全波段中的光强度吸收特征保持一致,在基于HPLC水平下可以初步判断两者结构与官能团相似。综合以上的实验结果,并结合光学诱导异构的反应机理,可以判定苏丹红的多峰现象是因为发生了光学诱导异构,出现的快峰是异构时慢峰的产物,在现有的分析条件下认为苏丹红Ⅰ和Ⅱ不能发生光学诱导异构,只有苏丹红Ⅲ和Ⅳ能够发生光学诱导异构,苏丹红的光学诱导异构是一个可逆的变化,在没有光照的情况下可以发生逆转。

图3 苏丹红Ⅲ快峰(a)和慢峰(b)的光谱图Fig.3 Spectrogram of fast peak(a)and slow peak(b)of Sudan Ⅲ
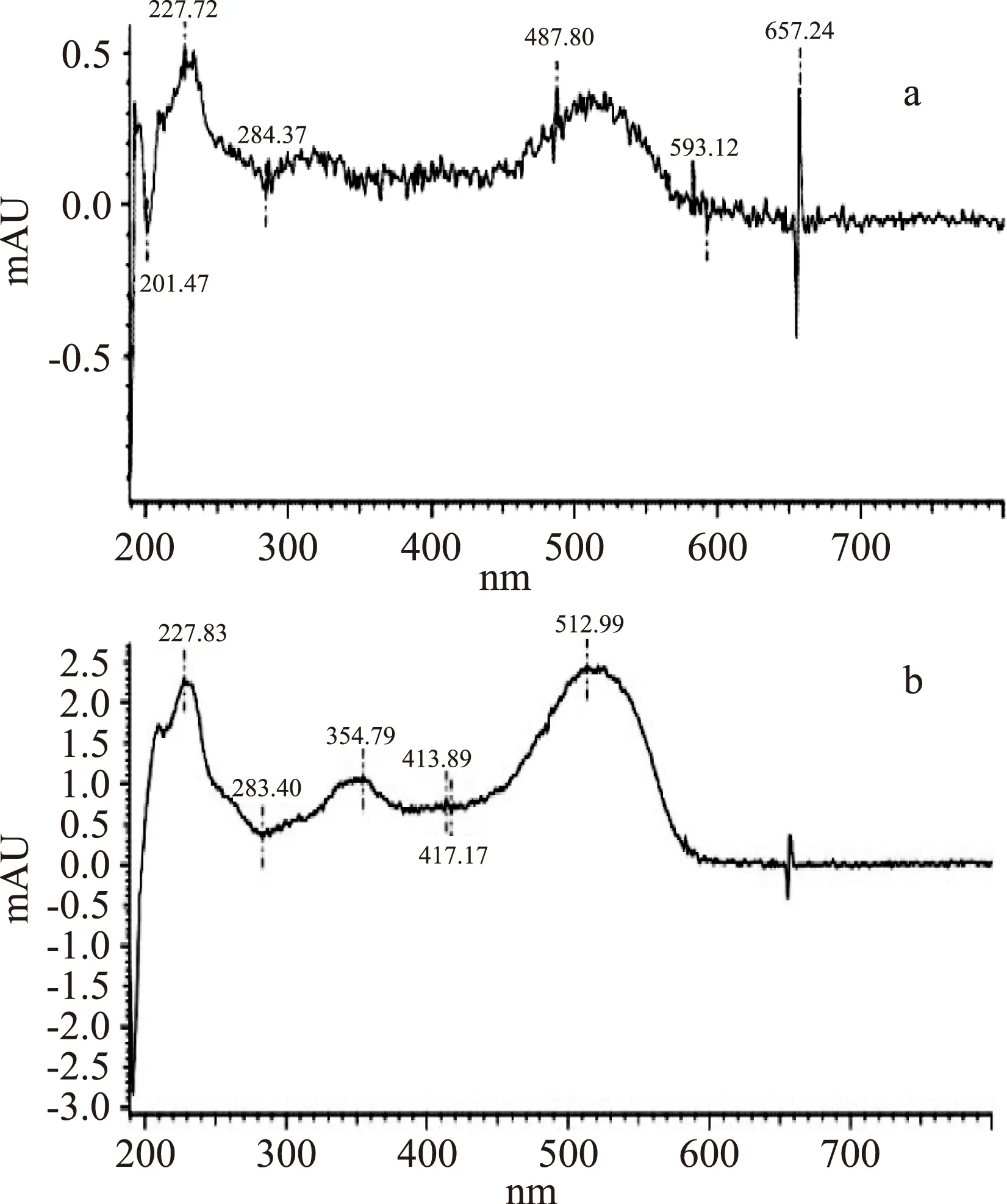
图4 苏丹红Ⅳ快峰(a)和慢峰(b)的光谱图Fig.4 Spectrogram of fast peak(a)and slow peak(b)of Sudan Ⅳ
2.3苏丹红谱图中杂质峰的确定
进行HPLC分析时发现在不同的实验条件下,6.968 min总会形成一个色谱峰,为了确定其对苏丹红的光学诱导异构是否有影响,对1.00、5.00、20.00 mg/L的苏丹红Ⅰ~Ⅳ的混标进行了不同时间的光照处理后进行色谱分析,结果发现:当苏丹红Ⅰ~Ⅳ的混标的浓度为1.00 mg/L时,光照处理不同的时间后,此峰的面积大都在0.006 mAu·min左右(图5);当苏丹红Ⅰ~Ⅳ的混标的浓度为5.00 mg/L时,光照处理不同的时间后,此峰的面积大都在0.03 mAu·min左右(图5);当苏丹红Ⅰ~Ⅳ的混标的浓度增加到20.00 mg/L时,光照处理不同的时间后,此峰的面积大都在0.12 mAu·min左右(图5)。由此可以看出,该峰的面积与光照时间没有关系,而只与苏丹红的浓度呈正相关。Mölder K也有类似的发现,并认为此峰是一个未确定的杂质峰[20],因此该峰对苏丹红光学诱导异构的研究影响不大。
2.4苏丹红标准品处理方式对光学诱导异构的影响
由图6a可知,20.00 mg/L即用即配的苏丹红Ⅰ~Ⅳ的混标没有发生光学诱导异构;而配好后在透明进样瓶中光照12 h的混标发生了光学诱导异构(图6b),苏丹红Ⅲ的异构率为3.016%,苏丹红Ⅳ的异构率为2.902%;将固体苏丹红标准品先光照12 h,再配制的20.00 mg/L的混标也发生了光学诱导异构(图6c),不过苏丹红III的异构率仅有0.543%,苏丹红Ⅳ的异构率仅有0.521%。这表明苏丹红标准溶液比固体的苏丹红标准品更容易发生光学诱导异构,可能是因为苏丹红标准品为固体,分子排列比较紧凑,接受光照的面积相对较小,而配成溶液后,苏丹红分子在溶液中分散比较均匀,能够充分得接受光照,因而光诱导异构更容易发生。

图6 不同处理方式的苏丹红标准品HPLC色谱图Fig.6 HPLC chromatogram of Sudan under different treatments注:(a)20.00 mg/L即用即配的苏丹红Ⅰ~Ⅳ的混标;(b)20.00 mg/L光照12 h的苏丹红Ⅰ~Ⅳ的混标;(c)苏丹红Ⅰ~Ⅳ的标准品光照12 h后配制的20.00 mg/L的混标。
2.5温度对苏丹红光学诱导异构的影响
由图7和表2可知5.00 mg/L的苏丹红Ⅰ~Ⅳ的混标在不同温度下光照24 h后光学诱导异构量(以快峰的面积计)并没有随着环境温度的下降或升高而产生很大的变化,因此可以认为苏丹红这类物质的热敏性较低,温度的变化对其光学异构的发生基本上没有影响。

图7 不同温度下5.00 mg/L的苏丹红Ⅰ~Ⅳ的混标光照24 h后的HPLC色谱图Fig.7 HPLC chromatogram of 5.00 mg/L Sudan Ⅰ~Ⅳ mixed standard solution after illumination 24 h at different temperature
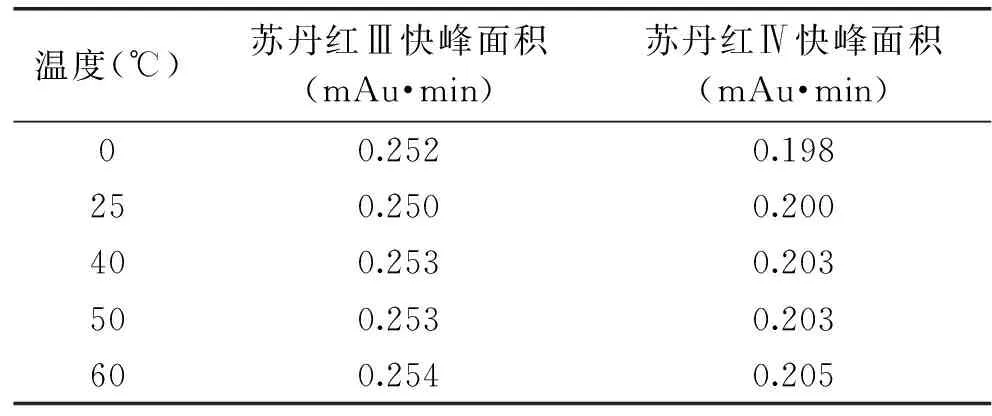
温度(℃)苏丹红Ⅲ快峰面积(mAu·min)苏丹红Ⅳ快峰面积(mAu·min)00.2520.198250.2500.200400.2530.203500.2530.203600.2540.205
2.6进样瓶对苏丹红光学诱导异构的影响
由图8可知,盛放在棕色和透明进样瓶中的20.00 mg/L的苏丹红Ⅰ~Ⅳ的混标光照20 h后都发生了光学诱导异构现象,但异变程度不同:棕色进样瓶中苏丹红的光学诱导异构量为苏丹红Ⅲ的快峰0.298 mAu·min,苏丹红Ⅳ的快峰0.304 mAu·min;透明进样瓶中苏丹红的光学诱导异构量为苏丹红Ⅲ的快峰0.573 mAu·min,苏丹红Ⅳ的快峰0.524 mAu·min。产生异变差异的原因可能由于棕色进样瓶透光性不及透明进样瓶好,因而所盛苏丹红溶液的光学诱导异构量低于透明进样瓶,但棕色进样瓶并不能完全隔绝光照,因而并不能避免光学诱导异构现象的发生。

图8 不同进样瓶盛装的20.00 mg/L的苏丹红Ⅰ~Ⅳ的混标光照20 h后的HPLC色谱图Fig.8 HPLC chromatogram of 20.00 mg/L SudanⅠ~Ⅳ mixed standard solution placed in different vial after illumination 20 h注:(a)棕色进样瓶;(b)透明进样瓶。
2.7光照方式对苏丹红光学诱导异构的影响
实际生活中添加苏丹红的基质样品大都曝露于室外日光以及室内灯光下,且连续光照时间受室外日夜交替以及室内作息时间的影响,多数情况下光照时间一般不超过12 h,所以考察日光照射和节能灯光照射12 h后苏丹红光学诱导异构的变化情况具有重要的意义。
由图9可以看出,日光和7 W的节能灯照射12 h后,1.00 mg/L的苏丹红Ⅰ~Ⅳ混标的光学诱导异构量相差不多,具体变化情况为:日光照射12 h后苏丹红的光学诱导异构量为苏丹红Ⅲ的快峰0.050 mAu·min,苏丹红Ⅳ的快峰0.043 mAu·min;7 W节能灯照射12 h后苏丹红的光学诱导异构量为苏丹红III的快峰0.048 mAu·min,苏丹红Ⅳ的快峰0.040 mAu·min。可见在相同的条件下,两种光照方式诱发苏丹红产生光学诱导异构的效应比较接近。
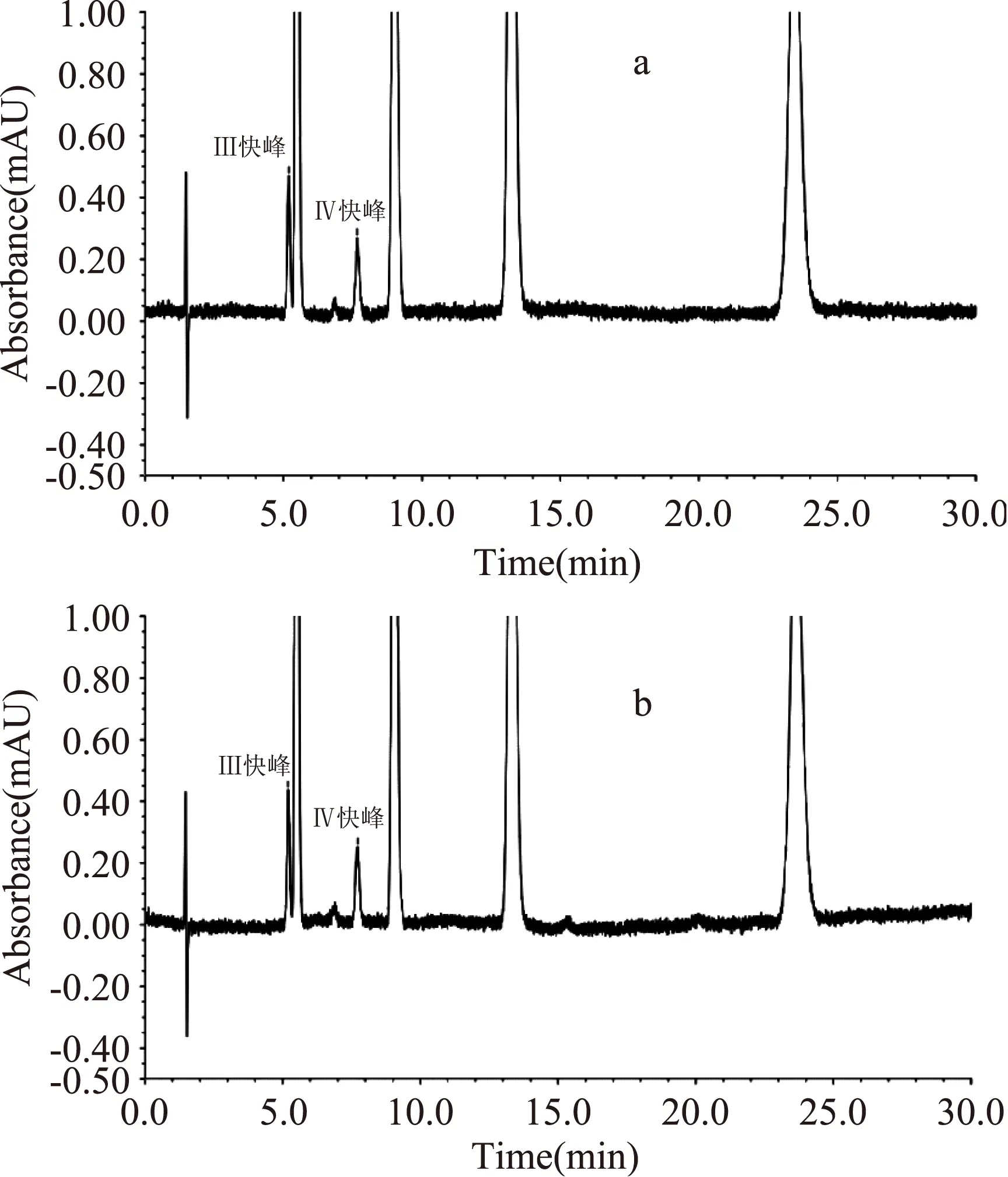
图9 不同光照方式处理的1.00 mg/L的苏丹红Ⅰ~Ⅳ的混标HPLC色谱图Fig.9 HPLC chromatogram of 1.00 mg/L Sudan Ⅰ~Ⅳ mixed standard solution under different light treatments注:(a)日光照射12 h;(b)7 W节能灯照射12 h。
2.8浓度对苏丹红光学诱导异构的影响
由于0.10 mg/L的苏丹红Ⅲ和Ⅳ的混标浓度较低,加上HPLC检测限的限制,导致光学诱导异构的异构量难以准确定量,所以仅对0.50 mg/L以上的4个浓度的苏丹红混标进行光学诱导异构量的分析。由图10可知,各浓度的苏丹红光学诱导异构量都呈现先增加后稳定的变化趋势,低浓度时(0.50、1.00 mg/L)的苏丹红Ⅲ和Ⅳ的混标在连续光照12 h后光学诱导异构量开始稳定,高浓度时(5.00、20.00 mg/L)的苏丹红Ⅲ和Ⅳ的混标在连续光照24 h后才趋于稳定,这说明苏丹红光学诱导异构平衡的时间和其浓度有关,浓度越高达到平衡所需要的时间越长。
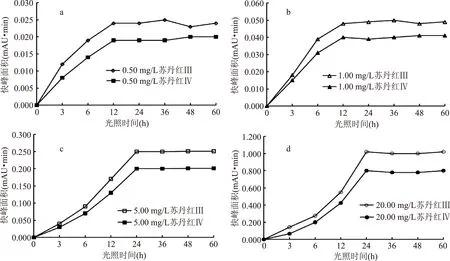
图10 不同浓度的苏丹红Ⅲ和Ⅳ的混标在不同光照时间下的光学诱导异构量Fig.10 Optical induced heterogeneous quantity of different concentration of Sudan Ⅲ and Ⅳ mixed standard solution at different illumination times
异构范围在实际的生活和检测工作中具有重要的应用价值。虽然苏丹红在不同的浓度和光照时间下的异构量不同,但在光学诱导异构平衡时的异构率却比较接近,研究表明0.50~20.00 mg/L的苏丹红Ⅲ和Ⅳ的混标在光学异构达到平衡时苏丹红Ⅲ的异构率为5.324%~5.787%,苏丹红Ⅳ的异构率为5.121%~5.507%。
3 结论
高效液相色谱法对苏丹红分析结果表明:苏丹红混标在光照后色谱图中会有两个快峰出现,光谱扫描证明两个快峰分别是由苏丹红Ⅲ和Ⅳ异构产生,即苏丹红Ⅲ和Ⅳ会产生光学诱导异构,苏丹红Ⅰ和Ⅱ不会产生光学诱导异构,发生光学诱导异构的苏丹红在避光24 h后异构部分会发生逆转;苏丹红标准溶液比固体苏丹红标准品更易发生光学诱导异构;温度的变化对苏丹红光学诱导异构的影响很小;棕色进样瓶只能在一定程度上抑制光学诱导异构的发生,但不能完全避免;日光和7 W的节能灯诱发苏丹红产生光学诱导异构的效应几乎相同;在一定的时间内,苏丹红光学诱导异构量会随光照时间的增加而增加,但最终会达到一个稳定值,浓度越高达到平衡所需要的时间越长,0.50、1.00 mg/L的苏丹红在光照12 h后异构趋于稳定,5.00、20.00 mg/L的苏丹红在光照24 h后异构趋于稳定;无论浓度高低,0.50、1.00、5.00、20.00 mg/L的苏丹红Ⅲ和Ⅳ在光学异构达到平衡时的异构率都比较接近,苏丹红Ⅲ光学异构平衡时的异构率为5.324%~5.787%,苏丹红Ⅳ光学异构平衡时的异构率为5.121%~5.507%。
[1]宋雁,李宁.食品中苏丹红的危险性评估[J].国外医学:卫生学分册,2005,32(3):129-132.
[2]XU H Y,Heinze T M,Chen S W,et al. Anaerobic Metabolism of 1-Amino-2-Naphthol-Based Azo Dyes(Sudan Dyes)by Human Intestinal Microflora[J]. Applied and Environmental Microbiology,2007,73(23):7759-7762.
[3]Rebane R,Leito I,Yurchenko S,et al. A review of analytical techniques for determination of Sudan I-IV dyes in food matrixes[J]. Chromatography A,2010,1217(17):2747-2757.
[4]庞艳玲,王怀友.薄层色谱-紫外可见分光光度法测定食品中的苏丹红I号[J].分析实验室,2008,27(1):60-62.
[5]王鲜俊,缪红,文君.薄层色谱法测定海椒面中的苏丹红[J].中国卫生检验杂志,2005,15(12):1475-1476.
[6]窦红,张晓鑫,高春平.薄层色谱法检测苏丹红[J].河北工业科技,2009,26(2):90-94.
[7]Lin H G,Li G,Wu K B,et al. Electrochemieal determination of Sudan I using montmorillonite calcium modified carbon paste eleetrode[J]. Food Chemistry,2008,107(1):531-536.
[8]Ju C M,Tang Y,Fan H Y,et al. Enzyme-linked immunesorbent assay(ELISA)using a specific monoelonal antibody as a new tool to detect Sudan dyes and Para red[J]. Analytica Chimica Acta 2008,621(2):200-206.
[9]Cornet V,Govaert Y,Moens G,et al. Development of a fast analytical method for the determination of Sudan dyes in chili-and curry-containing foodstuffs by high-performance liquid chromatography-photodiode array detection[J]. Agricultural and Food Chemistry,2006,54(3):639-644.
[11]Noguerol-Cal R,Lopez-Vilarino J M,Fernandez-Martinez G,et al. High-performance liquid chromatography analysis of ten dyes for control of safety of commercial articles[J]. Chromatography A,2008,1179(2):152-160.[12]Zacharis C K,Kika F S,Tzanavaras P D,et al. Development and validation of a rapid HPLC method for the determination of five banned fat-soluble colorants in spices using a narrow-bore monolithic column[J].Talanta,2011,84(2):480-486.
[13]何荣,廖林川,颜有仪,等.血液中苏丹红染料的高效液相色谱分析[J].分析试室,2008,27(7):751-754.
[14]刘珺,弓振斌.高效液相色谱-柱后在线光化学衍生荧光检测法测定辣椒油中4种苏丹红染料[J].色谱,2012,30(6):624-629.
[15]黄晓兰,吴惠勤,黄芳,等. GC-MS/SIM法同时测定食品中的苏丹红Ⅰ~Ⅳ[J].分析测试学报,2005,24(4):1-5.
[16]Erdemir U S,Izgi B,Gucer S,et al. An alternative method for screening of Sudan dyes in red paprika paste by gas chromatography-mass spectrometry[J].Analytical Methods,2013,5(7):1790-1798.
[17]王鹏,郭少飞,荆涛,等.基质固相分散液相色谱-串联质谱法检测禽蛋中的苏丹红[J].色谱,2008,26(3):353-357.
[18]Murty MRVS,Chary NS,Prabhakar S,et al. Simultaneous quantitative determination of Sudan dyes using liquid chromatography-atmospheric pressure photoionization-tandem mass spectrometry[J]. Food Chemistry,2009,115(4):1556-1562.
[19]Mejia E,Ding Y S,Mora M F,et al. Determination of banned sudan dyes in chili powder by capillary electrophoresis[J].Food Chemistry,2007,102(4):1027-1033.
[20]Mölder K,Künnapas A,Herodes K. “Fast peaks” in chromatograms of Sudan dyes[J]. Chromatography A,2007,1160(1-2):227-234.
Study on optical induced heterogeneous phenomenon of Sudan based on HPLC detection
SHAO Ming-hua,JIANG Chen-zhou*,ZHANG Chi-zhong,FU Jia-ping,WANG Li-juan
(ANPEL Scientific Instrument(Shanghai)Co.,Ltd.,Shanghai 201608,China)
Determination and optical induced heterogeneous phenomenon of Sudan was studied using a Shimadzu LC-20AB liquid chromatograph equipped with a SPD-M20A diode array detector. Chromatographic separations were performed using a CNW Athena C18-WP(4.6 mm×150 mm,5 μm)column,the column temperature was 30 ℃. The mobile phase consisted of acetonitrile-water(88∶12 by volume)and was delivered at a flow rate of 1.0 mL/min with equivalent elution. The detection wave length was 500 nm. The results showed that Sudan Ⅰ-Ⅳ were linear within a range of 0.10~20.00 mg/L,and the correlation coefficient was 1.0000. Sudan Ⅰ and Ⅱ could not occur optical induced heterogeneous phenomenon,but Sudan Ⅲ and Ⅳ could. Optical induced heterogeneous of Sudan was a reversible change,and it could be reversed when there was no illumination condition. Sudan standard solution was more easily to occur optical induced heterogeneous than solid Sudan standard. Temperature had little effect on optical induced heterogeneous of Sudan in the range of 0~60 ℃. Illumination had a significant effect on optical induced heterogeneous phenomenon of Sudan,the degree was brown vial>sunlight=7 W energy saving light. Concentration of Sudan also had a significant impact on its optical induced heterogeneous phenomenon. The higher the concentration,the longer the time that heterogeneous tended to stable needed. Within the range of 0.50~20.00 mg/L,optical induced heterogeneous rate of Sudan III was 5.324%~5.787% in the state of heterogeneous balance,and Sudan Ⅳ was 5.121%~5.507% under that condition. The study had important reference value in research and application of Sudan detection methods.
HPLC;Sudan;optical induced heterogeneous
2016-02-26
邵明华(1968-),男,本科,研究方向:分析化学,E-mail:shaominghua@anpel.com.cn 。
江晨舟(1983-),男,硕士,研究方向:分析化学,E-mail:brucehom@126.com。
TS201.2
A
1002-0306(2016)17-0142-07
10.13386/j.issn1002-0306.2016.17.019
