亚临界水中反应参数对ε-聚赖氨酸与葡聚糖美拉德反应的影响
2012-10-26李春林高彦祥王莹莹陶一荻张晓菲
李春林,高彦祥,袁 芳,王莹莹,陶一荻,张晓菲
(中国农业大学食品科学与营养工程学院,北京 100083)
亚临界水中反应参数对ε-聚赖氨酸与葡聚糖美拉德反应的影响
李春林,高彦祥*,袁 芳,王莹莹,陶一荻,张晓菲
(中国农业大学食品科学与营养工程学院,北京 100083)
研究了亚临界水温度、压力、时间、pH、反应物质量比对ε-聚赖氨酸与葡聚糖之间的美拉德反应速率的影响。通过测定接枝度和褐变指数评价各种因素对美拉德反应的影响。结果表明,褐变指数与温度、时间、pH呈正相关,与压力呈负相关;时间、pH、反应物质量比对接枝度的影响均是先增大后减小。
亚临界水,美拉德反应,接枝度,褐变指数
ε-聚赖氨酸(ε-Polylysine,ε-PL)是经白色链霉菌(Strptomyces albulus)发酵产生的一种均聚氨基酸。ε-PL对革兰氏阳性、阴性菌和真菌等都具有一定的抑制作用,已于2003年10月被FDA批准为安全食品防腐剂[1]。然而在实际应用中,ε-聚赖氨酸易于与蛋白质和酸性多糖发生相互作用,从而导致其抑菌性能的降低,且ε-聚赖氨酸乳化性较差,因而主要用于淀粉基类食物中[2]。近年来,国外学者研究发现通过美拉德反应形成的蛋白质-多糖共价复合物的乳化性及其他特性显著提高。如Kato等[3]发现用葡聚糖与溶菌酶进行美拉德反应后,溶菌酶的乳化性和热稳定性都有所提高,而且对革兰氏阳性菌(G+菌)和革兰氏阴性菌(G-菌)均有抑制作用。在传统条件下,美拉德反应速度慢,达到理想反应程度一般需要数天或者更长,在实际应用中受到了极大的限制[4]。研究表明,外加物理场可以明显提高蛋白质多糖共价复合反应速率,加速复合产物的形成。目前,国内外学者主要集中研究微波[5]、超高压[6]、超声波[7-8]以及超临界CO[9]2对蛋白质-多糖共价复合反应的影响,而关于亚临界水对蛋白质-多糖共价复合反应的影响研究较少。亚临界水,亦称作超热水、高压热水,即通过调节适当的压力,将水加热到100℃以上临界温度(374℃)以下的高温,仍然维持在液体状态[10]。作为一种新型的萃取溶剂,亚临界水已被广泛运用于植物材料中多酚[11]、精油[12]、蛋白质[13]、多糖[14]等活性物质的分离提取。提取有效成分的同时,处于亚临界水环境中的化学成分在高温条件下也可能会发生相互作用,形成与目标产物结构和性质不同的新物质。如原料中的蛋白质和碳水化合物在高温水溶液中易于发生美拉德反应而引起褐变,对于两者含量丰富的原料尤为显著。然而对亚临界水中美拉德反应的研究较少,仅有Merichel等[15]报道了氨基酸和葡萄糖在亚临界介质中反应的可能性,但并未对影响美拉德反应的各种因素进行系统的研究。本文以ε-聚赖氨酸和葡聚糖为实验原料,以接枝度和褐变指数为指标,研究亚临界水环境中压力、温度、时间、pH、反应底物配比等因素对美拉德反应的影响。
1 材料与方法
1.1 材料与仪器
ε-聚赖氨酸 浙江银象生物工程有限公司;葡聚糖(35~45u) Sigma公司;邻苯二甲醛(OPA)北京金龙化学试剂有限公司,化学纯;磷酸二氢钠、磷酸氢二钠、氢氧化钠、甲醇、十二烷基磺酸钠(SDS)等 分析纯。
CWYF亚临界水萃取装置 江苏华安是由科研仪器设备有限公司;AR1140分析天平 上海奥豪斯国际贸易有限公司;UV-1800紫外可见分光光度仪
日本岛津公司;DSHZ-300恒温水浴锅 江苏太仓市实验设备厂。
1.2 实验方法
1.2.1 温度对反应接枝度和褐变指数的影响 ε-聚赖氨酸与葡聚糖按照质量 1∶15的比例溶解于0.067mol·L-1的pH 8.5磷酸缓冲液中,其中ε-聚赖氨酸浓度为0.2%(W/V)。将以上所配制反应液置于亚临界反应装置中,通入N2并维持5MPa的压力下反应60m in。反应温度分别设定为90、100、110、120、130℃。
1.2.2 压力对反应接枝度和褐变指数的影响 ε-聚赖氨酸与葡聚糖按照1∶15的比例溶解于0.067mol·L-1的pH 8.5磷酸缓冲液中,其中ε-聚赖氨酸浓度为0.2% (W/V)。将以上所配制反应液置于亚临界反应装置中,110℃下反应60m in。反应压力分别设定为0、2.5、5.0、7.5、10.0MPa。
1.2.3 pH对反应接枝度和褐变指数的影响 反应pH分别设定为7.0、7.5、8.0、8.5、9.0。ε-聚赖氨酸与葡聚糖按照1∶15的比例溶解于0.067mol·L-1的不同pH的磷酸缓冲液中,其中 ε-聚赖氨酸浓度为0.2%(W/V)。将以上所配制反应液置于亚临界反应装置中,于110℃,5MPa的压力下反应60m in。
1.2.4 时间对反应接枝度和褐变指数的影响 ε-聚赖氨酸与葡聚糖按照1∶15的比例溶解于0.067mol·L-1的pH 8.5磷酸缓冲液中,其中聚赖氨酸浓度为0.2% (W/V)。将以上所配制反应液置于亚临界反应装置中,110℃、5MPa下反应。反应时间分别设定为30、45、60、75、90m in。
1.2.5 ε-聚赖氨酸/葡聚糖质量比对反应接枝度和褐变指数的影响 设定反应物中总质量为3.2%,调节葡聚糖与ε-聚赖氨酸的质量比值分别为2.5∶1、5∶1、10∶1、15∶1、20∶1。反应时间设定为110℃、5MPa下反应60m in。
1.2.6 自由氨基含量的测定 采用OPA法计算自由氨基含量。参照文献[16]的方法基础上略微改进。准确称取40mg的OPA溶解于1m L的甲醇中,分别加入 20%(w/w)的 SDS 2.5m L,0.1mol/L的硼砂25m L及100μLβ-巯基乙醇,最后用蒸馏水定容到50m L,此为OPA试剂,且使用前即时配制。
测定时,取OPA试剂4m L置于试管中,注入200μL样品液,混匀后于35℃反应2min,在340nm下测其吸光值A340,以在OPA试剂中加入200μL水作为空白。以赖氨酸作出标准曲线,计算自由氨基含量。
1.2.7 接枝度的计算[17]接枝度(Degree of Graft,DG)计算公式如下:

其中:C0为未反应时自由氨基总量;Ct为反应t时刻自由氨基的含量。
1.2.8 褐变程度的测定 参照文献[18],准确称量不同条件下的反应产物的冻干粉,配制成蛋白质含量为0.2%的溶液。通过紫外可见分光光度计测定420nm处的吸光值表示褐变程度。
2 结果与分析
2.1 温度对反应接枝度和褐变指数的影响
由图1可以看出,A420吸光值随着反应温度的升高而增大。其中90~110℃范围内吸光值增长较为缓慢(A420<0.1),当温度升高到120~130℃时,A420急剧增大到0.3以上,褐变比较明显。
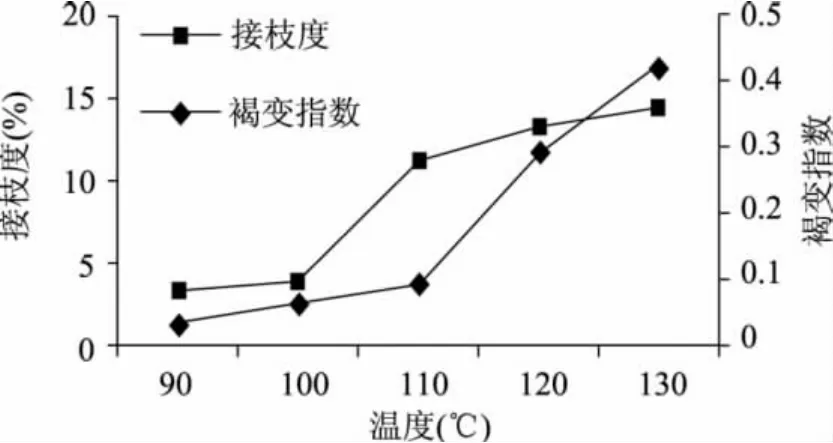
图1 温度对接枝度和褐变指数的影响Fig.1 Effect of temperature on graft and browning index
ε-聚赖氨酸与葡聚糖的接枝度随着温度的升高而增大。温度越高,反应速度越快,在相同的反应时间内反应程度越高。其中90~100℃之间,接枝度较低;当温度升高到110℃时,接枝度由3.6%增大到11.3%。这是因为亚临界水中,维持一定压力,升高温度可以显著减小水的表面张力和粘度,从而提高了溶质在其中的传质系数[19],增加了底物分子在溶液中热运动速率,从而提高了碰撞机率。
2.2 压力对接枝度和褐变指数的影响
从图2可以看出,随着压力的增大,接枝度变化不明显,可能是研究所用 ε-聚赖氨酸仅仅是由20~30个赖氨酸分子组成的肽段,分子结构简单,缺乏复杂的三四级结构,施加压力并不会对其结构产生影响,所以不会改变其暴露在溶液中的活性基团的浓度。但是A420吸光值却随着压力增大而逐渐降低,说明增大压力会抑制美拉德反应后期类黑精物质的产生,从而减小溶液的褐变程度。Neil等[20]研究压力对色氨酸与木糖等反应的影响时,发现压力抑制类黑精物质形成的原因是阻止了阿姆德瑞重排产物(Amadori rearrangement product)的降解,进而阻止了美拉德反应后期类黑精的生成。
2.3 时间对接枝度和褐变指数的影响
由图3可以看出,A420随着反应时间的延长而升高,当反应时间达到75m in时,吸光值达到0.12。蛋白质与多糖的反应是建立在两者活性基团的充分暴露和相互接触的基础之上,葡聚糖是多糖,分子较大,与ε-聚赖氨酸的结合存在着一定的空间位阻。随着反应时间的延长,ε-聚赖氨酸的氨基与葡聚糖的醛基受热逐步结合,反应程度提高。所以接枝度随着反应时间的延长而逐渐升高。当反应时间超过75m in时,又有所降低,可能是由于加热时间过长,从而导致聚赖氨酸的降解,或者反应基团的破坏,从而影响了两者的反应。
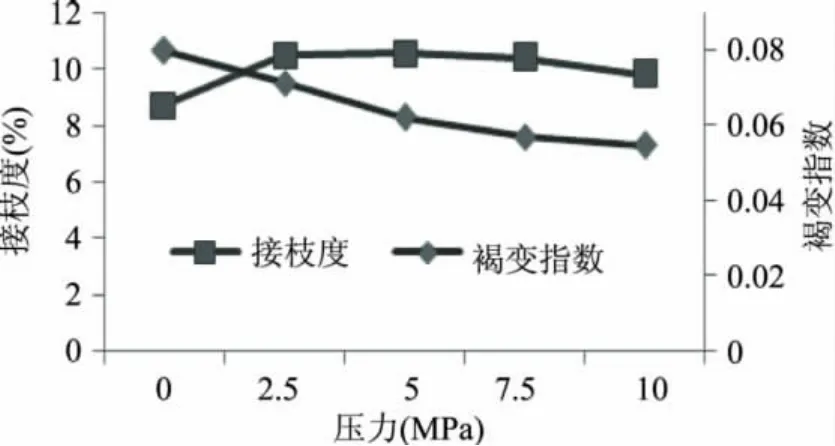
图2 压力对接枝度和褐变指数的影响Fig.2 Effect of pressure on graft and browning index
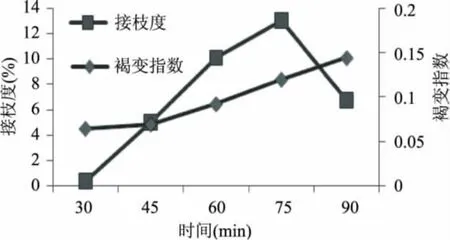
图3 时间对接枝度和褐变指数的影响Fig.3 Effect of time on graft and browning index
2.4 pH对接枝度和褐变指数的影响
从图4可以看出,随着pH增大,褐变程度逐渐加深,接枝度增大。当pH高于8.5时,褐变指数随pH的升高而急剧增大,这是因为美拉德反应本质上是一种碱催化反应,碱性越强,越容易发生反应,接枝度越大,褐变越严重;而中性和偏酸性,氨基易于质子化,不利于亲和反应的发生[21],因此阻碍美拉德反应的进行。但是碱性过强,则有可能会引起蛋白质一级结构的变化,如脱胺、脱羧等,反而不利于反应的进行[22]。在pH=9.0时,ε-聚赖氨酸处于等电点附近,溶解度有所降低,溶液中活性氨基浓度降低,因此接枝度有所下降,但在此条件下,葡聚糖发生焦糖化反应,因而褐变指数继续增大。
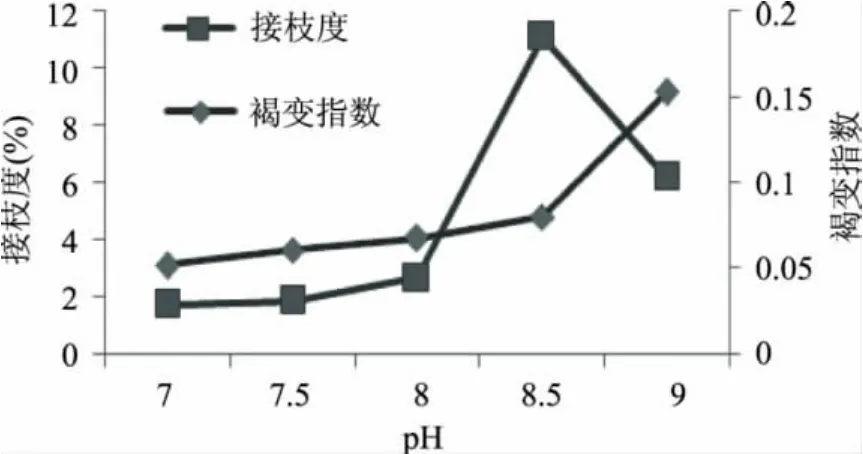
图4 pH对接枝度和褐变指数的影响Fig.4 Effect of pH on graft and browning index
2.5 ε-聚赖氨酸/葡聚糖质量比对接枝度和褐变指数的影响
蛋白质与多糖的美拉德反应在活性基团之间进行。ε-聚赖氨酸分子量低,且自由氨基含量丰富,葡聚糖含量较低时,大量的自由氨基处于非饱和状态而不能充分反应;葡聚糖分子量较大,引起空间位阻较大,且反应基团少;当葡聚糖含量较多时,溶液粘度增大,同时由于大分子的空间稳定作用,使得活性位点不易靠近[23]。所以合适的反应物配比不但可以促使反应快速充分的进行,还可以降低副反应(焦糖化等)的发生。由图5可以看出,接枝度随着两者比值的变化呈现先增加后减小的趋势,当两者比值达到15∶1时,反应物之间反应基团的结合达到最佳状态,接枝度达到最大,且褐变指数相对较低。

图5 ε-聚赖氨酸/葡聚糖质量比对反应的影响Fig.5 Effect of substrate ratio on graft and browning index
3 结论
本文研究了亚临界水中蛋白质多糖的美拉德反应,为实现蛋白质-多糖共价复合物的快速制备提供了新的途径。通过实验表明,反应温度、时间、pH、反应物配比对接枝度都有显著的影响,而适当地提高压力则可以减轻褐变的发生。同时研究了亚临界水环境中各种因素对美拉德反应的影响,对于亚临界水提取目标活性物质过程中,抑制或促进美拉德反应同样具有重要意义。
[1]刘蔚,周涛.ε-聚赖氨酸抑菌机理研究[J].食品科学,2009,30(9):15-20.
[2]Otsuka N,Kuwahara Y,Manabe M.Effect of e-polylysine on preservation of boiled noodles[J].Nippon Shokuhin Kogyo Gakkaishi,1992,39:344-347.
[3]Nakamura S,Kato A,Kobayashi K.New antimicrobial characteristics of lysozyme-dextran conjugate[J].J Agric Food Chem,1991,39:647-650.
[4]Laura J C,Rosina L F,Agustín O,et al.Study onβlactoglobulin glycosylation with dextran:effect on solubility and heat stability[J].Food Chemistry,2005,93:689-695.
[5]Tsubokura Y,Fukuzaki S,Noma S,et al.Glycation of ovalbumin in solid-state by conductive and microwave heating[J].Food Science and Technology Research,2009,15(4): 377-380.
[6]Schwarzenbolz U,Klostermeyer H,Henle T.Maillard reaction under high hydrostatic pressure:studies on the formation of protein-bound amino acid derivatives[J].Int Congress Series,2002,1245:223-227.
[7]Guan Y G,Zhang B S,Yu S J,et al.Effects of ultrasound on a glycin-glucose model system-A means of promoting maillard reaction[J].Food Bioprocess Technology,2009:1-8.
[8]Mu L X,Zhao M M,Yang B,et al.Effect of ultrasonic treatment on the graft reaction between soy protein isolated and gum acacia and on the physicochemical properties of conjugates[J].JAgric Food Chem,2010,58:4494-4499.
[9]Casal E,Ramirez P,Ibanez E,et al.Effect of supercritical carbon dioxide treatment on the Maillard reactionin model food systems[J].Food Chemistry,2006,97(2):272-276.
[10]Ramos L,Kristenson E M,Brinkman U A T.Current use of pressurized liquid extraction and subcritical water extraction in environment analysis[J].Journal of Chromatography A,2002,975 (1):3-29.
[11]Ju Z Y,Howard L R.Subcritical water and sulfured water extraction of anthocyanins and other phenolics from dried red grape skin[J].Journal of food science,2005,70(4):270-276.
[12]Jimenez C M,Ubera J L,Luque C M D.Comparison of continuous subcritical water extraction and hydrodistillation of marjoram essential oil[J].Journal of Chromatography A,1999,855(2):625-632.
[13]Sereewatthanawut I,Prapintip S,Watchiriaruji K,et al. Extraction of protein and amino acids from deoiled rice bran by subcriticalwater hydrolysis[J].Bioresource Technology,2008,99 (3):555-561.
[14]MoreschiSRM,Petenate A J,Meireles M A A.Hydrolysis of ginger bagasse starch in subcritical water and carbon dioxide[J].Journal of Agricultural and Food Chemistry,2004,52(6): 1753-1758.
[15]Merichel P,Miryam A B,María D C,et al.Neoformation of antioxidants in glycation model systems treated under subcritical water extraction conditions[J].Food Research International,2010,43:1123-1129.
[16]Brands C,Van Boekel.Kinetic modeling of reactions in heated disaccharide-casein systems[J].Food Chemistry,2003,83:13-26.
[17]Brands C M J,Van Boekel M A J S.Kinetic modelling of reactions in heated disaccharide-casein systems[J].Food Chemistry,2003,83:13-26.
[18]Li Y,Lu F,Luo C R,et al.Functional properties of the Maillard reaction products of rice protein with sugar[J].Food Chemistry,2009,117:69-74.
[19]Ramos L,Kristenson E M,Brinkman U A.Current use of pressurized liquid extraction and subcritical water extraction in environmental analysis[J].Journal of chromatography A,2002,975(1):3-29.
[20]Neil S I,Mark C.Effect of pressure on processes modeling themaillard reaction[J].Journal of physical organic chemistry,1996(9):639-644.
[21]孙丽平,汪东风,徐莹,等.pH和加热时间对美拉德反应挥发性产物的影响[J].食品工业科技,2009(4):122-125.
[22]管军军,裘爱泳,刘晓亚.微波辐射大豆分离蛋白-糖接枝反应条件的研究[J].食品与技术生物学报,2005,24(5): 16-20.
[23]Castaño L J,Villamiel M,Fandiño R L.Glycosylation of individual whey proteins by Maillard reaction using dextran of different molecular mass[J].Food Hydrocolloids,21(3): 433-443.
Effect of different parameters on maillard reaction betweenε-polylysine and dextran under subcriticalwater environment
LIChun-lin,GAO Yan-xiang*,YUAN Fang,WANG Ying-ying,TAO Yi-di,ZHANG Xiao-fei
(College of Food Science&Nutritional Engineering,China Agricultural University,Beijing 100083,China)
The effec ts of tem perature,p ressure,tim e,pH,substrate ratio under subc riticalwater environment on the maillard reaction betweenε-polylysine and dextran were researched.Degree of graft and browning index were introduced to evaluate the effects of different factors on the speed of maillard reaction.The results showed that b rowning index was positively correlated w ith tem perature,time and pH,but it was negatively correlated w ith p ressure.Deg ree of g raft increased first and then decreased under the effect of time,pH,substrate ratio.
subc riticalwater;maillard reac tion;deg ree of g raft;b rowning index
TS201.2
B
1002-0306(2012)02-0261-04
2011-03-23 *通讯联系人
李春林(1987-),男,硕士研究生,研究方向:食品添加剂。
国家自然科学基金资助项目(31071609)。
