缺氧应激对HepG-2细胞AFP和ICAM-1表达的影响
2012-10-16卢根林闫兴军
卢根林,邓 勇,闫兴军
(1.义乌市中心医院,浙江 义乌322000;2.青海大学附属医院,青海 西宁810001)
缺氧应激对HepG-2细胞AFP和ICAM-1表达的影响
卢根林1,邓 勇2,闫兴军1
(1.义乌市中心医院,浙江 义乌322000;2.青海大学附属医院,青海 西宁810001)
目的:探讨缺氧应激对HepG-2细胞甲胎蛋白(alpha fetoprotein,AFP)和细胞间粘附分子(intercellular adhesion molecule,ICAM)-1表达的影响。方法:缺氧(5%O2、5%CO2、90%N2)和常氧培养 HepG-2细胞。细胞侵袭实验测定HepG-2细胞侵袭能力;四甲基偶氮唑蓝(MTT)比色法测定细胞增殖活性;逆转录聚合酶链反应技术测定常氧组和缺氧12、24h组 HepG-2细胞AFPmRNA和ICAM-1mRNA的表达量。流式细胞仪技术测定ICAM-1蛋白表达,放射免疫法测定HepG-2细胞培养上清AFP蛋白表达。结果随着缺氧时间的延长HepG-2细胞的侵袭能力、增殖活性、AFP、ICAM-1 mRNA和蛋白表达量明显增高(P<0.01)。结论:缺氧应激下人HepG-2细胞侵袭能力增强的机制之一是ICAM-1基因表达上调;HepG-2细胞增殖活性增强的机制之一是HepG-2细胞AFP基因的表达上调。
缺氧应激;HepG-2细胞;甲胎蛋白;细胞间粘附分子-1
肿瘤侵袭、转移是多因素、多步骤的生物学过程,其发生有赖于肿瘤细胞运动侵袭能力增强、不同时相细胞粘附与解粘附、降解并穿过细胞外基质进入血液和淋巴循环[1]。实体瘤存在着缺氧的局部微环境,缺氧时肿瘤细胞增殖活性、侵袭和转移能力增强,糖酵解途径上调、对化疗药物耐药性增强,对放疗敏感下降[1]。本研究模拟肝癌缺氧微环境,探讨缺氧应激对人肝癌细胞HepG-2细胞侵袭能力和增殖活性和AFP、ICAM-1表达的影响。
1 材料与方法
1.1 细胞株和主要试剂
人肝癌细胞株HepG-2引自兰州军区总医院实验科(来源于美国国立肿瘤研究所),胎牛血清为杭州四季青生物工程公司产品,MTT、DMSO和胰蛋白酶均为美国Sigma产品,RT-PCR Kit购于Takara公司,Trizol为Invitrogen公司产品。人β-肌动蛋白(β-actin)、AFP和ICAM-1基因聚合酶链反应引物序列如下:β-actin上游引物 5′-GTACCACTGGCATCGTGATGGACT-3′,下游引物 5′-ATCCACACGGAGTACTTGCGCTCA-3′,目的片段长 度 为600bp;AFP 上游引物 5′-GTTCCAGAACCTGTCACAAG-3′,下 引 物 5′-CTTTGTTTGGAAGCATTCAACTGC-3′,目的片段长度为 193bp;ICAM-1 上游引物 5′-TGGTAGCAGCCGCAGTCATA-3′,下引物 5′-CTCCTTCCTGGCTTAGT-3′,目的片段长度为377bp;由Invitrogen公司合成。兔抗人 ICAM-1多克隆抗体,羊抗兔IgG-FITC荧光标记二抗均购自武汉博士德公司,AFP试剂盒由上海生物制品研究所提供。
1.2 体外细胞培养及实验分组
人HepG-2细胞置灭活10%胎牛血清、100u/ml青霉素和100μg/ml链霉素的RPMI1640培养液,于37℃、5%CO2培养箱中培养,每3-5天传代一次。缺氧12、24小时组 HepG-2细胞置37℃、5%O2、5%CO2、90%N2三气培养箱中分别培养 12、24h。
1.3 HepG-2细胞增殖活性检测[2]
用四甲基偶唑蓝(MTT)比色法检测细胞增殖活性的变化,设置无细胞孔做空白对照,置Bio-Tek酶标仪上选择490nm波长读吸光度(A),各孔的A值=各孔所测A值-空白对照孔所测A值。
1.4 细胞侵袭实验[3]
Matrigel(30μg/孔)铺于Transwell小室8μm聚碳酸酯微孔滤膜上、过夜干燥并水化Matrigel。Transwell上室为2×105个HepG-2细胞(细胞活力>95%),下室为含 10μg/ml Fibronectin完全培养基600μl,每组设 6 个平行孔,37℃常氧或缺氧孵育12h、24h。取出 Transwell小室,PBS洗 2次,用灭菌棉签擦去滤膜上表面未穿膜的细胞和Matrigel,95%酒精固定15分钟,HE染色,随机选择10个100×视野并计数。
1.5 各组HepG-2细胞AFP、ICAM-1mRNA表达
Trizol一步法提取细胞总RNA,电泳见28S、18S条带,以 2.5μg总 RNA为模板,以 Takara公司的Random Premier为引物进行逆转录反应合成cDNA。AFP和β-actin PCR的反应条件为:95℃预变性3分钟后,95℃ 变性 30s、60℃退火 30s、72℃延伸 50s共35个循环,72℃延伸7分钟。ICAM-1和β-actin PCR的反应条件为:95℃预变性3分钟后,95℃ 变性30秒、57℃退火30秒、72℃延伸50秒共35个循环,72℃延伸7分钟。PCR产物经1.5%琼脂糖凝胶电泳,以 AFP/β-actin和 ICAM-1/β-actin值分别表示AFP、ICAM-1 mRNA含量。
1.6 各组HepG-2细胞ICAM-1蛋白表达
1.6.1 培养细胞和取样取对数生长期的HepG-2细胞,按每孔5×105个接种于6孔板,常氧组HepG-2细胞于常氧培养24小时;缺氧12、24小时组HepG-2细胞于缺氧培养12、24小时,收集细胞,离心,PBS洗涤2次,用75%冷乙醇(4℃)固定,4℃保存。
1.6.2 采用免疫荧光间接法 检测细胞前经1500rpm离心5分钟,弃去乙醇,PBS洗涤2次,加20μl(1:20)兔抗人ICAM-1抗体,37℃水浴30分钟,PBS洗涤2次,加20μl(1:50)羊抗兔IgG-FITC荧光标记二抗,另设不加ICAM-1抗体只加IgGFITC荧光标记二抗作为空白对照组,37℃水浴30分钟,PBS洗涤2次,4℃保存,待测。
1.6.3 流式细胞仪检测 采用美国Becton-Dickson公司的FACSan流式细胞仪进行检测,每样品收集1×105个细胞,用 Clifit软件进行分析,参照Morkve[4]等提出的荧光指数(Fluorescence index,FI)表示ICAM-1蛋白的相对含量。
1.7 各组HepG-2细胞培养上清AFP含量的测定
取处于对数生长期的HepG-2细胞,按每孔1×105个细胞接种于24孔培养板,常氧组HepG-2细胞于常氧培养24小时;缺氧12、24小时组HepG-2细胞于缺氧培养12、24小时;吸取细胞培养上清经1000rpm离心15分钟,取上清用于AFP含量的RIA检测。
1.8 统计学处理
应用SPSS13.0统计软件进行统计学分析,计量资料用表示,多样本均数比较采用单因素方差分析,多样本均数间两两比较用q检验。
2 结 果
2.1 HepG-2细胞AFP、ICAM-1mRNA表达
常氧组和缺氧12h、24小时组总RNA的28S/18S=2:1,表明所提取的总RNA完整性好,可用于RT-PCR实验。图1、2和表1示:随着缺氧时间的延长HepG-2细胞的AFP、ICAM-1 mRNA表达量明显增高(P<0.01),两者正相关(r=0.754,P<0.05)。提示缺氧应激上调 HepG-2细胞 AFP、ICAM-1 mRNA表达。
2.2 HepG-2细胞AFP、ICAM-1蛋白表达
随着缺氧时间的延长HepG-2细胞的AFP、ICAM-1蛋白表达量明显增高(P<0.01),两者正相关(r=0.769,P<0.05)。提示缺氧应激上调HepG-2细胞 AFP、ICAM-1蛋白表达(见表1)。
表1 缺氧应激对HepG2细胞ICAM-1及AFP分子表达的影响(N=6,±SD)
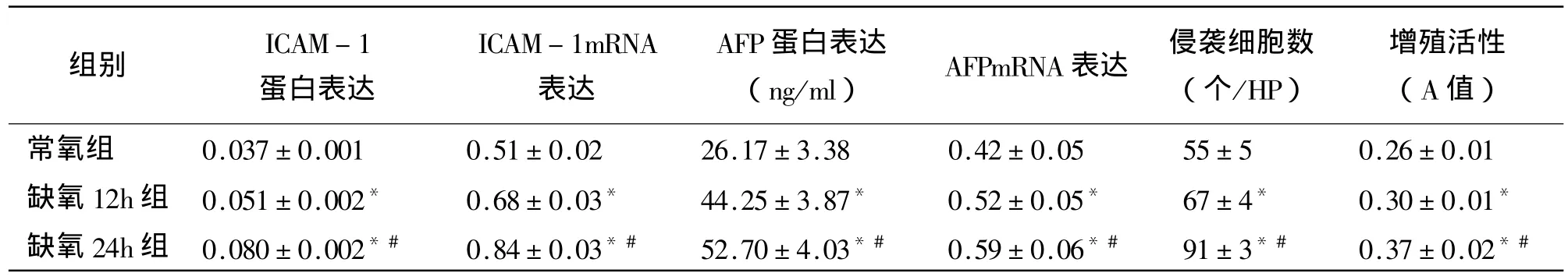
表1 缺氧应激对HepG2细胞ICAM-1及AFP分子表达的影响(N=6,±SD)
注:*:与常氧组比较P<0.01;#:与缺氧12h组比较 P<0.01
值)常氧组 0.037±0.001 0.51±0.02 26.17±3.38 0.42±0.05 55±5 0.26±0.01缺氧12h组 0.051±0.002* 0.68±0.03* 44.25±3.87* 0.52±0.05* 67±4* 0.30±0.01*缺氧24h组 0.080±0.002*# 0.84±0.03*# 52.70±4.03*# 0.59±0.06*# 91±3*# 0.37±0.02*#组别 ICAM-1蛋白表达ICAM-1mRNA表达AFP蛋白表达(ng/ml) AFPmRNA表达 侵袭细胞数(个/HP)增殖活性(A
2.3 缺氧应激下HepG-2细胞增殖活性的改变
表1显示:随着缺氧时间的延长HepG-2细胞的增殖活性明显增高(P<0.01)。HepG-2细胞增殖活性与 AFP蛋白及 mRNA表达呈正相关(r=0.691、0.781,P <0.01)。
2.4 缺氧应激下HepG-2细胞侵袭力的改变
表1显示:随着缺氧时间的延长HepG-2细胞的侵袭能力明显增高(P<0.01)。侵袭力和ICAM-1蛋白及mRNA表达呈正相关(r=0.742、0.754,P <0.01)。
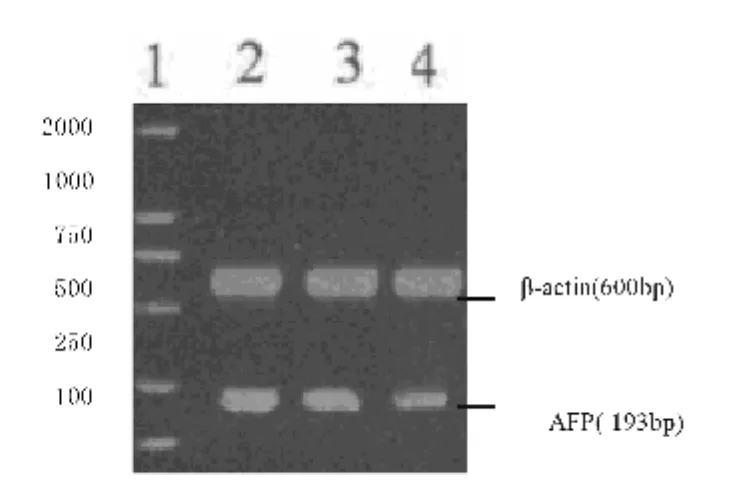
图1 HepG-2细胞AFP mRNA表达

图2 HepG-2细胞ICAM-1 mRNA表达
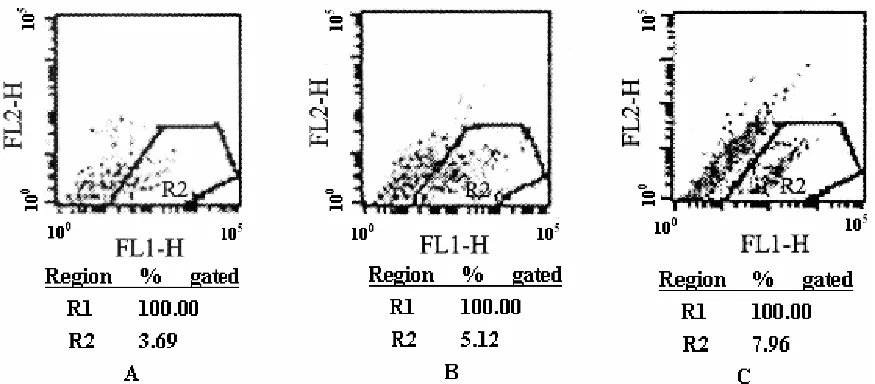
图3 A、B、C分别表示常氧、缺氧12h、24hHepG-2细胞ICAM-1蛋白表达
3 讨 论
肿瘤侵袭、转移是多因素、多步骤的生物学过程,其发生有赖于肿瘤细胞运动侵袭能力增强、不同时相细胞粘附与解粘附、降解并穿过细胞外基质进入血液和淋巴循环[1]。实体瘤存在着缺氧的局部微环境,缺氧时缺氧诱导因子(hypoxia inducible factor,HIF)-1α基因表达上调,转位到细胞核内与HIF-1β形成异二聚体HIF-1,HIF-1与其靶基因启动子或增强子的缺氧反应元件(hypoxia response element,HRE)5′-ACGTGC-3′结合,上调靶基因的表达,使肿瘤细胞增殖活性、侵袭和转移能力增强,糖酵解途径上调、对化疗药物耐药性增强,对放疗敏感下降[1]。前期的研究表明缺氧应激下 HepG-2细胞HIF-1表达[2]。本研究显示:缺氧应激下人HepG-2细胞的侵袭能力、增殖活性增强,与文献[1]相一致。
AFP基因属于白蛋白基因家族,有3个增强子,是原发性肝细胞癌诊断的重要血清标记物,参与细胞增殖和代谢的调节,能促进肝癌细胞增殖[5]。研究表明沉默AFP启动子抑制肝癌细胞的增殖活性[6]。本实验显示:缺氧应激下人 HepG-2细胞AFP基因的表达上调,增殖活性增强,且两者呈正相关;提示缺氧应激下HepG-2细胞增殖活性增强的机制之一是HepG-2细胞AFP基因的表达上调。
人ICAM-1(又名 CD54)基因长 15.5Kb,有7个外显子和6个内含子,定位于染色体19p13.2-13.3区,编码由4个前后排列的免疫球蛋白样区域组成的糖蛋白,是介导细胞间识别和粘附的重要粘附分子[7]。曲增强等研究发现:ICAM-1基因是肝癌细胞生物学行为的标志物之一。ICAM-1高表达的肝癌细胞转移能力增强,其可能的机制是:高表达ICAM-1的肝癌细胞通过LFA-1与浸润性淋巴细胞紧密结合,肝癌细胞间粘附力降低,易于随淋巴细胞的迁移脱离母瘤,与淋巴细胞结合的肝癌细胞在穿越血管壁时可以免受伤害,在血循环中易于形成栓子,逃逸免疫监视,易于在毛细胞血管内或淋巴窦滞留,形成转移灶[8]。本实验显示:缺氧应激下人HepG-2细胞ICAM-1基因的表达上调,侵袭力增强,与 Indovina[9]结果一致。ICAM-1 基因表达与HepG-2侵袭力呈正相关;提示缺氧应激下HepG-2细胞侵袭力增强的机制之一是HepG-2细胞ICAM-1基因的表达上调。
AFP、ICAM-1基因表达正相关,与 Zhang等[10]研究结果一致,提示两者可能在缺氧应激下HepG-2细胞增殖、侵袭能力增强中起协同作用,有待于进一步研究明确。AFP、ICAM-1基因是否是HIF-1的靶基因,有待于进一步研究证实。
[1]Jacques P,Frédéric D.Hypoxia signalling in cancer and approaches to enforce tumour regression[J].Nature,2006,441(7092):437-443.
[2]卢根林,邓勇,樊海宁,等.缺氧应激对HepG-2增殖活性和 HIF-1α、MMP-2 表达的影响[J].青海医学院学报,2007,28(4):485-490.
[3]卢根林,邓勇,樊海宁,等.缺氧应激对缺氧应激对人肝癌细胞粘附、侵袭和迁移能力的影响[J].第三军医大学学报,2008,30(8):721-723.
[4]Morkve O,Leaerum OD.Flow cytometry measurement of p21,p53 protein expression and DNA content in paraffin embedded tissues from bronchial carcinoma[J].Cytometry,1991,12(5):438-44
[5]Wang XW,Xie H.Alpha-fetoprotein enhances the proliferation of human hepatoma cells in vitro[J].Life Sci,1999,64(1):17-23.
[6]Gao P,Wang R,Shen JJ,et al.Hypoxia-inducible enhancer/alpha-fetoprotein promoter-driven RNA interference targeting STK15 suppresses proliferation and induces apoptosis in human hepatocellular carcinoma cells.Cancer Sci,2008,99(11):2209-2217.
[7]Vassilis GG,Panayotis Z,Athanassios K,et al.p53 activates ICAM-1(CD54)expression in an NF-kB-independent manner[J].The EMBO Journal,2003,22(7):1567-1578.
[8]曲增强,吴孟超,谢天培,等.I型细胞间粘附分子在肝细胞癌中的表达及其意义[J].中华病理学杂志,1997,26(2)::82-84.
[9]Indovina P,Rainaldi G,Santini MT.Hypoxia increases adhesion and spreading of MG-63 three-dimensional tumor spheroids[J].Anticancer Res,28(2A):1013-1022.
[10]Zhang H,Miao Z,He Z,et al.The existence of epithelialto-mesenchymal cells with the ability to support hematopoiesis in human fetal liver[J].Cell Biol Int,2005,29(3):213-219.
Effects of hypoxia stress on expressions of AFP and ICAM-1 in HepG-2 cell
LU Genlin1,DENG Yong2,YAN Xingjun1
(1.Yiwu Central Hospital,Zhejiang 322000,China;2.the Affiliated Hospital of Qinghai University,Xining 810001,China)
ObjectiveTo investigate whether hypoxia stress regulates expressions of AFP and ICAM-1 in HepG-2 cell.MethodHepG-2 cells were cultured under hypoxia(5%O2,5%CO2and 90%N2)for 12,24 h or normoxia.The proliferation in HepG-2 cell was detected by methyl thiazolyl tetrazolium(MTT).Cell invasion and migration assay was used to decide the invasion in HepG-2 cell.The expressions of AFP and ICAM-1 mRNA in HepG-2 cell were determined by reverse transcription polymerase chain reaction(RT-PCR).The expression of ICAM-1 protein in HepG-2 cell was studied by flow cytometry assay.The expression of AFP protein in HepG-2 cell was determined by radio-immunity assay(RIA).ResultWith the hypoxia time extending,the expressions of AFP and ICAM-1 gene were dramatically enhanced(P< 0.01).ConclusionUp-regulation of AFP and ICAM-1 contributes to the enhancement of proliferation,invasion in HepG-2 cell by hypoxia stress respectively.
hypoxia stress;HepG-2 cell;AFP;ICAM-1
R364.4;R73-37
A
1672-0024(2012)01-0044-04
卢根林(1973-),男,浙江衢州人,硕士,主治医师。研究方向:普通外科学
青海省卫生厅2006年指导性科研项目(编号:200601)
