胶质瘤浸润组织中MMP-2、MMP-9、VEGF、Flk-1和P16的表达及其临床意义
2012-10-11王长坤只达石
刘 伟,王长坤,只达石
(1.天津市环湖医院神经外科,天津300060;2.吉林大学第一医院神经外科,吉林 长春 130021)
胶质瘤是中枢神经系统中常见的肿瘤,浸润性生长的特点是胶质瘤难治性的根源。血脑屏障的破坏和新生血管的生成是胶质瘤浸润发生的重要成因。目前,胶质瘤与基质金属蛋白酶(matrix metalloproteinases,MMPs)和血管内皮因子的相关研究较多,但对胶质瘤浸润组织的研究较少[1-2]。本文作者通过研究胶质瘤浸润组织中的基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)、基质金属蛋白酶9(matrix metalloproteinase9,MMP-9)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管内皮生长因子受体Flk-1(flms like tyrosine kinase,Flk-1)和多种肿瘤抑制基因1(multiple tumor suppressor 1,P16)的表达,进一步阐明胶质瘤浸润性机制,为临床治疗胶质瘤提供科学依据。
1 材料与方法
1.1 材料来源收集手术切除并经病理诊断证实为Ⅰ~Ⅳ级胶质瘤浸润的新鲜标本33例,男性18例,女性15例,年龄为12~66岁,平均为39岁。正常脑组织对照组取材于同期颅脑损伤手术内减压的组织8例。肿瘤部位:额叶6例,颞叶9例,顶叶4例,颞顶叶6例,枕叶2例。
1.2 胶质瘤浸润组织的判定标准按照WHO的分类,将胶质瘤浸润的组织分为2组,一组为Ⅰ-Ⅱ级胶质瘤的浸润组织为15例(以Ⅱ级为主),另一组为Ⅲ-Ⅳ级胶质瘤的浸润组织为18例。
1.3 取材标准结合脑MRI中的T2瘤周高信号[2]进行取材。在手术显微镜下取材的胶质瘤浸润组织介于肿瘤组织和正常组织之间,呈黄白色的、质地较正常的脑组织韧的胶质增生组织。而肿瘤组织呈灰红色或灰白色,类似鱼肉样。用HE染色进行筛选,肿瘤组织和正常的脑组织不作为浸润组织的标准。
1.4 原位杂交检测方法每张切片加含3%柠檬酸新鲜的胃蛋白酶,暴露mRNA核酸片段。预杂交后,按每张切片20 μL杂交液,滴加生物素化鼠抗地高辛、生物素化过氧化物酶,显色二甲苯透明。原位杂交检测MMP-2和MMP-9。其中,MMP-2靶基因的mRNA序列为:①5′-TTCTATGGCTGCCCCAAGGAGAGCT GCAAC-3′;②5′-GACAGCCCTG CAAGTTTCCATTCCGCTT-3′;③5′-GAACCAAAGTCTGAAGTGCGTGAAGT-TTGG-3′。MMP-9靶基因的mRNA序列为:①5′-TCCCTGCCCGAGACCGGTGAGCTGGATAGC-3′;②5′-CAACTCGGCGGGAGAGCTGTGCGTCTTCCC-3′;③5′-CCAGGTGGACCAAG-TGGGCTACGTGACCTA-3′。
1.5 免疫组织化学染色方法将切片脱蜡、水化并抗原修复,加50 μL 过氧化酶阻断溶液,加50 μL 正常非免疫动物血清,洗涤后加50 μL生物素标记第二抗体,再加5 μL 链霉素抗生物素标记-过氧化物酶溶液。DAB显色,梯度酒精脱水,中性树胶封固。用VlteaSensitiveTMSP免疫组织化学试剂盒(购于福建迈新生物技术公司),采用生物素标记的第二抗体与链霉素抗生物素蛋白连接的过氧化物酶及底物色素混合液来测定细胞和组织中的抗原。免疫组织化学法检测MMP-2、MMP-9、VEGF、Flk-1和P16的表达。
1.6 结果判定根据参文[3],采用半定量测定方法,用目镜网格测试板在显微镜下,对每例组织切片随机观察5个高倍视野(400×),计数100个胶质瘤细胞内所含的阳性细胞数(即为阳性表达),按染色阳性细胞所占百分比评分。细胞浆染色强度评分:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。计算染色强度与阳性百分比的乘积,并按乘积数分为4个等级:-(0)、+(1、2分)、(3、4分)、(6、9分)。采用双盲法分别对每一张切片计数,取平均值。①MMP-2、MMP-9、VEGF和Flk-1结果判断:正常脑组织未见阳性表达,在胶质瘤浸润组织中的阳性表达主要位于细胞胞浆中;按染色阳性细胞所占百分比:0分为0,1分为阳性细胞占1%~10%,2分为11%~20%,3分为21%以上。②P16结果判定:P16蛋白阳性产物主要分布于为细胞胞浆中;按其中阳性细胞所占比例分为:0分为0~10%,1分为11%~40%,2分为41%~75%,3分为76% 以上。
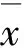
2 结 果
2.1 MMP-2和MMP-9mRNA原位杂交结果MMP-2和MMP-9的mRNA在Ⅰ-Ⅱ级与Ⅲ-Ⅳ级胶质瘤浸润组织中的阳性表达率分别为20.00%、61.11%和26.67%、55.56%,组间比较差异有统计学意义(P<0.01)。表明恶性胶质瘤的浸润组织具有浸润性生长的特征。见表1。

表1 胶质瘤浸润组织中MMP-2和MMP-9 mRNA表达的原位杂交结果
2.2 MMP-2、MMP-9、VEGF和Flk-1免疫组织化学检测结果MMP-2和MMP-9在Ⅰ-Ⅱ级与Ⅲ-Ⅳ级胶质瘤浸润组织中的阳性表达率分别为20.00%、61.11%和13.33%、55.56%,组间比较差异有统计学意义(P<0.01)。VEGF和Flk-1在Ⅰ-Ⅱ级与Ⅲ-Ⅳ级胶质瘤浸润组织中的阳性表达率分别为26.67%、66.67%和20.00%、72.22%, 组间比较差异有统计学意义(P<0.01)。MMP-2、MMP-9、VEGF和Flk-1在正常脑组织中无表达。见图1、2(封三)和表2。
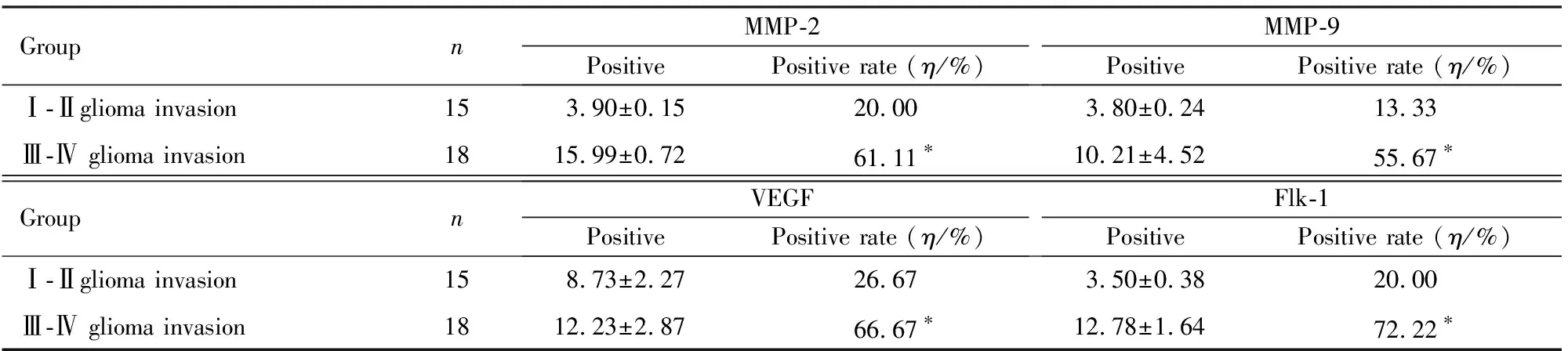
表2 MMP-2、MMP-9、VEGF和Flk-1表达的免疫组织化学检测结果
2.3 P16免疫组织化学检测结果P16在Ⅰ-Ⅱ级与Ⅲ-Ⅳ级胶质瘤浸润组织中的缺失率分别为13.33%和77.78%,组间比较差异有统计学意义(P<0.01), 表明P16蛋白在高级别胶质瘤浸润组织中表现为缺失。见图1、2(封三)和表3。

表3 胶质瘤浸润组织中P16的阳性表达及缺失率
3 讨 论
胶质瘤起源于中枢神经系统的胶质细胞,复发率高、预后差。其根源在于胶质瘤自身的恶性行为和浸润性生长的特征[4]。恶性胶质瘤本身可以通过手术切除,即使是术中切除肿瘤本身,术后复发率也很高。主要是胶质瘤周围浸润组织的过度增殖,加上神经纤维和神经胶质的特殊性,使得胶质瘤浸润过度增殖组织转变为胶质瘤,成为复发的根源。
限制胶质瘤侵袭性生长的是肿瘤周围由基底膜和细胞外基质构成的组织学屏障(胶原Ⅳ、层黏连蛋白和纤黏蛋白等)。MMP-2和MMP-9是一组含Zn2+的能降解基底膜的蛋白酶,主要降解明胶、胶原Ⅳ、胶原Ⅴ、层黏连蛋白、弹性蛋白及纤黏蛋白等[5-6]。而构成血脑屏障的胶质细胞和毛细血管壁基底膜的主要成分为Ⅳ型胶原、层黏蛋白和纤黏蛋白等。浸润组织细胞释放出金属蛋白酶,溶解了构成血脑屏障的基底膜,伸出伪足向被蛋白水解酶水解的区域运动、迁移,进一步降解胶质细胞的基底膜和基质,破坏了血脑屏障,沿着基底膜缺损和基质空隙向周围生长[7-8]。
本研究结果显示:在蛋白水平和分子水平上,Ⅲ-Ⅳ级胶质瘤浸润组织MMP-2、MMP-9的表达明显高于Ⅰ-Ⅱ级胶质瘤浸润组织,提示高级别胶质瘤边缘组织降解Ⅳ型胶原的能力增强,突破血脑屏障的基底膜而向外浸润的能力随之增强,这为胶质瘤的浸润性生长行为提供了病理形态学基础。
胶质瘤的生物学行为与血管生成密切相关,也是胶质瘤浸润性生长的重要条件。在浸润发生的过程中,胶质细胞外周基质的降解和新生血管内皮细胞的增殖、新生血管的形成促进了胶质瘤的侵袭行为[9-10]。VEGF及其受体是新生血管生成的重要因素。VEGF的生物学效应是通过其特异的膜受体介导实现的。其中受体Flk-1发挥了重要作用。VEGF与受体Flk-1结合,加快了血管内皮细胞增生,新生血管不断涌现,为肿瘤生长、浸润提供了适合的血液基础[11]。另外,胶质瘤的侵袭过程中,MMPs降解血脑屏障中的血管内皮细胞基底膜的同时,也降解了胶质细胞的基底膜,使其结构疏松,有利于肿瘤细胞沿着基底膜侵袭。MMPs与VEGF起着协同的作用,共同参与调节肿瘤血管形成[12]。
本研究结果显示:在Ⅲ-Ⅳ级胶质瘤浸润组织区域VEGF、Flk-1表达明显增多,而在Ⅰ-Ⅱ级胶质瘤浸润组织区域VEGF、Flk-1表达明显减少,表明恶性程度高的胶质瘤周围浸润组织中含有较多的血管生成因子。这些增生的血管是由VEGF通过各种机制降解血管基底膜和周围细胞的外基质,促进内皮细胞分裂、游走和增殖,导致血管生成并长入肿瘤组织中。本文作者同时发现:VEGF和受体Flk-1的阳性表达增高的区域,MMPs同步增高,说明两者协同促进了胶质瘤浸润组织细胞过度增殖。
胶质瘤浸润组织与胶质瘤不同,是瘤外周的增生组织。抑癌基因P16的缺失可以反映出胶质瘤浸润组织的增殖的生物学行为[13-14]。本研究同步检测了33例脑胶质瘤浸润组织中P16蛋白的缺失情况,其中和Ⅲ-Ⅳ级脑胶质瘤浸润组织中蛋白缺失率高于Ⅰ-Ⅱ级,说明Ⅲ-Ⅳ级脑胶质瘤浸润组织具有增殖为胶质瘤的潜能。
总之,胶质瘤的浸润性机制复杂,其中胶质瘤浸润组织中MMPs、VEGF的表达和P16的缺失成为胶质瘤浸润性组织增殖、转化为胶质瘤的重要因素之一。
[参考文献]
[1]刘 伟, 王长坤.基质金属蛋白酶与胶质瘤浸润性的关系[J].中国现代神经疾病杂志 ,2004 ,4(4):233-235.
[2]Engelhorn T, Savaskan NE, Schwarz MA.Cellular characterization of the peritumoral edema zone in malignant brain tumors[J].Cancer Sci, 2009,100(10):1856-1862.
[3]Franchi A,Santucci M,Masini E,et al.Expression of matrix metalloproteinase 1,matrix metalloproteinase 2,and matrixmetaUoproteinase 9 in carcinoma of the head and neck[J].Cancer,2002,95(9):1902-1908.
[4]兰凤鸣,岳 晓,韩 磊,等.反义miR-21通过RECK抑制胶质瘤细胞侵袭性生长的体内外研究[J].中华神经外科杂志, 2011,1 (27):94-98.
[5]Nima-Etminan D, Corinna-Peters SC,Ficnar J,et al.Modulation of migratory activity and invasiveness of human glioma spheroids following 5-aminolevulinic acid based photodynamic treatment[J].Neurosurgery,2011,115(2):281-288.
[6]Hisaoka K,Tsuchioka M,Yano R,et al.Tricyclic antidepressant amitriptyline activates fibroblast growth factor receptor signaling in glial cells:involvement in glial cell line-derived neurotrophic factor production[J].Biol Chem,2011,286(12):21118-21128.
[7]Kunapuli P, Kasyapa CS, Hawthorn L,et al.LGI1, a putative tumor metastasis suppressor gene, controlsinvitroinvasiveness and expression of matrix metalloproteinases in glioma cells through the ERK1/2 pathway[J].Biol Chem,2004,279(10):23151-23157.
[8]Chernov AV, Baranovskaya S,Golubkov VS,et al.Microarray based transcriptional and epigenetic profiling of matrix metalloproteinases, collagens, and related genes in cancer[J].Biol Chem,2010, 285(11):19647-19659.
[9]Badiga AV,Chetty C, Kesanakurti D,et al.MMP2 siRNA Inhibits Radiation-Enhanced Invasiveness in Glioma Cells[J].PLoS One,2011,6(6):20614-20619.
[10]Lakka SS,Gondi CS,Dinh DH,et al.Specific interference of urokinase type plasminogen activator receptor and matrix metalloproteinase-9 gene expression induced by double-stranded RNA results in decreased invasion, tumor growth, and angiogenesis in gliomas[J].Biol Chem,2005,280(10):21882-21892.
[11]Lucio-Eterovic AK, Piao Y, de Groot JF.Mediators of glioblastoma resistance and invasion during antivascular endothelial growth factor therapy[J].Clin Cancer Res,2009,15(14):4589-4599.
[12]Liu Y ,Zhou Y,Zhang XS,et al.Expression of VEGF and MMP-9 and MRI imaging changes in cerebral glioma[J].Oncol Lett,2011,6(2):1171-1175.
[13]向 莉,李书剑,张杰文.美洲商陆抗病毒蛋白对人神经胶质瘤细胞U251细胞增殖和凋亡的影响[J].郑州大学学报:医学版,2011,46(5):742-744.
[14]郑瑞锋,尹继云,杨 波,等.脑恶性胶质瘤调强放疗和三维适形放疗剂量比较[J].郑州大学学报:医学版,2011,46(2):303-304.
