乙型肝炎病毒相关性肝癌患者癌组织中HBx和CEACAM1的表达及其意义
2012-10-11许刚柱刘凯歌
马 莉,张 蔚,许刚柱,姚 杨,徐 利,刘凯歌
(1.西安交通大学第二附属医院病理科,陕西 西安710004;2.西安医学院第一附属医院消化科,陕西 西安710077)
肝细胞癌(hepatocelular carcinoma,HCC)是我国最常见的恶性肿瘤之一,而乙型肝炎病毒(HBV)感染是引起肝癌的最主要原因,特别是乙型肝炎病毒基因x开放读框编码的乙型肝炎病毒x蛋白(HBx)。癌胚抗原相关细胞黏附分子1 (carcinoembryonic antigen-related cell adhesion molecule 1,CEACAM1) 属于免疫球蛋白超家族基因,具有肿瘤抑制作用,研究发现:CEACAM1在多种恶性肿瘤中的表达普遍降低。乙型肝炎病毒相关性肝癌(乙肝相关性肝癌)中HBx和CEACAM1的关系和作用如何,国内外的相关研究鲜有报道。本文作者拟通过检测HBx和CEACAM1在乙肝相关性肝癌组织和细胞中的表达,探讨其在肝癌发生和发展中的意义。
1 资料与方法
1.1 研究对象81例乙肝相关性肝癌标本由西安医学院附属医院及第四军医大学西京医院病理科提供,均为2002年3月—2010年3月手术病例,术前未行化疗、放疗及其他辅助治疗。诊断标准参考中国抗癌协会肝癌专业委员会2001年9月于广州制定的“原发性肝癌的临床诊断与分期标准”。人正常肝细胞株QZG 细胞、肝癌细胞株HepG2及HepG2-X为第四军医大学西京医院肿瘤生物学国家重点实验室保存,其中HepG2-X为转染了HBx基因的HepG2细胞。
1.2 试 剂100 mL·L-1小牛血清(杭州四季青生物工程公司)、RPMI1640培养基、免疫组织化学SP试剂盒 (北京中杉生物技术公司),鼠抗人HBx单克隆抗体(NeoMarkers公司),兔抗人CEACAM1单克隆抗体(Epitomics公司),β-actin及蛋白Marker(Sigma公司),DAB显色试剂(Santa Cruz 公司),化学发光法(ECL)显色试剂(Pierce公司)。
1.3 免疫组织化学检测组织标本用40 g·L-1甲醛固定24 h,石蜡包埋,连续切片4 μm,贴附于预先用1 g·L-1多聚赖氨酸处理的载玻片,65℃烤片1 h,SP法检测按试剂盒说明书步骤进行,兔抗人CEACAM1mAb滴度为1∶200,鼠抗人HBx mAb滴度为1∶400,以PBS代替一抗作为阴性对照,用已知阳性标本作为阳性对照。DAB显色后进行结果判定:阳性反应物为棕黄色颗粒, 仅细胞核着蓝色者为阴性,胞膜、胞质或胞核呈棕黄色者为阳性细胞。随机选取5个视野,根据每个视野中阳性细胞数百分比和染色强弱进行评分:无阳性细胞记0分,阳性细胞数<25%记1分,阳性细胞数25%~50%记2分,阳性细胞数>50%记3分;细胞无显色记0分,呈浅黄色(弱染色)记1分,呈棕黄色(中等染色)记2分,棕褐色(强染色)记3分。两项相加>3分记为阳性,≤3分记为阴性。
1.4 细胞培养人正常肝细胞株QZG、肝癌细胞株HepG2及HepG2-X细胞以含体积分数100 mL·L-1的新小牛血清和青霉素100 U·mL-1、链霉素100 mg·L-1的RPMI1640培养液,在37℃、50 mL·L-1CO2、饱和湿度的培养箱中培养。
1.5 Western blotting检测蛋白水平细胞生长达培养皿的70%~80%时,冰上操作,4℃的PBS洗涤细胞3次,收集细胞,三去污裂解液裂解细胞。4℃、14 000 r·min-1离心10 min,收取上清蛋白,蛋白变性、定量及电泳。SDS-PAGE 电泳后转膜,50 g·L-1脱脂奶粉室温封闭2 h,加一抗,CEACAM1 mAb为1∶200,β-actin为1∶2 000,4℃孵育过夜。TBST洗膜,10 min×3次。辣根过氧化物酶标记的羊抗鼠二抗(1∶2 000) 室温孵育3 h,洗膜,15 min×3次,ECL显色。
1.6 统计学分析采用SPSS13.0统计软件进行统计学处理,表达阳性率组间比较采用χ2检验,HBx及CEACAM1表达阳性率的相关性分析采用Spearman法 。
2 结 果
2.1 乙肝相关性肝癌组织中HBx和CEACAM1的表达及关系免疫组织化学检测HBx和CEACAM1在乙肝相关性肝癌中的表达(图1,见封三),81例乙肝相关性肝癌组织中HBx表达阳性率为74.07% (60/81), CEACAM1表达阳性率为71.60% (58/81)。结果表明:HBx阳性组的CEACAM1的表达阳性率63.33%(38/60),明显低于HBx阴性组的CEACAM1的表达阳性率95.24%(20/21)(P<0.05), HBx与CEACAM1表达呈负相关(rs=-0.310,P<0.05),见表1。
2.2 HBx和CEACAM1的表达与乙肝相关性肝癌临床病理学特征的关系HBx在乙肝相关性肝癌组织的表达阳性与患者的年龄、性别、肿瘤直径及包膜浸润无关联,与门静脉侵袭、淋巴结转移和TNM分期有关联,组间比较差异有统计学意义(P值分别为0.000,0.006,0.004),其中TNM分期Ⅲ-Ⅳ期组病例中,HBx表达阳性率为90.91%(30/33),显著高于Ⅰ-Ⅱ期组(62.50%,30/48)。CEACAM1在乙肝相关性肝癌组织的阳性表达与患者的年龄、性别无关联,而与肿瘤直径、包膜浸润、门静脉侵袭、淋巴结转移和TNM分期有关联,组间比较差异有统计学意义(P值分别为0.003、0.000、0.002、0.000、0.000),其中TNM分期Ⅰ-Ⅱ期组病例中,CEACAM1表达阳性率为91.67%(44/48),显著高于Ⅲ-Ⅳ期组CEACAM1表达阳性率(42.42%,14/33)。见表1。
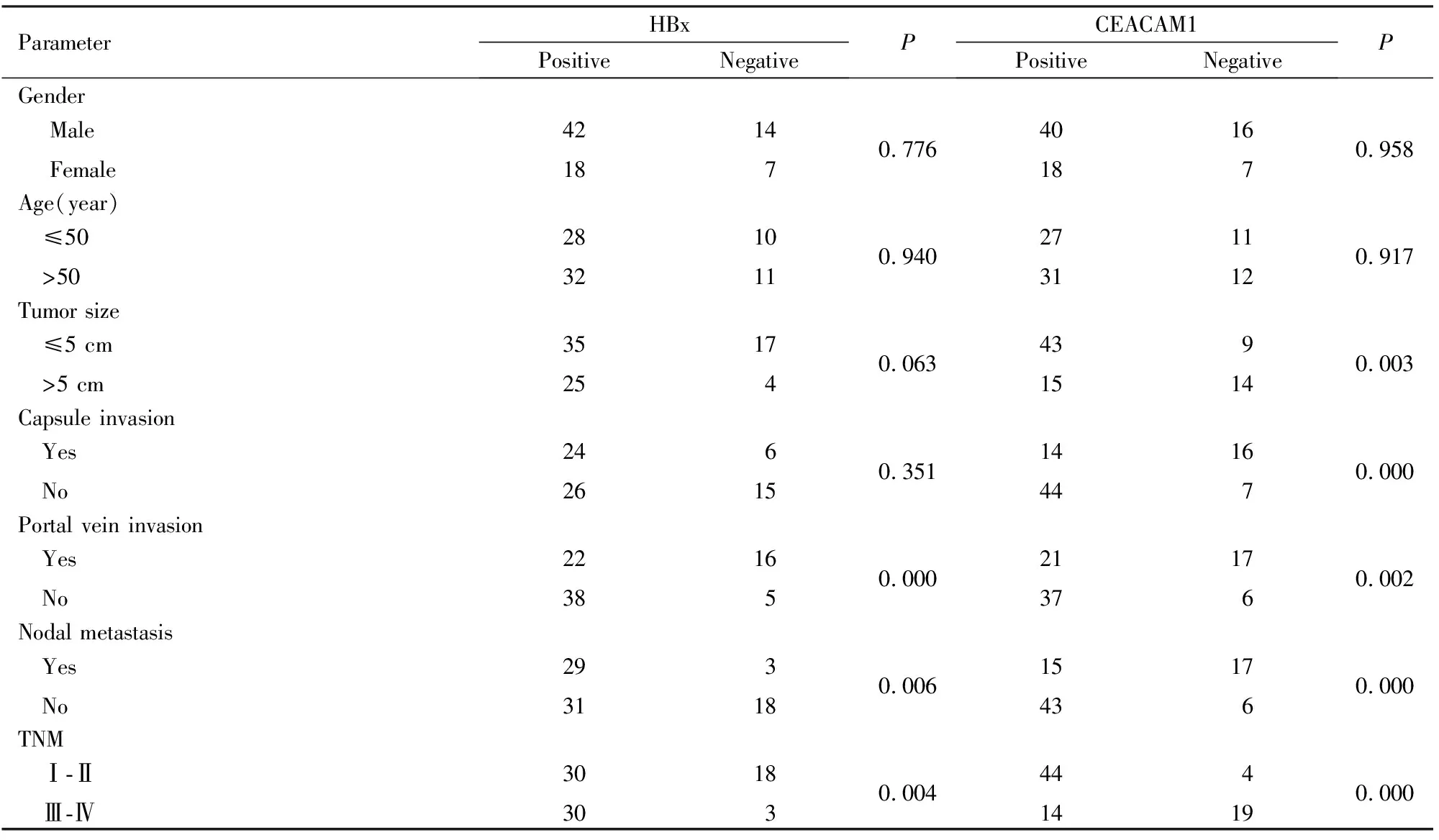
表1 HBx及CEACAM1表达与乙肝相关性肝癌临床病理特征的关系
2.3 Western blotting检测结果在HepG2-X中, CEACAM1蛋白表达水平与转染空载体的对照肝癌细胞HepG2及人正常肝细胞系QZG比较显著降低(图2)。
3 讨 论
HBV慢性感染是肝细胞癌发病的独立高危因素,HBV的x基因编码产物x蛋白产物是HBx。有研究发现:HBx在乙肝相关性肝癌的发生、发展和浸润中发挥着重要作用[1-3],但其作用机制不很明确。目前研究发现:HBx能通过激活Notch 信号通路促进肝细胞癌的进展[4]。Xu 等[5]研究发现:HBx通过下调肿瘤抑制因子MIA2的表达激活肝癌细胞生长、增殖。
CEACAM1是一种跨膜糖蛋白,为癌胚抗原(CEA)家族成员之一,属于免疫超家族,最初由Ocklind等[6]报道。早期研究发现:CEACAM1上皮来源的恶性肿瘤中表达降低,如在前列腺癌[7]、肾细胞癌[8]、肝癌[9]等中均发现CEACAM1的表达下调,因此被认为是一种肿瘤抑制因子;但肺癌和胰腺癌的研究提示与CEACAM1具有与肿瘤抑制效应相反的结果[10-11],CEACAM1阳性病例恶性程度上升,CEACAM1可促进恶性肿瘤的进展和迁移。特别是在黑色素瘤中,CEACAM1 的表达与肿瘤进展与患者的不良生存相关,介导了黑素瘤细胞的免疫逃逸机制,有可能作为黑素瘤的生物标记用于诊断和治疗靶标[12]。
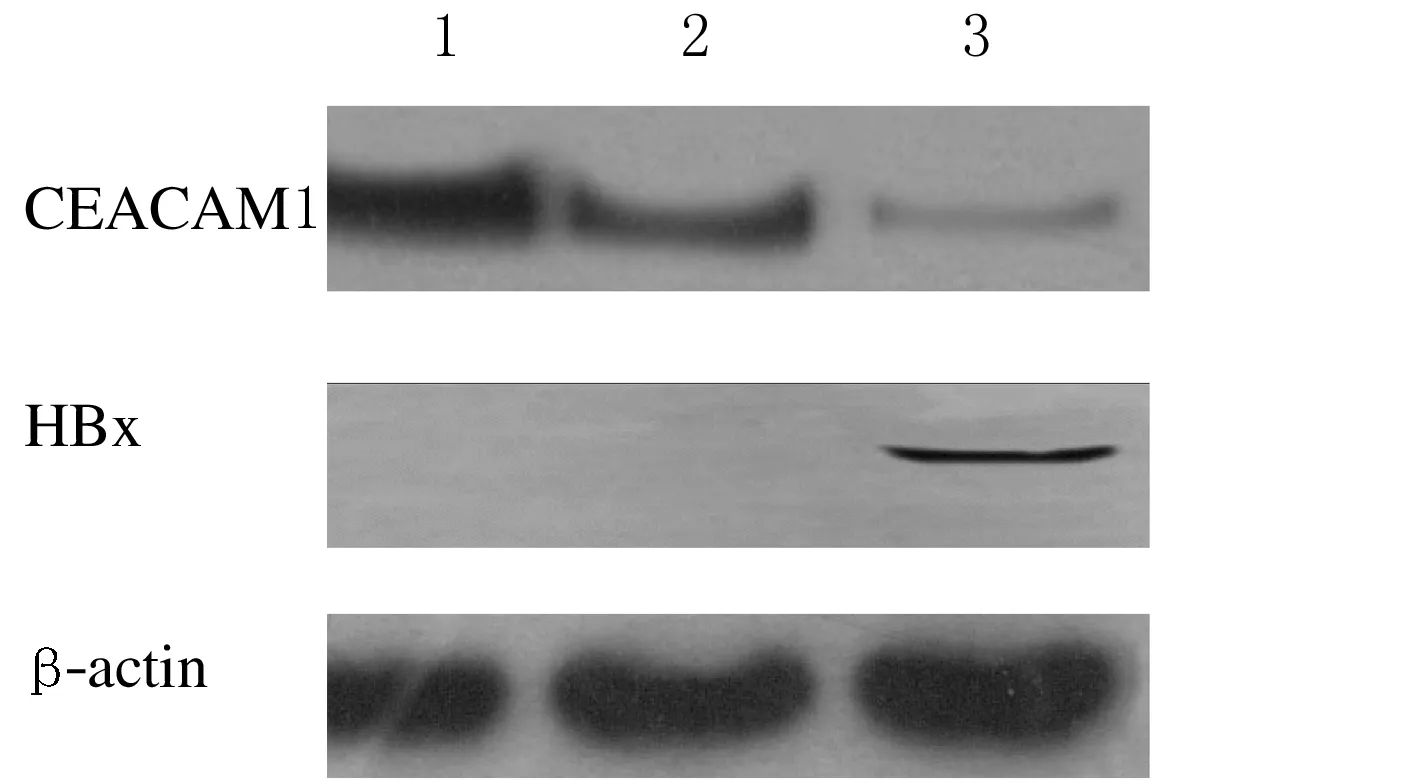
图2 Western blotting检测各组细胞中CEACAM1的表达
本实验检测了81例乙肝相关性肝癌组织中HBx表达,其阳性率为74.07%,HBx蛋白表达与年龄、性别、肿瘤直径、包膜是否浸润无关联,而与门静脉侵袭、淋巴结转移、TNM分期有关联(P<0.05),其中TNM分期Ⅲ-Ⅳ期组病例中HBx表达阳性率显著高于Ⅰ-Ⅱ期组,进一步证实HBx在乙肝相关性肝癌的形成、发展、转移和浸润中发挥着促进作用。
乙肝相关性肝癌组织中HBxC与CEACAM1的研究国内外鲜有报道。本实验81例乙肝相关性肝癌组织中CEACAM1阳性表达率为71.60%,CEACAM1的表达与肿瘤直径、包膜浸润、门静脉侵袭、淋巴结转移和TNM分期有关联(P<0.05),而与患者的年龄、性别无关联(P>0.05)。其中,TNM分期Ⅰ-Ⅱ期组病例中,CEACAM1表达阳性率显著高于Ⅲ-Ⅳ期组(P<0.01),肿瘤的恶性程度越高,CEACAM1的阳性表达率越低,说明其表达下调可能是肿瘤发生和发展中的重要生物事件,提示CEACAM1在乙肝相关性肝癌发生和发展中可能扮演着肿瘤抑制基因的角色,CEACAM1低表达则反映预后不良,与Cruz等[9]的研究结论类似,可能与促进肿瘤细胞生长有关。Tsukada等[13]在肝母细胞瘤中的研究也显示:CEACAM1表达的缺失可能反映一个高的转移的潜力及较差的预后。
本研究中相关性分析结果提示:HBx和CEACAM1表达呈负相关(rs=-0.310,P<0.05);Western blotting检测结果提示:HBx可能通过相应的信号通路抑制CEACAM1表达。
本研究结果表明:在乙肝相关性肝癌的发生和发展中CEACAM1仍然作为肿瘤抑制基因,其低表达与HBx关联,二者在乙肝相关性肝癌的发生和发展中发挥着相反的作用,HBx的高表达和CEACAM1的低表达共同促进了乙肝相关性肝癌的侵袭转移。推测在乙肝相关性肝癌的发生中,HBx可能通过抑制CEACAM1表达从而促进肿瘤的发生和发展。
[参考文献]
[1]Zhang X, Zhang H,Ye L.Effects of hepatitis B virus X protein on the development of liver cancer[J].J Lab Clin Med, 2006,147(2):58-66.
[2]刘凯歌,高红艳,赵 慧,等.HBx和VEGF与乙肝相关性肝癌组织血管生成及转移的关系[J].吉林大学学报:医学版,2010,36(2):372-376.
[3]Xie H, Liu K,Fan D, et al.The expression of hypoxia-inducible factor-1alpha in hepatitis B virus-related hepatocellular carcinoma:correlation with patients, prognosis and hepatitis B virus X protein[J].Dig Dis Sci, 2008,53(12):3225-3233.
[4]Wang F,Zhou H, Yang Y, et al.Hepatitis B virus X protein promotes the growth of hepatocellular carcinoma by modulation of the Notch signaling pathway[J].Oncol Rep, 2012,27(4):1170-1176.
[5]Xu Y, Yang Y, Cai Y, et a1.The X protein of hepatitis B virus activates hepatoma cell proliferation through repressing melanoma inhibitory activity 2 gene[J].Biochem Biophys Res Commun, 2011,416(3/4):379-384.
[6]Okegawa T,Pong RC,Li Y,et al.The role of cell adhesion molecule in cancer progression and its application in cancer therapy[J].Acta Biochim Pol,2004,51(2):445-457.
[7]Volpert O,Luo W,Liu TJ,et al.Inhibition of prostate tumor angiogenesis by the tumor suppressor CEACAM1[J].J Biol Chem, 2002,277(38):35696-35702.
[8]Kammerer R, Riesenberg R, Weiler C, et al.The tumour suppressor gene CEACAM1 is completely but reversibly downregulated in renal cell carcinoma[J].J Pathol, 2004,204(3):258-267.
[9]Cruz PV, Wakai T,Shirai Y,et al.Loss of carcinoembryonic antigen-related cell adhesion molecule 1 expression is an adverse prognostic factor in hepatocellular carcinoma[J].Cancer, 2005,104(2):354-360.
[10]Sienel W, Dango S, Woelfle U, et al.Elevated expression of carcinoembryonic antigen-related cell adhesion molecule 1 promotes progression of non-small cell lung cancer[J].Clin Cancer Res,2003,9(6):2260-2266.
[11]Simeone DM,Ji B,Banerjee M,et al.CEACAM1,a novel serum biomarker for pancreatic cancer[J].Pancreas, 2007,34(4):436-443.
[12]Sapoznik S, Ortenberg R, Schachter J,et al.CEACAM1 in malignant melanoma:a diagnostic and therapeutic target[J].Curr Top Med Chem,`2012,12(1):3-10.
[13]Tsukada M,Wakai T,Matsuda Y,et al.Loss of carcinoembryonic antigen-related cell adhesion molecule 1 expression predicts metachronous pulmonary metastasis and poor survival in patients with hepatoblastoma[J].J Pediatr Surg,2009, 44(8):1522-1528.
