日常性体力活动与绝经后骨质疏松症发病风险的关联性
2012-10-11张晓波邓士琳
张晓波, 邓士琳
(武汉理工大学体育部,湖北 武汉 430070)
目前体力活动对防治绝经后骨质疏松症(postmenopausal osteoporosis, PMOP)的作用正日益受到重视,但研究结论并不一致。尚缺乏充分的证据能够证明体力活动对PMOP有保护作用。本研究以绝经后妇女为观察对象,对日常性体力活动与PMOP发病风险的关系进行探讨,旨在为我国妇女防治PMOP提供经济、有效、可行的途径。
1 资料与方法
1.1 研究对象和纳入/排除标准本研究的病例组和对照组来源于2007年3月—2008年2月在华中科技大学附属同济医院骨密度测量室检查的健康体检人员及门诊和住院患者。纳入标准为:①年龄在40岁及以上;②自然绝经1年及以上;③5年内未发现癌症或接受相关治疗;④未使用影响骨密度(bone mineral density, BMD)的药物;⑤排除继发性骨质疏松症。排除标准:①过早绝经(低于40岁);②继发性骨质疏松症;③甲状腺机能亢进、恶性肿瘤的骨转移及多发性骨髓瘤等。按照1∶1配比筛选病例组(n=67)和对照组(n=67)。配比的条件主要是年龄(相差不超过5岁)和绝经年限(相差不超过3岁)。
1.2 骨质疏松症的诊断骨密度测量采用美国Hologic公司生产的QDR-2000+型双能X线骨密度仪(dual energy X-ray absorption, DEXA),测量腰椎(L1-4)后前位骨密度。骨质疏松症诊断标准:依据我国老年学学会骨质疏松症委员会建议的诊断标准,腰椎骨密度(L2-4)低于正常同性别、同年龄者峰值骨量的2.5个标准差,并能排除其他原因所致者[1]。标准差在0~1.0者诊断为正常。
1.3 调查内容与方法所有研究对象(病例组及对照组)均由经过相应培训的调查员采用面对面方式进行问卷调查。调查内容包括:人口统计学特征,月经史,绝经史,生育史,母乳喂养史,吸烟及饮酒和膳食等生活习惯,牛奶及补钙史,目前体力活动情况,青少年时期(7~18岁)体力活动史等。按标准方法测量身高、体质量,体质量指数(BMI)=体质量(kg)/身高(m)2。
体力活动测量采用《国际体力活动问卷》(International Physical Activity Questionnaire, IPAQ)中文版,调查最近1年内经常性体力活动情况,包括职业性、家务劳动性、交通行程性和休闲性体力活动。该问卷主要从大强度、中等强度体力活动及步行和静坐4个方面调查体力活动量。询问各项活动的时间、频率和强度等。根据王书梅等[2]的方法对各种强度体力活动及步行和静坐等进行每小时平均代谢当量(MET)赋值,然后计算各单项(职业性、交通行程性、家务劳动性和休闲性)体力活动MET值,总的体力活动MET值为各单项体力活动MET值之和。依照IPAQ国际体力活动专家组的评价标准,将总的体力活动分为3个水平:体力不足,体力活跃,体力高度活跃。将各单项体力活动分为“体力不足”和“体力活跃”。
1.4 质量控制严格按照纳入和排除标准进行研究对象的选择;进行调查员培训,减少调查员人数;盲法调查;对常见的选择性偏倚、信息偏倚和混杂偏倚等进行控制。
2 结 果
2.1 病例组和对照组人口社会学特征、月经史、生育史及生活习惯调查对象最小年龄45岁,最大年龄70岁,平均年龄(56.42±4.95)岁。病例组和对照组年龄分别为(56.75±4.85)岁和(56.09±5.06)岁,绝经年限分别为(8.37±4.95)年和(6.75±5.41)年,组间比较差异无统计学意义(P>0.05)。病例组和对照组在人口社会学特征、膳食、生活习惯(吸烟、饮酒、咖啡、可乐等摄入)、补钙、喝牛奶、日照时间,以及月经史、生育史和母乳喂养史等方面比较差异均无统计学意义(P>0.05)。χ2检验结果显示:对照组在生育期服用避孕药的比例高于病例组,对照组绝经后使用激素替代(HRT)及日常喝豆浆者的比例要高于病例组(P<0.05)。
2.2 病例组和对照组体力活动水平比较总的体力活动水平:病例组体力不足者比例高于对照组,体力高度活跃者低于对照组,组间比较差异有统计学意义(P=0.001),见表1。但经使用避孕药、HRT、喝豆浆等因素校正后,差异无统计学意义(P>0.05)。

表1 病例组和对照组总体力活动水平比较
病例组和对照组单项体力活动:本次调查对象中不在职人员占56.7%,包括离退休人员、家庭妇女等。结果显示:病例组交通行程性体力不足的比例高于对照组(表2)。经使用避孕药、HRT、喝豆浆等因素校正后,差异仍有统计学意义(校正OR=0.249, 95%CI 0.096~0.651,Waldχ2=6.300,P=0.012)。病例组休闲性体力活动不足的比例高于对照组(表3)。但经使用避孕药、HRT、喝豆浆等因素校正后,差异无统计学意义(P>0.05)。病例组和对照组职业性和家务劳动性体力活动水平比较差异无统计学意义(P>0.05)。

表2 病例组和对照组交通行程性体力活动水平比较
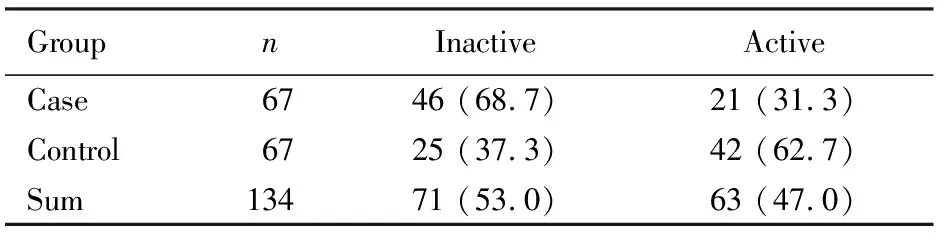
表3 病例组和对照组休闲性体力活动水平比较
病例组和对照组有规律锻炼情况: 研究对象中坚持有规律锻炼者占47.4%, 病例组所占比例更低(病例组30.3%,对照组64.2%),组间比较差异有统计学意义(P<0.01)。调查对象中最常见的锻炼方式有:步行/慢跑(39.6%),健身舞蹈(23.9%),太极拳/剑(17.2% );而其余锻炼方式则参与者较少,如骑自行车(6.0%),爬楼梯(5.2%),伸展柔韧性练习(4.5%),球类(3.7%),力量练习(3.7%),瑜伽(2.2% ),其他(3.0%)。 结果显示:病例组和对照组采用步行/慢跑、健身舞蹈和爬楼梯3种锻炼方式者比例比较差异有统计学意义(P<0.01),其他锻炼方式如太极拳/剑、力量练习、骑自行车、球类运动、瑜伽、柔韧伸展练习等比较差异无统计学意义(P>0.05)。
3 讨 论
体力活动及其力学负荷对骨结构和横断面积有重要作用[3]。大量试验研究表明:长期卧床或失重造成的机械负荷减少可以导致成骨和骨组织钙化,抑制骨量下降甚至骨质疏松[4]。定期体力活动,包括有氧、承重、抗阻力量练习对增加绝经后妇女脊椎骨密度和肌肉量有效[5]。体育锻炼和机械刺激可以促进成骨并抑制骨吸收[6]。本研究发现:交通行程性体力活动可降低PMOP的发病风险,而其他体力活动对PMOP的影响不明显。在休闲性体力活动中,只有步行/慢跑、健身舞蹈和爬楼梯3种锻炼方式在病例组和对照组之间比较差异有统计学意义。提示只有负重性体力活动如步行、登楼梯等有助于降低PMOP的发病风险。Moayyeri[7]所做的回顾性研究也证实了这一点。绝经后妇女进行负重和高冲击运动对骨骼的影响因为部位不同而有不同的作用,如跑步可增加下肢BMD,但对非负重的前臂则无影响[8-9]。提示在选择促进骨健康的体力活动项目时,必须考虑到应变率、应力大小以及运动方式的创新,以优化骨适应性反应。
本组结果显示:经使用避孕药、HRT、喝豆浆等因素校正后,总的体力活动和休闲性体力活动水平对PMOP发病风险的影响不再存在。这可能与日常性体力活动,包括规律性锻炼的方式所产生的应力和应变有关。
Devine等对1 363名老年妇女调查发现:与中等或低等体力活动组相比,体力活动水平高与髋部骨密度及跟骨QUS呈相关关系;如果同时具备高体力活动和高钙摄取,那么髋部骨折的危险性有望减少约17%[10]。Hagery等[11]指出:绝经后妇女长期的低-中等体力活动与较高的骨密度有关,但长期的高强度的训练方式使骨密度更高。提示体力活动水平及锻炼时间与骨密度有剂量-效应关系。陈柏龄等[12]发现:在校正年龄、骨密度、膳食钙、维生素D、血清E2水平等混杂因素影响后,总的体力活动能耗高者比总体力活动能耗低者有着较高的骨矿物质含量和骨皮质厚度。
但日常性体力活动对骨密度影响的研究结论不太一致[13],这可能与种族有关。例如,美国的一项研究发现:休闲性体力活动与白种人妇女腰椎和髋骨骨密度显著相关,而黑种人女性中,体力活动和骨密度无相关性[14]。Blanchet 等[15]在575位无亲属关系的健康绝经后妇女中作的研究发现:每周运动3次或3次以上的妇女,维生素D受体基因型为bb者其校正后的腰椎骨密度比BB型的低。该结果提示体力活动与骨密度之间的关联可能还受到遗传因素的影响。此外,由于体力活动是一个非常复杂的过程,包括活动的强度、持续的时间、活动的频率以及周围环境和社会因素等,各种因素均会影响体力活动的能量消耗,因此影响研究结论的一致性。
本研究是基于临床诊断的病例-对照研究,严格按照1∶1配比筛选合格样本量,在研究设计上注重控制偏倚,减少对结果的干扰,结果较为可靠。但回顾性研究方法学上的差异仍可能影响结果。对体力活动的定级主要来自IPAQ专家组的建议和参考其他研究者的定义。体力活动本身可能与许多因素相互影响,如能量摄入和膳食习惯、个体基础代谢差异、健康状况及遗传等因素,从而使结果的解释受到较大干扰。
本研究发现:交通行程性体力活动可以降低PMOP的发病风险。步行既是人们常见的交通出行方式,也是最简单可行的锻炼方式,有必要提倡人们多利用步行作为交通活动来增加体力活动水平,或作为锻炼方式。
[参考文献]
[1]刘忠厚.中国人原发性骨质疏松症诊断标准(试行)[J].中国骨质疏松杂志,1999,5(1):1-3.
[2]王书梅,范明秋,赵家奎.上海市浦东新区不同人群体力活动现况调查[J].中华流行病学杂志,2006,27(12):1033-1037.
[3]Junno JA, Paananen M, Karppinen J, et al.Influence of physical activity on vertebral size[J].Osteoporos Int, 2011, 22(1):371-372.
[4]Pavalkof M, Norvell SM, Burr DB, et al.A model for mechanotransduction in bone cells:the load-bearing mechanosomes[J].J Cell Biochem, 2003,88(1):104-112.
[5]Marques EA, Wanderley F, Machado L, et al.Effects of resistance and aerobic exercise on physical function, bone mineral density, OPG and RANKL in older women[J].Exp Gerontol,2011,46(7):524-532.
[6]Vico L, Coliet P, Guignandon A, et al.Effects of long-term microgravity exposure on cancellous and cortical weight-bearing bones of cosmonauts[J].Lancet, 2000,355(9215):1607-1611.
[7]Moayyeri A.The association between physical activity and osteoporotic fractures:a review of the evidence and implications for future research[J].Ann Epidemiol, 2008,18(11):827-835.
[8]Kagan R.Exercise and bone health[J].Female Patient, 2002, 27(6):49-50.
[9]Mauck KF, Clarke BL.Diagnosis, screening, prevention, and treatment of osteoporosis[J].Mayo Clinic Proceedings, 2006, 81(5):662-672.
[10]Devine A, Dhaliwal SS, Dick IM, et al.Physical activity and calcium consumption are important determinants of lower limb bone mass in older women[J].J Bone Miner Res,2004, 19(10):1634-1639.
[11]Hagberg JM.Moderate physical activity is associated with higher bone mineral density in postmenopausal women[J].J Am Geriatr Soc,2001,49(11):1565-1567.
[12]陈柏龄,李佛保,粘家斌,等.绝经后妇女体力活动与桡骨骨密度、皮质厚度和相关骨代谢指标关系的研究[J].中华老年医学杂志,2003,22(10):599-601.
[13]Kitamura K, Nakamura K, Kobayashi R, et al.Physical activity and 5-year changes in physical performance tests and bone mineral density in postmenopausal women:The Yokogoshi Study[J].Maturitas,2011, 70(1):80-84.
[14]Chantler S, Dickie K, Goedecke JH, et al.Site-specific differences in bone mineral density in black and white premenopausal South African women[J].Osteoporos Int,2012,23(2):533-542.
[15]Blanchet C, Giguere Y, Prud'homme D, et al.Association of physical activity and bone:influence of vitamin D receptor genotype[J].Med Sci Sports Exerc,2002,34(1):24-31.
