广东地区鸭黄病毒QS株的分离和初步鉴定
2012-10-09钟植文苏伟桐江鹏华周泽标刘镇明杨傲冰
钟植文,苏伟桐,江鹏华,周泽标,刘镇明,杨傲冰
(1.广东永顺生物制药有限公司,广州 511356;2.华南农业大学兽医学院,广州 510642)
2010年4月以来,我国部分地区陆续发生一种新疾病,以产蛋鸭产蛋急剧下降,卵泡变性,卵泡膜出血为特征,目前有报道确定为由鸭黄病毒引起[1-3]。广东清远地区某商品蛋鸭场,6000只蛋鸭1周前开始出现减料降蛋。至2011年9月18日,产蛋量从原来每天4800枚降至2800枚,即产蛋率从80%降至46.7%,下降了33.3%;而饲料量从原来每天25包降至20包,即采食量从每只鸭每天167 g降至133 g,下降了20%。对病死鸭只进行解剖,病变主要为卵泡充血、出血(图1)。本文对广东清远地区某商品蛋鸭场该病进行诊断研究。

图1 病死鸭卵泡充血、出血
1 材料与方法
1.1 细菌分离 无菌采取广东清远地区某商品蛋鸭场病(死)产蛋种鸭的肝脏、脾脏、心血等,接种于普通营养琼脂、麦康凯琼脂、鲜血液琼脂等培养基,置37℃温箱培养。
1.2 病毒分离和传代 采取广东清远地区某商品蛋鸭场病(死)产蛋种鸭的肝脏、脾脏、肺、卵巢等内脏组织,按常规方法匀浆后,反复冻融3次,3500 r/min离心10 min,吸取上清液,加入青链霉素,终浓度均为1万单位/mL,4℃作用2 h,再经细菌滤器过滤除菌,保留滤液。滤液经尿囊腔途径接种9日龄鸭胚(由广东永顺生物制药有限公司提供)8只,每只0.3 mL。接种后置37℃温箱孵化,每天照胚4次,连续观察7 d。观察死亡鸭胚病变,收获死亡鸭胚尿囊液,无菌检查后命名为QS株,然后连续传代,同时开始进行鸡胚传代。
1.3 血凝试验 参照文献[4],配制1%鸭、鸡红细胞悬液,分别进行微量血凝试验。
1.4 PCR、RT-PCR鉴定和序列测定分析 根据实验初步结果,分别针对鸭瘟病毒UL6基因,禽流感病毒M基因,禽副粘病毒Ⅰ型F基因,鸭肝炎病毒VP1基因和黄病毒属Tembusu病毒的非结构蛋白NS5基因设计引物,引物由英潍捷基(上海)贸易有限公司合成。其中,针对Tembusu病毒NS5基因设计的引物序列为P1:5’-GACACTAGAATAACCAAG -3’,P2:5’-GCGAATCTGTCATCTGCT-3’。用 Takara Universal Genomic DNA Extraction Kit提取接种QS株的鸭胚尿囊液的病毒总DNA,再用针对鸭瘟病毒UL6基因所设计的特异性引物进行PCR扩增。用Takara MiniBEST Viral RNA Extraction Kit提取接种QS株的鸭胚尿囊液的病毒总RNA,用随机引物为反转录引物合成cDNA,再分别用针对禽流感病毒M基因、禽副粘病毒Ⅰ型F基因,鸭肝炎病毒VP1基因和Tembusu病毒NS5基因所设计的特异性引物进行PCR扩增。另外,再用Takara MiniBESTViral RNA Extraction Kit提取健康鸭胚尿囊液的病毒总RNA,随机引物为反转录引物合成cDNA,针对Tembusu病毒NS5基因所设计的特异性引物进行PCR扩增,并作为对照,所有的PCR和RT-PCR产物一起电泳检测结果。将阳性产物经回收纯化后送英潍捷基(上海)贸易有限公司进行序列测定。用 BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行相似性检索,用CLUSTALW比较序列相似性,用MEGA 4.0构建系统进化树。
1.5病毒对鸭胚的ELD50测定 参照文献[5],将QS株第3代病毒液以灭菌生理盐水配制成10-5~10-1的病毒液,每个稀释度分别经尿囊腔途径接种8只9日龄鸭胚,每只0.2 mL。每天照胚4次,24 h内死亡胚弃去不计数,之后每天记录死胚情况,连续观察7 d,按Reed-Muench法计算病毒的ELD50。
2 结果
2.1 细菌分离 病料接种的普通营养琼脂、麦康凯琼脂、鲜血液琼脂等培养基均无菌落生长,初步排除细菌感染的可能性。
2.2 病毒分离和传代 经处理的病料接种9日龄鸭胚,孵化68 h开始出现死亡。死亡胚体全身出血,尤其是头、颈、脚出血明显(图2)。收获死亡鸭胚尿囊液,无菌检查为阴性。进行鸭胚传代,连续传9代。鸭胚的死亡率均为100%,死亡时间集中在68~96 h。取第3代鸭胚尿囊液,接种9日龄鸡胚,89 h开始出现死亡,死亡胚体严重出血,而死亡时间不集中,在89~143 h之间。初步确定为病毒性感染。
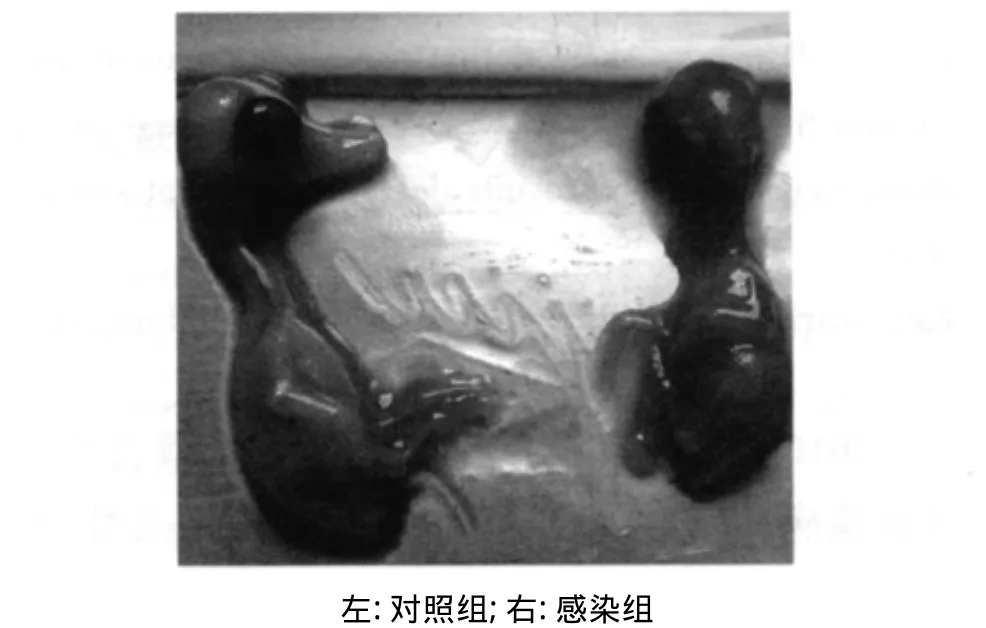
图2 接种QS株后的鸭胚
2.3 血凝试验 每一代鸭胚尿囊液和鸡胚尿囊液均不能凝集鸭和鸡红细胞,表明QS株对鸭和鸡红细胞无血凝性。
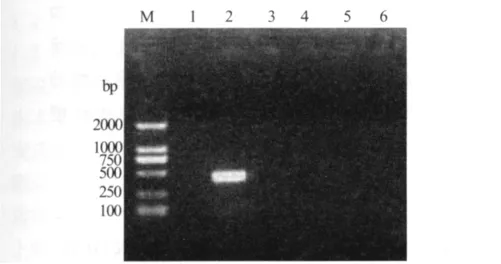
图3 QS株病毒PCR和RT-PCR检测结果
2.4 PCR、RT-PCR鉴定和序列测定分析 用针对黄病毒属Tembusu病毒NS5基因所设计的特异性引物进行RT-PCR扩增,结果显示扩增片段大小约为400 bp,而针对禽流感病毒M基因,禽副粘病毒Ⅰ型F基因,鸭肝炎病毒VP1基因和鸭瘟病毒UL6基因,所设计的特异性引物均未能扩增出任何预期片段(图3)。将目的条带回收纯化后,经测序后对获得序列进行分析,扩增片段为419 bp。用Blastn进行比较分析,发现与黄病毒属中的Tembusu病毒相似性最高,其中与Tembusu病毒Fengxian株相似性高达99%,而与黄病毒属其它毒株如YY5株、CJD05/CHN/2010株和SD/CHN/2010株相似性均达98%。基于NS5基因部分片段建立系统进化树,QS株和黄病毒属Fengxian株等多个毒株处于同一分支,而Tembusu病毒Sitiawan株等多个毒株处于另一分支(图4),这些都表明QS株与Tembusu病毒亲缘关系很近,也属于黄病毒属。
2.5 病毒对鸭胚的ELD50测定 QS株的鸭胚尿囊液稀释后接种9日龄鸭胚,10-1和10-2稀释度的病毒液接种的8只鸭胚,死亡率均8/8,10-3稀释的病毒液接种的,死亡率为7/8,10-4稀释的病毒液接种的,死亡率为2/8,10-5稀释的病毒液接种的死亡率为0/8。按Reed-Muench法计算,QS株对鸭胚的ELD50为 10-3.6/0.2mL。

图4 基于NS5基因部分片段建立的系统进化树
3 讨论
3.1 接种鸭胚的死亡情况及PCR、RT-PCR鉴定和序列测定分析结果显示,本次从广东省清远地区商品蛋鸭场病死鸭中分离的病毒QS株与黄病毒属中的Tembusu病毒亲缘关系很近,同属于黄病毒属。
3.2 QS株对鸭和鸡红细胞均无血凝性,表明QS株不属于 AIV、NDV、EDSV[5-6]。
[1] 李玉峰,马秀丽,于可响,等.一种新病原——鸭黄病毒的分离与初步鉴定[J].家禽科学,2011,5:12 -14.
[2] 万春和,施少华,程龙飞,等.一种引起种(蛋)鸭产蛋骤降新病毒的分离与初步鉴定[J].福建农业学报,2010,25(6):663 -666.
[3] 曹贞贞,张 存,黄 瑜,等.鸭出血性卵巢炎的初步研究[J].中国兽医杂志,2010,46(12):3 -7.
[4] 中华人民共和国农业部,高致病性禽流感诊断技术(GB/T 18936-2003)[S].
[5] 辛朝安.禽病学[M].北京:中国农业出版社,2003:40-84.
[6] 殷 震,刘景华.动物病毒学[M].第二版.北京:科学出版社,1997:262 -264,351 -354,632.
