PI3K/Akt-NO信号通路在AngⅣ诱导大鼠心肌肥大中的作用*
2012-09-27彭晓凤陈加飞王全华周龙洋蒋青松
彭晓凤,陈加飞,王全华,周龙洋,王 佳,蒋青松△
(1.重庆医科大学药理学教研室 400016;2.重庆市巴南区人民医院药剂科 401320;3.重庆市綦江县人民医院药剂科 401420)
大量研究已经证明,肾素-血管紧张素系统(renin-angiotensin system,RAS)在糖尿病等代谢综合征的发生发展过程有重要作用,但大多数研究集中于血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)及其受体。血管紧张素Ⅳ(angiotensinⅣ,AngⅣ)是AngⅡC末端的六肽片段,与能量代谢、细胞增殖、炎症反应等密切相关[1-2]。其特异性受体AT4是一种胰岛素调节的氨基肽酶(insulin-regulated aminopeptidase,IRAP)[3-4],与葡萄糖转运子GLUT4联合位于细胞内膜的囊泡中。当胰岛素水平发生变化时,IRAP和GLUT4一起移动至胞浆膜上,调节葡萄糖的摄取[5-6]。在IRAP敲除的小鼠,GLUT4表达降低,同时心脏尺寸增大[7]。本研究亦发现,AngⅣ是一个致心肌肥厚的因子,但对其相关信号通路研究较少[8]。已有资料证明[9],AngⅡ可损伤磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)依赖途径激活的蛋白激酶B(protein kinase B,Akt),使内皮型一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)磷酸化,从而损伤胰岛素信号通路,在胰岛素抵抗中有重要病理生理意义。AT4受体本身就是受胰岛素调节的氨基肽酶——那么,AngⅣ的作用是否也与胰岛素信号通路受损有关?胰岛素/Akt通路在AngⅣ诱导心肌肥大的病理生理过程中有什么作用?这是值得探讨的问题。
1 材料与方法
1.1 动物与主要试剂 清洁级SD乳鼠,1~3d龄,第三军医大学大坪医院实验动物中心提供,动物许可证:SCXK(渝)2007-0005。AngⅣ、胰蛋白酶、5′-溴-2-脱氧尿嘧啶核苷(5′-BrdU)均 购 自 Sigma公 司;LY294002、L-硝 基-精 氨 酸 甲 酯(NG-nitro-L-arginine-methyl ester,L-NAME)、RIPA裂解液、BCA蛋白浓度测定试剂盒(增强型)、总NO检测试剂盒、辣根过氧化物酶标记山羊抗兔IgG等均购自江苏碧云天公司;大鼠eNOS ELISA试剂盒购自上海西唐生物科技有限公司;Trizol、逆转录试剂盒均购自大连宝生物公司。其余均为国产分析纯。

表1 实时荧光定量PCR基因扩增引物序列
1.2 方法
1.2.1 心肌细胞培养与分组 胰蛋白酶消化法培养乳鼠心室肌细胞[10]。细胞分为(1)正常对照组:加入等体积无血清的DMEM 培养基;(2)不同浓度 AngⅣ组:AngⅣ(0.01、0.1及1nmol/L);(3)AngⅣ(1nmol/L)+LY294002(0.02mmol/L)组;(4)AngⅣ(1nmol/L)+ L-NAME(0.1mmol/L)组。
1.2.2 心肌细胞表面积测量 将心肌细胞接种于加有盖玻片的6孔板中,常规HE染色后用Leica Qwin V3医学图像分析系统(德国Leica公司)测量单个细胞表面积,每张玻片测5个视野,每个视野测10~15个细胞,取其平均值,每组重复3次。
1.2.3 Real-time PCR法检测心房利钠因子(atrial natriuretic factor,ANF)、Akt及eNOS mRNA的表达 用Trizol提取心肌细胞总RNA,按照说明书要求进行逆转录-聚合酶链反应,利用SYBR绿色荧光技术在Icycler System荧光定量PCR仪完成mRNA表达的检测。引物由大连宝生物公司合成,序列见表1。以β-actin为内参,荧光强度到达阈值时的循环数Ct值为统计参数,相对定量法进行结果的分析处理,每组重复3次。
1.2.4 Western blot法检测Akt蛋白表达 取蛋白100μg,聚丙烯酰胺变性凝胶分离,电转膜法转移到PVDF膜上,5%蛋白干粉封闭90min,加一抗(Akt:1∶400稀释;β-actin:1∶1 000稀释)。4℃过夜,辣根过氧化物酶标记二抗(1∶1 000稀释)孵育60min。洗膜,用发光剂(ECL)显色、凝胶成像仪与Quantity one软件显影。以β-actin为内参,计算各组Akt表达的相对量。每组重复3次。
2 结 果
2.1 AngⅣ诱导心肌细胞肥大 与正常组比较,AngⅣ0.01、0.1和1nmol/L使心肌细胞表面积浓度依赖性增加,ANF mRNA亦明显增加(P<0.05,图1A、B,表2)。PI3K抑制剂LY294002(0.02mmol/L)和 NOS抑制剂 L-NAME(0.1 mmol/L)均可使AngⅣ1nmol/L在细胞表面积和ANF mRNA表达增加的作用增强(图1C、D,表2)。
2.2 AngⅣ对大鼠心肌细胞Akt及eNOS mRNA表达和Akt蛋白的影响 正常大鼠心肌细胞Akt及eNOS mRNA的表达均较高,AngⅣ1nmol/L使其表达分别降低为原来的71.4%和63.7%(P<0.01)。LY294002和L-NAME均明显增加AngⅣ的作用,使其表达进一步降低(P<0.05),见图2。AngⅣ对Akt蛋白表达的影响与对mRNA的作用一致,使其下调,LY294002和L-NAME则加强 AngⅣ的作用(P<0.05),见图3。
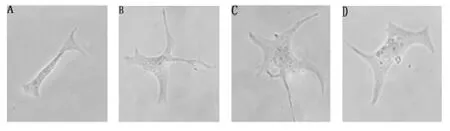
图1 大鼠心肌细胞HE染色(×400)

图2 AngⅣ对大鼠心肌细胞Akt和eNOS mRNA表达的影响
表2 AngⅣ诱导大鼠心肌细胞肥大±s,n=3)

表2 AngⅣ诱导大鼠心肌细胞肥大±s,n=3)
组别 细胞表面积(μm2/cell)ANF mRNA正常对照组 630.1±38.7 51.1±11.9 AngⅣ0.01nmol/L 854.1±98.0* -AngⅣ0.1nmol/L 947.8±107.9* -AngⅣ1nmol/L 1 064.3±98.6** 88.3±13.6*
续表2 AngⅣ诱导大鼠心肌细胞肥大(±s,n=3)

续表2 AngⅣ诱导大鼠心肌细胞肥大(±s,n=3)
*:P<0.05,**:P<0.01,与正常对照组比较;#:P<0.05,##:P<0.01,与AngⅣ1nmol/L组比较;-:表示无数据。
组别 细胞表面积(μm2/cell)ANF mRNA AngⅣ1nmol/L+ LY294002 0.02 mmol/L 1 389.7±121.4# 130.3±15.9#AngⅣ1nmol/L+ L-NAME 0.1 mmol/L 1 360.0±136.6# 149.7±18.2##
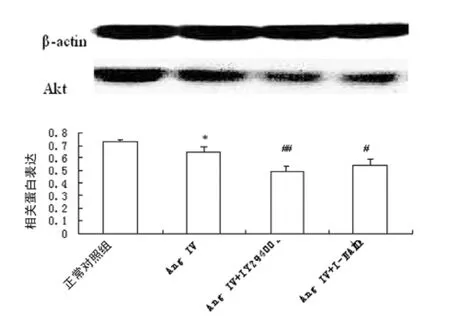
图3 AngⅣ对大鼠心肌细胞Akt蛋白表达的影响
2.3 AngⅣ对大鼠心肌细胞培养液中eNOS和NO浓度的影响 正常心肌细胞eNOS和NO含量均较高,AngⅣ0.01、0.1、1nmol/L使二者浓度依赖地降低(P<0.05)。LY294002和L-NAME均使AngⅣ的作用加强(P<0.05),见表3。
表3 AngⅣ对大鼠心肌细胞培养液中eNOS和NO含量的影响(±s,n=6)
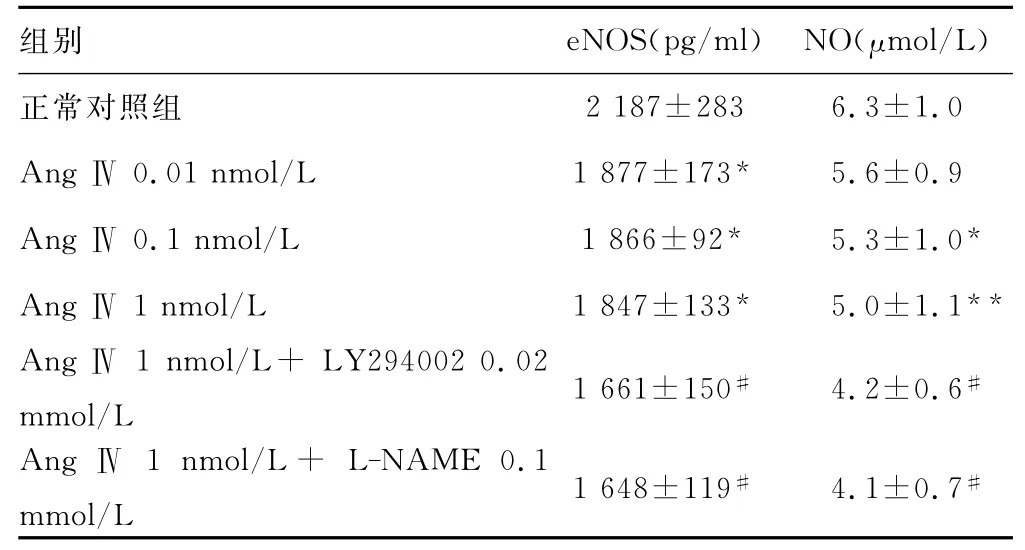
表3 AngⅣ对大鼠心肌细胞培养液中eNOS和NO含量的影响(±s,n=6)
*:P<0.05,**:P<0.01,与正常对照组比较;#:P<0.05,与AngⅣ1nmol/L组比较。
组别 eNOS(pg/ml) NO(μmol/L)2 187±283 6.3±1.0 AngⅣ0.01nmol/L 1 877±173* 5.6±0.9 AngⅣ0.1nmol/L 1 866±92* 5.3±1.0*AngⅣ1nmol/L 1 847±133* 5.0±1.1**AngⅣ1nmol/L+ LY294002 0.02 mmol/L 1 661±150# 4.2±0.6#Ang Ⅳ 1nmol/L+ L-NAME 0.1 mmol/L 1 648±119# 4.1±0.7正常对照组#
3 讨 论
心肌肥厚是临床最常见的心血管疾病之一。虽然已经进行了广泛的研究,但其病理生理机制及参与因子并不完全清楚。目前普遍公认RAS在心肌肥厚发生发展中具有重要作用。AngⅡ是RAS的主要效应激素,可通过多条信号通路诱导心肌肥厚[11]。AngⅣ是AngⅡ的降解片断,目前对其在心血管系统方面的作用研究较少。纳摩尔水平的AngⅣ激活其特异性AT4受体,竞争性抑制IRAP的催化特性,产生相应生物学效应[12]。本研究结果显示,AngⅣ在0.01、0.1、1nmol/L可浓度依赖地增加心肌细胞的表面积,同时使心肌肥厚特异性因子ANF mRNA表达增加,提示低浓度的AngⅣ有类似于AngⅡ的作用,也是一个致心肌肥大的活性因子。
最近的研究证实胰岛素信号通路参与心肌细胞的正常生长和蛋白质合成,对于维持心血管的正常功能有重要作用。如果该通路异常,在胰岛素抵抗状态下,将会导致心血管功能的紊乱,出现心血管系统疾病,诱导心肌肥厚发生[13]。胰岛素的大多数生物学效应是通过PI3K/Akt信号途径介导的,NO是其重要的“终末效应子”[14]。PI3K/Akt-eNOS-依赖信号机制及其代谢产物的调节,对于心血管系统的保护作用具有重要的临床意义。有研究显示,AngⅡ可引起PI3K/Akt-eNOS信号通路损伤,导致心肌肥厚[9]。AngⅣ的致肥大作用是否也与该通路的受损有关?目前国内外未见相关报道。
本研究结果显示,在AngⅣ诱导的心肌细胞肥大中,Akt和eNOS mRNA表达均明显被抑制,Akt的蛋白表达下调,细胞培养液中eNOS的含量减少,NO的释放亦下降。这些结果提示PI3K/Akt-eNOS信号途径受损在AngⅣ诱导心肌肥大过程中有重要意义。为进一步确证该实验结果,作者还利用PI3K抑制剂LY294002和NOS抑制剂L-NAME进行了相应研究。结果显示,无论是心肌细胞表面积和ANF mRNA的表达,还是Akt mRNA和蛋白水平的表达,以及eNOS和NO的含量,LY294002和L-NAME均使AngⅣ的作用加强,再次提示AngⅣ诱导的心肌肥大作用与PI3K/Akt-eNOS-NO信号通路被抑制有紧密联系。在上述指标的改变中,LY294002的作用明显强于L-NAME,同时也说明NO不是该通路的惟一下游因子,AngⅣ的致肥大作用还有其他因素参与。作者另外的研究结果提示[8],PPARα信号通路在AngⅣ的致心肌细胞肥大中有重要作用,说明AngⅣ的作用也是一个多因素共同参与的结果。
综上所述,AngⅣ致心肌细胞肥大作用与其对PI3K/Akt信号通路的抑制密切相关,但AngⅣ对该通路下游的信号转导因子的影响需要更深入地研究。
[1] Ruiz-Ortega M,Esteban V,Egido J.The regulation of the inflammatory response through nuclear factor-κB pathway by angiotensinⅣextends the role of the rennin angiotensin system in cardiovascular diseases[J].Trends Cardiovasc Med,2007,17(1):19-25.
[2] Ribeiro-Oliveira AJr,Nogueira AI,Pereira RM,et al.The renin-angiotensin system and diabetes:an update[J].Vasc Health Risk Manag,2008,4(4):787-803.
[3] Wright JW,Yamamoto BJ,Harding JW.Angiotensin receptor subtype mediated physiologies and behaviors:New discoveries and clinical targets[J].Prog Neurobiol,2008,84(2):157-181.
[4] Stragier B,De Bundel D,Sarre S,et al.Involvement of insulin-regulated aminopeptidase in the effects of the reninangiotensin fragment angiotensin Ⅳ:a review[J].Heart Fail Rev,2008,13(3):321-337.
[5] Albiston AL,Peck GR,Yeatman HR,et al.Therapeutic targeting of insulin-regulated aminopeptidase:heads and tails[J].Pharmacol Ther,2007,116(3):417.
[6] Vanderheyden PM.From angiotensin Ⅳ binding site to AT4receptor[J].Mol Cell Endocrinol,2009,302(2):159-166.
[7] Keller SR.Role of the insulin-regulated aminopeptidase IRAP in insulin action and diabetes[J].Biol Pharm Bull,2004,27(6):761-764.
[8] 陈加飞,王全华,吴芹,等.PPAR-α参与血管紧张素Ⅳ诱导的心肌细胞肥大[J].基础医学与临床,2011,31(10):1094-1096.
[9] Wen Y,Zhang XJ,Ma YX,et al.Erythropoietin attenuates hypertrophy of neonatal rat cardiac myocytes induced by angiotensin-Ⅱin vitro[J].Scand J Clin Lab Invest,2009,69(4):518-525.
[10]徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002.
[11]Kumar R,Singh VP,Baker KM.The intracellular reninangiotensin system:implications in cardiovascular remodeling[J].Curr Opin Nephrol Hypertens,2008,17(2):168-173.
[12]Chai SY,Fernando R,Peck G,et al.The angiotensinⅣ/AT4receptor[J].Cell Mol Life Sci,2004,61(21):2728-2737.
[13]Yu W,Chen C,Fu Y,et al.Insulin signaling:apossible pathogenesis of cardiac hypertrophy[J].Cardiovasc Ther,2010,28(2):101-105.
[14]Yu Q,Gao F,Ma XL.Insulin says NO to cardiovascular disease[J].Cardiovasc Res,2011,89(3):516-524.
