铅对小鼠学习记忆功能影响与突触囊泡蛋白相关
2012-09-27武红娟
赵 奇,王 艳,武红娟,陈 于
(重庆医科大学公共卫生与管理学院劳动卫生与环境卫生教研室 400016)
铅是广泛存在于生产及生活环境中的重金属元素,长期接触铅能够造成机体多个系统损伤,其中铅对中枢神经系统的毒性作用越来越被人们重视。有研究表明,长期接触铅可导致严重的神经毒作用,造成神经行为障碍和认知能力低下等[1-2]。Morris水迷宫实验是作为检测实验大、小鼠空间学习记忆功能常用方法[3],海马脑区则是空间学习记忆功能的中枢[4]。突触囊泡蛋白(Synaptophysin,Syn)是突触囊泡的一种特异性标志蛋白,与胞吐作用密切相关[5]。Syn变化可间接反映体内突触的数量和分布情况,与突触重建及认知过程密切相关,其缺乏可导致学习记忆功能下降[6]。Syn在学习记忆过程中发挥重要作用,并且其与铅所致学习记忆功能损伤的关系研究较少。本实验拟对海马区Syn表达与铅所致小鼠学习记忆功能损伤关系进行研究,进而探讨铅的神经毒性作用相关机制。
1 材料与方法
1.1 实验动物及分组 清洁级8~9周龄雄性昆明小鼠24只[(购自大坪医院野战外科研究所医学实验动物中心,许可证编号:SCXK(渝)2007-0005]。动物饲养温度:(21±2)℃,室内光照12h(光照时间08:00到20:00),动物进食标准基础饲料,自由进水。适应性喂养1周后,将小鼠随机分为两组,对照组和铅染毒组,每组12只。
1.2 主要试剂及仪器 醋酸铅(Sigma,美国)纯度99.99%,突触囊泡蛋白单克隆抗体(AB8049,Abcam,美国),驴抗小鼠荧光抗体IRDye800CW(LI-COR,美国),β-actin抗体(Sigma,美国)。MT-200型Morris水迷宫视频跟踪系统(成都泰盟,中国),蛋白电泳系统(Bio-Rad,美国),Odyssey红外荧光扫描成像系统(LI-COR,美国),DM6000B型倒置光学显微镜及图像采集系统(Leica,德国)。
1.3 铅染毒实验 铅染毒组小鼠饲养饮水由醋酸铅溶于蒸馏水中配制,醋酸铅浓度2.4mmol/L,剂量参照文献[7-9],并经预实验确定;对照组饮水则为蒸馏水。饲养过程中,笼具、饮水瓶等所有用具均使用不含铅的制品。各组动物自由进食、饮水,喂养30d后对动物进行各项测试。
1.4 Morris水迷宫实验 实验方法参照文献[10]进行:水池直径120cm,池深50cm;平台直径10cm,位于水面下1cm。水池平分为四个象限,平台位于其中一象限正中位置,实验开始后平台位置固定不变,摄像头位于迷宫正中上方位置。迷宫内水温保持在(23±2)℃,池水加奶粉使之浑浊。水迷宫实验正式开始前24h,各组小鼠均放入迷宫内(无平台)自由游10次,每次60s,使之适应迷宫内环境。在铅暴露第30天,对照组和铅染毒组进行水迷宫定位航行实验。实验时,将小鼠面朝水迷宫池壁,随机从四个象限中的一个象限中点轻轻放入水迷宫。每次训练设定时限60s,若60s内小鼠找到隐藏在水面下的平台,则让小鼠在平台上停留30s,并记录其找到隐藏平台的时间,即逃逸潜伏期;若60s内小鼠未能找到平台,则将小鼠轻轻引导至平台上,并使之在平台上停留30s,逃逸潜伏期记为60s。同时系统会记录小鼠搜索平台的轨迹。一次训练结束后,将小鼠擦干后,放在取暖器旁休息,等待下一次训练,每次训练间隔15min,每只小鼠共训练8次。水迷宫实验结束后24h,每组随机取9只小鼠用水合氯醛麻醉,断头处死,取其海马组织,组织冻存于-80℃备用;另外3只小鼠则用于做脑组织切片。
1.5 海马区HE切片实验 将水迷宫实验结束后的两组中的小鼠各3只,参照文献[11]方法,取小鼠全脑做连续冠状切片,常规HE染色后显微镜下观察小鼠铅染毒后海马CA1、CA3和齿状回区神经元变化。
1.6 Western blot实验 将冻存的组织加RIPA匀浆裂解后,提取海马组织总蛋白,BCA法测定蛋白浓度,上样量60μg,10%SDS-PAGE电泳,转膜至NC膜,5%脱脂奶粉的PBS缓冲液封闭。突触囊泡蛋白单克隆抗体(1∶1000)4℃孵育过夜,TBST洗膜,驴抗小鼠荧光二抗(1∶5 000)室温孵育1h,洗膜,Odyssey红外荧光扫描成像系统扫描条带,用Odyssey系统软件对目的条带荧光光密度进行分析。β-actin做内参,两组结果再行比较。
1.7 统计学处理 两组小鼠每次水迷宫逃逸潜伏期和Western blot实验结果,以±s表示,采用SPSS13.0统计软件进行单因素方差分析,检验水准α=0.05。
2 结 果
2.1 Morris水迷宫实验 (1)各组小鼠连续8次水迷宫实验逃逸潜伏期结果见表1。结果显示对照组小鼠随训练次数的增加,其逃逸潜伏期逐渐缩短,即搜索到隐藏平台所用时间逐渐减少。铅染毒组小鼠学习记忆功能明显受损,表现为第3次(P<0.05)、第4次至第8次(P<0.01)水迷宫实验,铅染毒组小鼠逃逸潜伏期与对照组比较显著延长(P<0.05)。(2)轨迹图(图1)为第8次训练各组小鼠水迷宫轨迹。从轨迹图上看,对照组小鼠经过连续8次训练后,找寻平台的方向性明确,路径简单直接;铅染毒组小鼠搜索平台的轨迹与对照组比,目标性不明确,轨迹杂乱,经过训练虽然能够找到隐藏的平台,但其找寻平台的路径相对方向性不如对照组准确,无法快速有效搜寻到隐藏的平台。
表1 两组小鼠逃逸潜伏期比较(n=12,±s)
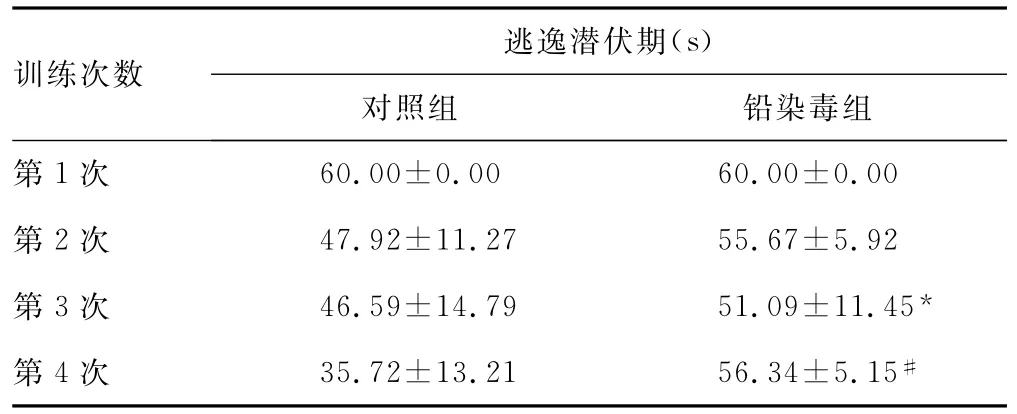
表1 两组小鼠逃逸潜伏期比较(n=12,±s)
训练次数逃逸潜伏期(s)对照组 铅染毒组第1次60.00±0.00 60.00±0.00第2次 47.92±11.27 55.67±5.92第3次 46.59±14.79 51.09±11.45*第4次 35.72±13.21 56.34±5.15#
续表1 两组小鼠逃逸潜伏期比较(n=12,±s)
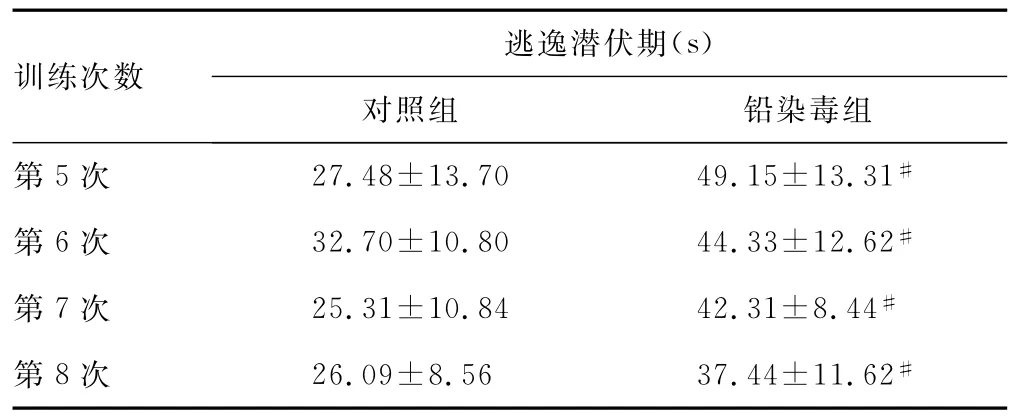
续表1 两组小鼠逃逸潜伏期比较(n=12,±s)
#:P<0.01,*:P<0.05,与对照组比较。
训练次数逃逸潜伏期(s)对照组 铅染毒组第5次 27.48±13.70 49.15±13.31#第6次 32.70±10.80 44.33±12.62#第7次 25.31±10.84 42.31±8.44#第8次 26.09±8.56 37.44±11.62#
2.2 Western blot检测结果 与对照组比较,铅染毒组小鼠海马区中Syn表达水平显著降低(P<0.05),见图2。

图1 经过连续8次训练后各组小鼠水迷宫轨迹图
2.3 海马区神经元HE切片形态观察 结果显示,铅染毒组小鼠海马区较对照组无明显变化。对照组和铅染毒组海马神经元呈带状分布,排列整齐,CA1、CA3区锥体细胞及齿状回区颗粒细胞形态均正常,核居中,大而圆,染为淡蓝色,核仁核膜清晰,核仁染为紫色,胞质红色且着色均匀,见图3。

图2 Western blot检测Syn结果

图3 两组小鼠海马区HE切片结果(×50)
3 讨 论
现有研究认为铅直接的神经毒性主要是促进细胞凋亡、神经系统兴奋性中毒及对神经递质储存与释放的影响[12-13]。而本研究结果提示Syn在铅导致的神经毒性机制中可能亦发挥重要作用。
本研究中,Morris水迷宫实验结果显示铅染毒组小鼠逃逸潜伏期较对照组显著延长,表明慢性铅暴露可导致小鼠空间学习记忆功能损伤。由于海马是空间学习记忆重要脑区,其功能受到抑制时将会导致学习记忆功能下降[14]。
有文献指出,大鼠长期饮用高铅水,铅可通过血―脑屏障对大鼠大脑皮层和海马组织造成明显病理损伤,本实验中并未发现铅对小鼠海马造成明显病理损伤[15],但 Morris水迷宫却显示铅已经导致了小鼠学习记忆功能损伤,提示铅导致的学习记忆功能损伤可能并非是单纯由其导致的病理变化引起。
Syn与突触囊泡的胞吐作用密切相关,其变化可间接反映体内突触的数量和分布情况,与认知过程及突触重建密切相关,Syn的缺乏可导致学习记忆功能下降[6]。Western blot结果显示,铅染毒组小鼠海马中Syn表达较对照组显著降低。结合水迷宫实验和海马HE切片结果,提示铅染毒造成的小鼠学习记忆功能损伤,在其出现病理损伤前可能是由于铅导致小鼠海马区Syn表达水平降低造成。但是铅如何通过影响Syn表达进而引起铅染毒小鼠学习记忆功能损伤,仍需要进一步研究。
[1] 杨坦,丁玉琴,刘萍.铅暴露对大鼠学习记忆功能和海马CA1区 LTP的影响[J].医学信息,2008,21(6):872-875.
[2] Chang W,Chen J,Wei QY,et al.Effects of Brn-3aprotein and RNA expression in rat brain following low-level lead exposure during development on spatial learning and memory[J].Toxicol Lett,2006,164(1):63-70.
[3] 曲巍,王孝文,王金平.鼠脑穹窿海马伞切断突触素动态变化及Morris水迷宫重复训练对其影响[J].解剖学研究,2009,31(6):414-419.
[4] 田枫,齐晓旭,郑振辉.α-亚麻酸对大鼠学习记忆功能和海马神经元的影响[J].中国老年学杂志,2009,29(6):664-666.
[5] Arthur CP,Stowell MH.Structure of synaptophysin:a hexameric MARVEL-domain channel protein[J].Structure,2007,15(6):707-714.
[6] Schmitt U,Tanimoto N,Seeliger M,et al.Detection of be-havioral alterations and learning deficits in mice lacking synaptophysin[J].Neuroscience,2009,162(2):234-243.
[7] 高双,宫慧芝,姜泓,等.PKC-γ和ERK在慢性染铅小鼠脑皮质区的异常表达[J].中国医科大学学报,2008,37(5):627-640.
[8] 彭博,吴哲,张朝东.铅对小鼠大脑皮层神经元磷脂酰肌醇3激酶影响[J].中国公共卫生,2010,26(2):228-229.
[9] 郝凤进,高双,袁莹,等.慢性铅暴露对小鼠脑皮质区ERK蛋白表达的影响[J].贵阳医学院学报,2008,33(1):16-18.
[10]Morris R.Developments of a water-maze procedure for studying spatial learning in the rat[J].Neurosci Methods,1984,11(1):47-60.
[11]刘剑,秦大莲,黄新武,等.脑舒胶囊对阿尔茨海默病大鼠学习记忆力的改善及海马神经元的保护[J].中药药理与临床,2010,26(4):54-57.
[12]Lidsky TI,Schneider JS.Lead neurotoxicity in children:basic mechanisms and clinical correlates[J].Brain,2003,126(1):5-19.
[13]Verina T,Rohde CA,Guilarte TR.Environmental lead exposure during early life alters granule cell neurogenesis and morphology in the hippocampus of young adult rats[J].Neuroscience,2007,145(3):1037-1047.
[14]许志强,张涛,张猛,等.proBDNF对老龄鼠空间学习与记忆功能的影响[J].重庆医学,2008,37(7):683-685.
[15]蒋军军,贾庆华,刘春杰,等.醋酸铅对小鼠星形胶质细胞的凋亡作用[J].工业卫生与职业病,2010,36(4):224-229.
