亚甲蓝血浆病毒灭活对凝血因子的影响
2012-09-27赵树铭刘凤君蒋天伦
宋 敏,赵树铭,刘凤君,郭 辉,蒋天伦△
(第三军医大学西南医院,1:输血科;2:检验科,重庆 400038)
近年来,随着人们生活水平和医疗保障水平的不断提高,输血的安全性问题,越来越受到公众的重视和关注,虽然对献血员都进行了筛选,但是由于当前科技水平的限制,检测方法较为局限,存在病毒标记物检测技术的局限性、窗口期、试剂敏感性、检测病毒种类的局限性等[1],血液输注仍无法达到“零风险”。由于有些病毒颗粒片段存在于血浆中[2],输注血浆传播某些传染病的可能性高于全血,故对血浆进行病毒灭活是当前提高输血安全性的重要措施。目前已有的血浆病毒灭活方法很多[3],但对于单袋血浆病毒灭活最常用的是亚甲蓝(MB)光化学法血浆病毒灭活[4-5],该方法现已在我国多家血站实行。据报道,MB光化学血浆病毒灭活方法几乎可以灭活所有细胞外的含脂薄膜病毒,如可经血液传播的艾滋病毒(HIV),乙型肝炎病毒(HBV),丙型肝炎病毒(HCV)等[6],但对于细胞内的病毒不具灭活作用,因此,在采用该方法进行血浆病毒灭活的同时,还需滤除血液中的白细胞[7]。但是,如果经过病毒灭活处理后,虽然杀灭或去除了可能存在的病毒,但却对其中的有效血液成分的活性和(或)活力造成严重损伤,那就失去了病毒灭活的意义。尤其是现已证明冷沉淀是所有血液成分中病毒含量最高的[2],用病毒灭活血浆制备冷沉淀就显得尤为重要了。基于此,本研究对冷沉淀的主要有效成分且对病毒灭活较为敏感的凝血因子Ⅷ(FⅧ)及纤维蛋白原(Fib)进行了如下实验研究。
1 材料与方法
1.1 仪器与试剂 日本蓝桥血凝仪(Sysmex CA-7000),淄博中保康医用病毒灭活柜(ZBK-YBM-01),BECKMAN 低温离心机(Jb-MC Centrifuge),SANYO速冻冰箱(CFC-free型),四联采血袋(南京赛尔金),含有MB添加元件的病毒灭活柜配套一次性病毒灭活血袋(淄博中保康),Fib检测试剂(德国 Marburg Lot:537511),FⅧ:C(FⅧ活性)检测试剂(德国 Marburg Lot:500881B)。
1.2 标本来源 均来自本血站街头无偿献血血液标本。随机抽取16袋400mL全血,于6h内进行血液成分分离。将所得血浆充分混匀后无菌等量分装于两个相同空血袋内,热合封口后分别归为实验组和对照组。同时留取血浆小辫子一份,做好标记用于检测FⅧ及Fib。整个操作过程严格按照标准操作规程(SOP)文件(根据《血站质量管理规范》制定)要求进行。
1.3 血浆病毒灭活处理 采用一次性病毒灭活血袋对血浆进行病毒灭活处理主要有两个步骤:光照及过滤。作者通过无菌操作将两组血浆与一次性血浆病毒灭活专用血袋相连,其中实验组血浆中加入 MB(浓度1μmol/L),对照组血浆中不加入MB,两组血浆同时放入病毒灭活辐照箱内进行光照处理(光照强度25 000~30 000 1ux,温度5~10℃,摆动频率60次/分钟条件下作用30min),光照后分别留取血浆小辫子一份,做好标记用于检测FⅧ及Fib;按要求过滤后再分别留取血浆小辫子一份,做好标记备检。将三组备检小辫子立即放于-50℃冰箱速冻。整个操作过程严格按照SOP文件(根据《血站质量管理规范》制定)要求进行。
1.4 凝血因子检测 3d后,于-50℃冰箱取出三组小辫子,37℃水浴箱中复溶后,立即检测FⅧ及Fib。Sysmex CA-7000血凝仪检测原理为免疫比浊法。检测过程严格按照凝血因子检测操作规程进行。
1.5 统计学处理 结果在SPSS11.0统计学软件上进行t检验分析,P<0.05为差异有统计学意义。
2 结 果
实验组与对照组FⅧ:C及Fib浓度病毒灭活处理前后、光照前后变化差异有统计学意义(P<0.05),见表1、2,两组过滤前后比较差异无统计学意义(P>0.05),见表3。
表1 两组血浆病毒灭活处理前后凝血因子减少值(±s)

表1 两组血浆病毒灭活处理前后凝血因子减少值(±s)
组别 n FⅧ:C(%) Fib(g/L)对照组16 4.54±7.58 0.05±0.069实验组16 32.81±10.47 1.06±0.260
表2 两组血浆光照前后凝血因子减少值(±s)
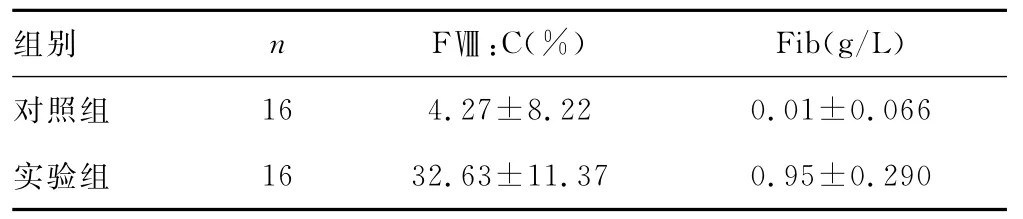
表2 两组血浆光照前后凝血因子减少值(±s)
组别 n FⅧ:C(%) Fib(g/L)对照组16 4.27±8.22 0.01±0.066实验组16 32.63±11.37 0.95±0.290
表3 两组血浆过滤前后凝血因子减少值(±s)
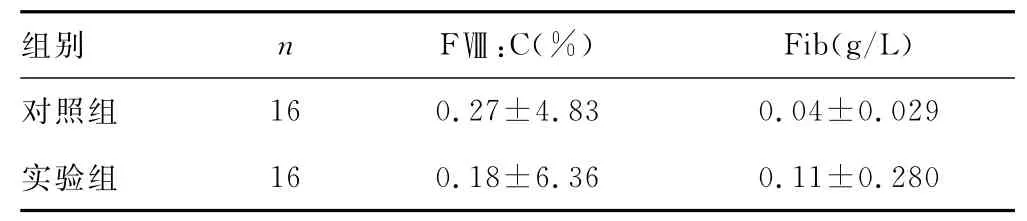
表3 两组血浆过滤前后凝血因子减少值(±s)
组别 n FⅧ:C(%) Fib(g/L)对照组16 0.27±4.83 0.04±0.029实验组16 0.18±6.36 0.11±0.280
3 讨 论
MB光化学法血浆病毒灭活技术已相当成熟,该方法进行血浆病毒灭活操作简便,且能灭活几乎所有有包膜病毒[8],但是,关于用MB光化学法病毒灭活后的血浆能否用于制备符合质量要求的冷沉淀还尚有争议[9-12]。本实验中将同一人份血浆均分为两份,分别进行加入MB与未加MB光照处理,观察MB光化学法血浆病毒灭活对冷沉淀中较为重要且较敏感的凝血因子的影响,实验结果显示,MB光化学法血浆病毒灭活对FⅧ及Fib均有较大程度上的影响。加入MB的实验组血浆经病毒灭活后,FⅧ:C平均损失率达40.5%,Fib平均损失率达47.6%,与未加入MB的对照组比较差异有统计学意义(P<0.05)。同时由三组数据对比可看出,病毒灭活过程中FⅧ:C及Fib的损耗主要来源于MB光化学反应,而单纯光照处理影响不大,且实验组和对照组过滤前后FⅧ:C及Fib浓度的损失率相比较差异无统计学意义(P>0.05)。本实验中,考虑到冷沉淀制备过程中人为因素影响较大,如冷沉淀中血浆保留量的影响等,未直接跟踪检测在制备为冷沉淀以后凝血因子的水平,而是留取检测标本后均按照冷沉淀原料血浆保存过程处理:三组小辫子标本留取后立即放于-50℃冰箱速冻,待3 d以后于37℃水浴箱中复溶待检,故本实验可以对制备成冷沉淀后质量进行预测。由于通过常规标准操作制备冷沉淀时,凝血因子也还会有一定的损失,故由实验结果可看出病毒灭活血浆制备为冷沉淀后凝血因子活性不符合质量要求标准。因此,在血液成分制备中,可考虑先将新鲜冰冻血浆制备成冷沉淀后再将血浆进行病毒灭活。
目前输血安全性已获得显著提高,总体上血液已非常安全,但是由于病毒窗口期以及检测试剂灵敏度等问题,仍然存在输血传播艾滋病和肝炎等传染病的危险。据报道美国90%以上输血传播HIV和HBV以及75%以上输血传播HCV的危险均来自窗口期感染献血[13]。我国血站主要采用ELISA(酶联免疫吸附试验)方法对血液中HBV,HCV及HIV等进行检测,该法试剂灵敏度差异较大且窗口期较长[14],而据报道即便是用灵敏度较高的核酸检测也只能将HIV检测窗口期由22d缩短到12d,HCV检测窗口期由70d缩短到14d[15]。另外尚有很多未被认识或一时难以找到有效检测手段的病毒存在经输血传播给受血者的危险。因此,对血液成分进行病毒灭活处理,是从根本上控制或杜绝经输血途径传播疾病的重要措施。现在都提倡成分输血,对于所有血液成分中病毒含量最高、输注危险性最大的冷沉淀,则更应进行病毒灭活处理后用于临床。但是我国目前推广使用的MB光化学法血浆病毒灭活对血浆中一些有效成分,尤其是凝血因子影响较大,病毒灭活后血浆不适合用于制备冷沉淀,因此,还有待努力寻找一种更安全可靠的病毒灭活技术,以更大限度地提高输血安全性。
[1] 江朝富.临床输血风险及对策[J].实用医学杂志,2003,19(3):226-228.
[2] 黎劲.去白细胞输血的临床应用[J].右江民族医学院学报,2007,29(1):97-98.
[3] 李忠平.临床输用血浆病毒灭活的研究进展[J].国外医学输血及血液学分册,2001,24(2):157-159.
[4] 宋玉和.血液成分病毒灭活与安全输血[J].临床血液学杂志:输血与检验版,2007,4(1):77-78.
[5] 沈莉,李建民,梁晓虎,等.亚甲蓝/光化学病毒灭活法对血浆蛋白浓度及凝血因子活性的影响[J].中国输血杂志,2006,19(6):474-475.
[6] Abe H,Yamada-Ohnishi Y,Hirayama J,et al.Elimination of both cell-free and cell-associated HIV infectivity in plasma by a filtration/methylene blue photoinactivation system[J].Transfusion(Paris),2000,40(9):1081-1087.
[7] Jeff RM.A new paradigm for preventing transfusiontransmitted infections[J].Am J Clin Pathol,2007,128(6):945-955.
[8] 王敦成,卜凤荣,许金波,等.亚甲蓝/光化学法灭活血浆中指示病毒及对血浆成分影响的初步研究[J].中华实验和临床病毒学杂志,2000,14(1):52-55.
[9] 中华人民共和国国家质量监督检验检疫总局.GB 18469-2001全血成分及血质量要求[S].北京:中国标准出版社,2004.
[10]王飞,路志浩,古醒辉,等.亚甲蓝光化学法血浆病毒灭活前后血浆成分的变化[J].临床输血与检验,2010,12(2):97-100.
[11]王飞,卢舜华,叶小演,等.血浆病毒灭活后质量回顾性分析[J].重庆医学,2010,39(15):2043-2044.
[12]齐村生,任会莹,曾凤琴.病毒灭活新鲜冰冻血浆的质控指标初探[J].临床输血与检验,2009,11(3):253-254.
[13]Busch MP,Kleinman SH,Jackson B,et al.Committee report.Nucleic acid amplification testing of blood donors for transfusion-transmitted infectious diseases:Report of the interorganizational task force on nucleic acid amplification testing of blood donors[J].Transfusion (Paris),2000,40(2):143-159.
[14]Shan H,Wang JX,Ren FR,et al.Blood banking in China[J].Lancet,2002,360(9347):1770-1775.
[15]Chamberland ME,Alter HJ,Busch MP,et al.Emerging infectious disease issues in blood safety[J].Emerg Infect Dis,2001,7(3Suppl):552-553.
