早期大剂量纳洛酮对弥漫性轴索损伤患者β淀粉样前体蛋白的影响
2012-09-27白洪涛苗雨露
白洪涛,尹 勇,苗雨露,赵 万
(广东省深圳市龙岗区第二人民医院神经外科 518112)
弥漫性轴索损伤(Diffuse axonal injury,DAI)是一种头部在加速运动时脑深部组织因剪应力作用引起的原发性闭合性颅脑损伤,一直以来无特效的救治措施[1]。纳洛酮作为一种人工合成的非特异性阿片受体拮抗剂,在颅脑损伤后早期应用可抑制阿片受体的激活,从而产生降低颅内压、减轻脑水肿、改善脑代谢及意识障碍的作用。但其治疗颅脑损伤的用量、疗程仍存在争议[2]。β淀粉样前体蛋白(β-APP)是一种具有受体样结构的大分子跨膜糖蛋白,由高尔基体产生并由轴突的快轴浆运输通道运输[3-4]。有研究表明,DAI后不久神经元β-APP的表达即上调,检测DAI后血浆β-APP的浓度可作为判断DAI损伤严重程度及治疗有效与否的可靠指标[1]。本实验通过观察早期大剂量纳洛酮治疗后DAI患者β-APP浓度的变化,以期为大剂量纳洛酮用于临床治疗DAI的安全性及有效性提供理论依据。
1 资料与方法
1.1 一般资料 2007年6月至2011年3月在本院经临床检查诊断为DAI的56例患者纳入本研究。其中,男33例,女23例;年龄20~62岁,平均(33.32±10.26)岁。因交通肇事致伤者31例,高处坠落致伤者13例,打击致伤者5例,手术致者7例。参照文献[5]确立本组患者的纳入标准:(1)头部遭受加速性旋转外力作用;(2)创伤后昏迷,但受伤后至入院时间小于6 h;(3)CT扫描和(或)MRI检查证实大脑皮质和髓质交界处、神经核团和白质交界处、胼胝体、脑干有单发或多发直径小于2cm的无占位效应出血灶及脑室内出血、脑弥漫性肿胀、蛛网膜下腔出血,中线结构无明显移位;(4)无明确定位神经体征。排除标准:(1)患有高血压病、糖尿病、肝肾功能不全等严重慢性疾病者;(2)严重的多发伤和(或)复合伤者;(3)已使用其他类似药物或对纳洛酮代谢造成影响的药物者;(4)入院时已双瞳孔散大、眼球固定、无自主呼吸者。56例患者中,伴发脑挫裂伤者14例,伴发颅内血肿者8例,伴发脑室内出血者5例。格拉斯哥昏迷评分(GCS)3~5分者31例,6~8分者25例,平均5.84分。根据患者同等伤情随机分为对照组、小剂量治疗组及大剂量治疗组,分别为18、19、19例。3组患者年龄(F=0.037,P=0.963)、性别(χ2=2.144,P=3.142)、GCS评分(F=0.654,P=0.526)、致伤原因(χ2=0.70,P=0.15)等临床指标比较,差异无统计学意义,见表1。
1.2 治疗方法 取得所有患者家属的知情同意后,对照组常规给予保持呼吸道通畅、循环支持、降颅压、防治血管痉挛、维持内环境平衡等治疗。小剂量、大剂量治疗组在对照组的常规治疗基础上,分别按0.1、0.4mg·kg-1·d-1的剂量给予纳洛酮治疗,加入生理盐水250mL另管静脉滴注,维持24h;3d后将剂量调整为4.8mg/d,加入生理盐水250mL另管静脉滴注,维持24h;共治疗10d。治疗前及治疗后1、3、7d,采集患者晨起空腹静脉血2mL于乙二胺四乙酸(EDTA)抗凝管中,轻轻摇匀以充分抗凝,分离血浆,-20℃冰箱保存待测。参照文献[6]的方法制作十二烷基硫酸钠-聚丙烯酰胺凝胶(SDSPAGE)。在微量离心管中,用2倍SDS加样缓冲液1∶1稀释待测血清样品,100℃煮沸5min。100V恒压下电泳至溴酚蓝前沿到达分离胶,将电压调整至200V,继续电泳至预染蛋白质分子质量标准所示目的分子质量出现为止。用转移缓冲液冲洗凝胶,并浸泡30min进行平衡。剪一块凝胶大小的硝酸纤维素(NC)滤膜标记正反面,转移缓冲液浸泡15min.将纤维垫片、滤纸、NC滤膜及凝胶置入含有冷却装置的转移槽中。注入4℃转移缓冲液,100V电转移60min。后取出NC滤膜,TBS缓冲液冲洗后置入3%的牛血清清蛋白(BSA)中,室温下振动60min;将NC滤膜置于抗APP一抗孵育,室温下振动60 min;用TTBS冲洗NC滤膜6次,每次室温振动5min;将NC滤膜置于辣根过氧化物酶(HRP)标记的山羊抗小鼠二抗中孵育,室温下振动60min;用TIBS冲洗6次,每次振动5min;将化学发光底物(ECL)A、B液等体积混合;NC滤膜浸润在混合液中5min;将NC滤膜在暗室中置X线感光胶片上曝光30s,将感光胶片放入显影剂中5min,清水冲洗2次,放入定影剂中10min,清洗,晾干。图像分析采用Tiger凝胶图像分析仪进行。采用Western blot检测3组患者血浆β-APP的平均吸光度值,以此表示β-APP表达。治疗后1、3、7d,采用GCS评分系统对患者进行评分;同时,在治疗过程中观察并记录皮疹、肝肾功能损害、躁狂、精神障碍等与过量应用纳洛酮的药物不良反应,评估药物的安全性。
表1 对照组、小剂量及大剂量治疗组患者一般情况比较(±s)

表1 对照组、小剂量及大剂量治疗组患者一般情况比较(±s)
组别 n 年龄(岁) 性别(男/女) GCS评分(分) 致伤原因(n)车祸 高处坠落 打击 手术对照组 18 31.36±8.96 11/7 5.71±2.30 10 4 2 2小剂量治疗组 19 32.00±9.89 10/9 5.80±2.44 10 5 2 2大剂量治疗组 19 33.12±10.68 12/7 5.75±2.27 11 4 1 3
1.3 统计学处理 采用SPSS13.0软件进行统计学处理,所有数据均以±s表示,组间比较采用单因素方差分析和非参统计分析,P<0.05为差异有统计学意义。
2 结 果
2.1 不良反应结果 治疗期间,小剂量及大剂量治疗组均未发生皮疹、肝肾功能损害、躁狂、精神障碍等与过量应用纳洛酮相关的不良反应。
2.2 GCS评分比较 治疗后1、3d,对照组、小剂量及大剂量治疗组之间GCS评分比较,差异均无统计学意义(P>0.05);治疗后7d,对照组、小剂量及大剂量治疗组之间GCS评分比较,差异有统计学意义(P<0.05),见表2。
表2 治疗后不同时间对照组、小剂量及大剂量治疗组患者GCS评分比较(分,±s)
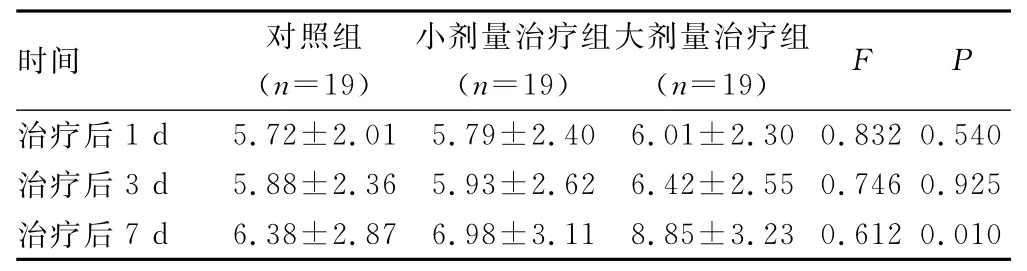
表2 治疗后不同时间对照组、小剂量及大剂量治疗组患者GCS评分比较(分,±s)
时间 对照组(n=19)小剂量治疗组(n=19)大剂量治疗组(n=19)F P治疗后1d 5.72±2.01 5.79±2.40 6.01±2.30 0.832 0.540治疗后3d 5.88±2.36 5.93±2.62 6.42±2.55 0.746 0.925治疗后7d 6.38±2.87 6.98±3.11 8.85±3.23 0.612 0.010
表3 治疗后不同时间对照组、小剂量及大剂量治疗组患者血清β-APP含量比较(ng/mL,±s)
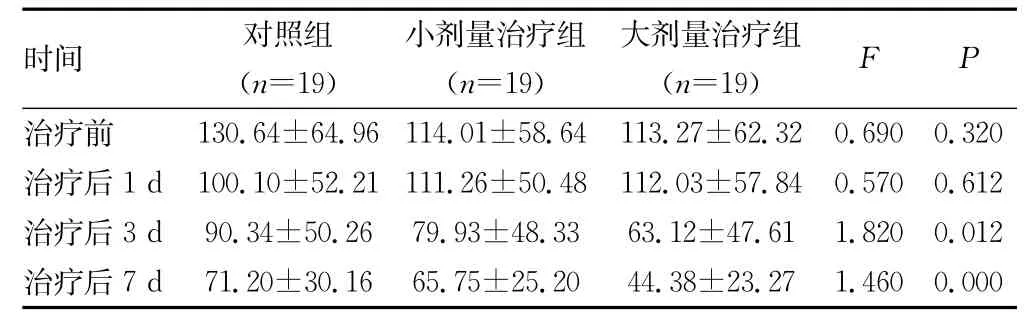
表3 治疗后不同时间对照组、小剂量及大剂量治疗组患者血清β-APP含量比较(ng/mL,±s)
时间 对照组(n=19)小剂量治疗组(n=19)大剂量治疗组(n=19)F P治疗前 130.64±64.96 114.01±58.64 113.27±62.32 0.690 0.320治疗后1d100.10±52.21 111.26±50.48 112.03±57.84 0.570 0.612治疗后3d90.34±50.26 79.93±48.33 63.12±47.61 1.820 0.012治疗后7d71.20±30.16 65.75±25.20 44.38±23.27 1.4600.000
2.3 β-APP含量比较 治疗前及治疗后1d,对照组、小剂量及大剂量治疗组患者血清中β-APP含量比较,差异无统计学意义(P>0.05);治疗后3、7d,对照组、小剂量及大剂量治疗组患者血清中β-APP含量比较,差异有统计学意义(P<0.05),见表3。治疗后1、3、7d,对照组、小剂量及大剂量治疗组患者血清中β-APP含量较治疗前差异有统计学意义(P<0.05)。
3 讨 论
DAI由于头部在外力作用下瞬间的旋转使脑在惯性驱使下作非线性加-减速运动,产生一种与旋转轴相垂直的剪切力;剪切力作用于神经纤维致轴索损伤,作用于脑实质血管致脑组织内点状出血[5]。以伤后数小时至数天出现轴突肿胀和轴突回缩球为主要病理学特征[6]。正常脑组织中β-APP主要存在于多囊结构、核膜、高尔基体和粗面内质网中,由于其表达水平很低而不易被检测[7]。在机械性损伤、缺血缺氧及兴奋性毒素等病理因素作用下,β-APP可作为一种快速反应性蛋白而诱导表达增高[8]。Sherriff等[9]研究发现,在肿胀的轴索中可见β-APP阳性反应,且头部损伤后β-APP阳性的轴索部位表现为DAI中所描述的轴索回缩球,提示轴索β-APP的免疫反应性可能代表了轴突损伤。外伤性脑损伤导致的细胞骨架崩解、细胞轴浆流动停止是β-APP在轴突积聚的一个重要原因,故而较多学者认为β-APP是轴突损伤和断裂很好的标志物[10-11]。纳洛酮作为阿片受体拮抗剂,可通过拮抗阿片受体而减轻β-APP所产生的病理效应,保护脑组织[12]。但目前有关纳洛酮治疗DAI,对患者血清中β-APP的蛋白表达研究却较为少见。为此,本研究纳入了受伤后至入院时间小于6h的DAI患者,以期检测早期大剂量纳洛酮对DAI患者β-APP的影响作用。
本研究采用0.1、0.4mg·kg-1·d-1两种剂量的纳洛酮对患者进行了治疗,并应用 Western blot检测了对照组、小剂量及大剂量治疗组患者血清中β-APP的蛋白表达情况。结果显示,治疗后3d大剂量治疗组患者血清中β-APP的蛋白表达较其他两组明显降低。DAI后3~5d往往是脑水肿和继发性神经损害的高峰期,此时的β-APP含量能更准确地反映患者的病情程度。本研究结果表明,纳洛酮大剂量治疗能更显著的降低DAI患者脑水肿高峰期的β-APP含量,从而更有效地控制颅内压,减轻脑水肿,改善脑代谢。作者还发现,治疗后7d大剂量治疗组患者的GCS评分明显高于其他两组。说明纳洛酮能明显改善DAI患者的临床症状和预后。纳洛酮治疗颅脑损伤的机制,国内外多有相关研究,现就本院的实验结果总结如下:(1)可竞争性阻断内源性阿片受体与中枢和外周神经的结合,抑制软膜血管收缩,增加脑血流和脑灌注压。缓解脑血管痉挛,改善脑组织的微循环和组织供氧,减少继发性损害[13]。(2)抑制氧自由基的产生和抗脂质过氧化作用,稳定细胞膜及溶酶体,减少溶酶释放。(3)内皮素是目前所知最强烈的血管收缩因子。颅脑损伤后,内皮素水平明显升高且与临床症状加重相符,从而引起一系列反应,损害神经细胞[14]。而纳洛酮的应用可降低内皮素水平,提高降钙素基因相关肽水平,保护神经元[15]。(4)解除内源性阿片肽物质对呼吸、心血管的抑制作用,抑制外周血管平滑肌收缩,提高心肌输出量,调节血压,改善循环,增加脑干血氧供应,保护生命中枢。提示纳洛酮治疗脑外伤有一定的时间窗限制,越早用药,其防止神经细胞凋亡的效果越好。
综上所述,早期大剂量应用纳洛酮治疗弥漫性轴索损伤,可促进患者神经功能恢复及改善预后,同时无明显药物不良反应发生,具有较好的安全性,值得临床推广应用。但由于本研究样本量较小,有关其更可靠的疗效及禁忌证尚有待今后更大样本量的研究加以探讨。
[1] 段志新,王洪财,吴芳芳,等.大鼠弥漫性轴索损伤后β-淀粉样前体蛋白表达的动态变化[J].神经损伤与功能重建,2009,4(6):391-393.
[2] Blumberg PC,Scott G,Manavis J,et al.Staining of amyloid precursor protein to study axonal damage in mild head injury[J].Lancet,1994,344(8929):1055-1060.
[3] 刘洪恩,孙晓川.β淀粉样前体蛋白与弥漫性轴索损伤[J].创伤外科杂志,2005,7(1):73-75.
[4] Dan W,Tang WY,Liu FY,et al.The flucluation of absolute power values of electroencephalogram for evaluation the efficacy of different dose of naloxone in brain injury[J].Chin J Clin Rehabilitat,2005,9(13):192-195.
[5] 庄仲伟,费智敏,王勇,等.闹弥漫性轴索损伤的诊断与治疗[J].中国临床神经外科杂志,2008,13(5):296-297.
[6] 江基尧.弥漫性轴突损伤的概念和病理机制[J].中华神经外科杂志,2006,22(11):645-647.
[7] 江基尧,朱诚.现代颅脑损伤学[M].上海:第二军医大学出版社,1999:197-222.
[8] 金冬雁,黎孟枫.分子克隆实验指南[M].2版.北京:科学出版社,1999:881-885.
[9] Sherriff FE,Bridges LR,Sivaloganathan S.Early detection of axonal injury after human head trauma using immunocytochemistry for betar amyloid precursor protein[J].Acta Neuropathol(Berl),1994,87(1):55-60.
[10]潘隆盛,许百男,周定标,等.大鼠弥漫性轴突损伤早期淀粉样前体蛋白(β-APP)表达的实验研究[J].解放军医学杂志,2006,31(9):899-900.
[11]蔡韬,廖达光.弥漫性轴索损伤的临床诊治分析[J].中国现代医生,2008,46(13):49-51.
[12]罗良生,李英斌,张健,等.弥漫性轴索损伤的影像与临床分析[J].临床神经外科杂志,2008,5(3):131-132.
[13]李建初,袁光华,柳之仪,等.血管和浅表器官彩色多普勒超声诊断学[M].北京:北京医科大学、中国协和医科大学联合出版社,1999:82.
[14]关国梁,黄志雄,林启明,等.拉罗通对颅脑外伤患者神经功能的保护作用[J].中华实验外科杂志,2003,20(4):470-471.
[15]罗晓阳,章翔,王嘉军,等.纳洛酮对脑挫裂伤大鼠血浆及海马中内皮素、肿瘤坏死因子和降钙素基因相关肽含量的影响[J].中国急救医学,1997,9(2):1650-1652.
