猪源鼠伤寒沙门菌的分离鉴定与耐药性分析
2012-09-26张文波李宏睿邓舜洲
张文波,李宏睿,冷 闯,邓舜洲*
(1.江西农业大学动物科学技术学院,江西南昌330045;2.江西农业大学食品科学与工程学院,江西南昌330045)
沙门菌是肠杆菌科中一类分布广泛、血清型众多的革兰阴性杆菌。其中有少数为致病菌,可引起多种动物的胃肠炎(即食物中毒)、伤寒、败血症及肠道外局灶性感染,又以胃肠炎型最为常见。猪是其重要的储存宿主。
仔猪副伤寒(Swine paratyphoid)是由猪霍乱沙门菌、猪伤寒沙门菌、鼠伤寒沙门菌等沙门菌属细菌引起的一种严重危害仔猪生产的传染病[1]。主要引起猪的败血症、肠炎、肺炎和肝炎,也可使怀孕母猪发生流产。随着养猪业的集约化和规模化发展,该病对猪场正常生产的不利影响越来越大。近年,由于猪场抗生素的滥用和不当使用,沙门菌的耐药性日趋严重,多重耐药现象已成为该菌的主要特征之一[2],对其防控的难度不断加大。因而从临床病例中分离鉴定沙门菌,进行药敏试验筛选敏感药物,对防控该病有着重要的实践意义。
2011年10月份开始,江西南昌2个规模化猪场的40日龄左右仔猪出现消瘦、腹泻、食欲不振等临床症状,采取注射猪瘟疫苗、庆大霉素等治疗措施无效。本试验采用常规方法从该场病死仔猪的组织脏器中分离病原菌,并进行生化鉴定、动物试验和药敏试验,为防控该病提供试验依据。
1 材料与方法
1.1 材料
1.1.1 病料来源 江西南昌2个规模化猪场送检的病死仔猪。
1.1.2 微量生化鉴定管和药敏试纸 均为杭州天和微生物试剂有限公司产品。
1.1.3 实验动物 6周龄昆明鼠,购自南昌大学实验动物部。
1.2 方法
1.2.1 病料采集 解剖病死仔猪,无菌采集肝脏和肠道,进行细菌分离。
1.2.2 细菌分离 无菌条件下分别将病料划线接种于兔血琼脂培养基,37℃烛缸培养12 h~24 h,观察细菌生长及菌落特征。
1.2.3 细菌的纯培养 无菌挑取兔血琼脂培养培养基上的单个菌落,革兰染色并划线接种于新的兔血琼脂培养培养基,37℃培养过夜,革兰染色,镜检;将纯培养的菌落分别划线接种于普通琼脂培养基、麦康凯培养基和伊红美蓝琼脂培养基,37℃培养过夜,观察细菌生长及菌落。
1.2.4 生化鉴定 从纯培养物中挑取单菌落接种于普通肉汤中,220 r/min振荡培养12 h,革兰染色,镜检。按文献[3]方法进行生化鉴定。
1.2.5 药敏试验 用灭菌棉签将培养菌均匀涂在普通琼脂培养基上,将药敏试纸均匀贴于培养基表面,37℃培养24 h,测量抑菌圈直径。
1.2.6 动物试验 参照文献[4]方法进行。取分离菌的肉汤培养物(浓度为1.5×108cfu/mL),分别以0.25 mL和0.5 mL的量通过腹腔注射接种小鼠,观察其发病的死亡情况,同时腹腔注射普通肉汤培养液作对照。并对死亡鼠进行剖检和细菌分离鉴定。
2 结果
2.1 病理剖检
送检的病死仔猪外观消瘦、被毛粗乱、皮肤出现斑疹或紫色斑点、身体末端发绀;剖检可见盲肠、结肠肠壁增厚,结肠黏膜覆盖糠麸样假膜,揭开假膜可见出血点(斑);肝肿大,表面有黄白色坏死点;心肌出血,淋巴结切面有出血点(图1~图5)。
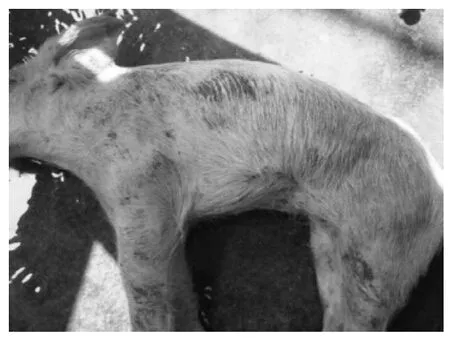
图1 仔猪消瘦 、皮肤发红Fig.1 Piglet emaciation,skin redness

图2 结肠肠壁增厚Fig.2 Colon wall thickening
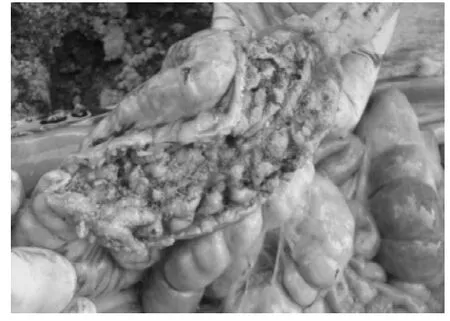
图3 结肠黏膜覆盖糠麸样物Fig.3 The bran-like material covering colonic mucosa
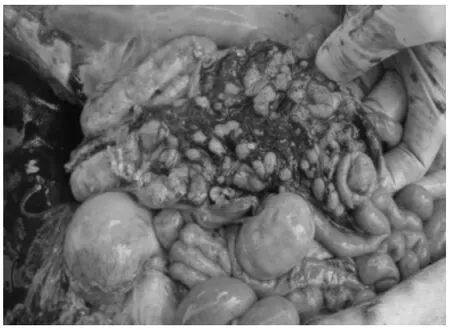
图4 盲肠黏膜覆盖糠麸样物Fig.4 The bran-like material covering cecal mucosa
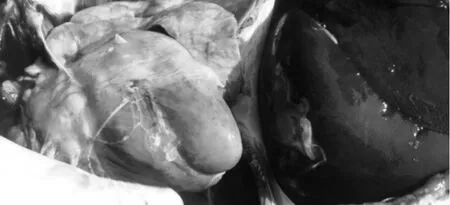
图5 心肌出血;肝脏肿大,表面有黄灰色坏死点Fig.5 Myocaridial hemorrhage;Enlargement and surface yellow-gray necrotic points of the liver
2.2 细菌分离培养特性
在血琼脂培养基生长良好,呈现圆形、半透明、灰白色、微隆起、湿润、边缘整齐、针尖大的露滴样菌落;在麦康凯培养基上,菌落均为圆形、光滑、边缘整齐、无色半透明;在伊红美蓝培养基上,菌落为无色的小菌落。取纯培养进行革兰染色,镜检,可见无荚膜、无芽胞、散在的革兰阴性短杆菌。与沙门菌的特征基本一致。
2.3 分离菌株生化鉴定结果
分离的6株菌均能发酵葡萄糖、麦芽糖、甘露醇和阿拉伯糖产酸产气,赖氨酸脱羧酶、精氨酸脱羧酶、MR和硫化氢反应阳性,乳糖、蔗糖、VP和硝酸盐反应阴性,运动力检查阳性,与鼠伤寒沙门菌的生化特性一致。
2.4 药敏试验结果
分离菌对阿米卡星、卡那霉素、头孢噻肟极敏感,对环丙沙星、诺氟沙星高敏,对大观霉素、恩诺沙星、利福平、四环素、头孢氨苄为低敏,对阿莫西林、青霉素G、复方新诺明、林可霉素为耐药(表1)。
2.5 动物致病性试验结果
注射0.5 mL菌液的小鼠均在15 h内死亡,注射0.25 mL菌液的小鼠均在48 h内死亡。剖检肺脏充血,肝脏肿大、出血,腹腔中有腹水,脾脏肿大,肠黏膜出血,肠系膜水肿。从死亡鼠的肝、心、肺中分离到与接种细菌生物学特性一致的细菌。对照组小鼠无任何异常表现,7 d后处死剖检,内脏无病变。表明分离菌有较强的致病性。
3 讨论
沙门菌在自然界中的分布十分广泛,也是一种重要的条件致病菌[5],对畜禽健康养殖、人类公共安全、食品安全都具有着重要的影响。尤其是近年来我国养殖业的快速发展,沙门菌的危害越来越严重。
根据送检猪场的流行病学、临床症状和病死猪的剖检变化等,初步怀疑是仔猪副伤寒。无菌采集病料进行细菌分离鉴定,结果分离的6株菌在普通琼脂培养、血琼脂培养基、麦康凯培养基和伊红美蓝培养基上的生长和菌落特征均与鼠伤寒沙门菌的一致。

表1 分离菌的药敏试验结果Table1 The results of drug sensitivity test of isolate strains mm
沙门菌常存在猪体内尤其是肠道内,且肠道内存在多种类似菌群,因此从肠道和粪便中分离到沙门菌并不能证实是致病菌。只有证明分离的沙门菌有强致病性,才能确诊是沙门菌病[7]。本次试验中,选择大小2种剂量的分离菌肉汤培养物,接种小鼠。结果2倍剂量组的小鼠在接种后15 h内全部死亡,单倍剂量组的小鼠在接种后48 h内全部死亡,且可从死亡鼠中分离到与原分离菌生物学特性一致的细菌,表明分离的鼠沙门菌有强致病性,是引起猪场发病的病原菌。
张玮等[8]采用直肠棉拭子从健康猪肠道内分离到22株沙门菌,药敏试验结果表明,分离菌的耐药性非常强,仅对部分第3代头孢类敏感,其中耐4种以上抗生素的多重耐药菌株达90.9%。张琦等[9]对分离的猪源鼠伤寒沙门菌进行药敏试验结果表明,分离菌仅对先锋噻肟、菌必治、呋喃妥因、头孢呋肟等药物有效,而对其他临床常用的12种抗菌药物均耐药。Varga C等[10]检测并比较了加拿大阿尔伯塔省922株猪源大肠埃希菌和922株猪源沙门菌对15种抗菌药物的耐药性,结果没有l种菌耐第3代头孢菌素和喹诺酮类药物,70.2%的大肠埃希菌和28%的沙门菌耐2至多种抗菌药物。其他的研究报道与国内的大致相同[11-12]。这些研究结果说明,目前规模化猪场沙门菌的耐药性正在不断发生变化,且耐药性逐渐增强。虽然抗生素在沙门菌的防控中发挥着重要的作用,但随着养殖业中抗生素的滥用和不规范使用,细菌在药物的选择性压力下,不断发生变异,以适应药物环境,其中以多重耐药和耐药谱不断扩大最为常见[13],且已成为目前沙门菌的主要特征之一。因此,分离鉴定沙门菌,了解其耐药性及筛选药物仍是防控沙门菌的重要方式。
本次分离菌的药敏试验结果表明,分离菌株的耐药性较强,且呈多重耐药性。结果与文献[14-15]报道的基本一致。但2个场的药敏试验结果不太一致,经询问养殖人员得知,2猪场相邻,且关系密切,平时的预防用药和疫苗免疫程序几乎相同,但2个场的发病早,用药较多,导致对一些药物的敏感度降低。根据药敏试验结果,选择卡那霉素肌注3 d,水中添加头孢噻肟钠和多维,连用7 d,同时加强消毒、饲养管理、减少应激等综合措施,除前4 d有猪死亡外,以后逐渐平稳,然后再用乳酸诺氟沙星可溶性粉饮水5 d,猪群恢复正常。
随着抗生素的大量使用,沙门菌的耐药性不断增强;且沙门菌的血清型多达2 500多种[16],使用疫苗防控的难度较大;近年,随着规模化、集约化的发展,以及疾病的演变,大部分猪群处于亚健康状态,在应激、免疫抑制等不利因素作用下,很容易发生沙门菌的继发、并发感染。因此,猪场在防控沙门菌病时,应在加强饲养管理、定期消毒、通过药敏试验筛选敏感药物或其组合进行药物预防等综合措施,才能取得较好的效果。
[1]Barbara E.Diseases of swine (9th Edition)[M].Ames(IA):Iowa State University Press,2006:841-860.
[2]Antunes P,Mouräo J,Pestana N,et al.Leakage of emerging clinically relevant multidrug resistant Salmonella clones from pig farms[J].J Antimicrob Chemother,2011,66(9):2028-2032.
[3]Roy Cullimore D.Practical Atlas for Bacterial Identification(Second Edition)[M].USA:CRC Press,2010:197-233.
[4]黄福标,卢冰霞,刘 磊,等.屠宰猪肠道沙门氏菌的分离鉴定、耐药性分析及致病性试验[J].中国畜牧兽医,2012,39(1):172-177.
[5]潘 荞,邓治邦.仔猪副伤寒沙门菌致病性及耐药机制研究进展[J].动物医学进展,2009,30(2):93-97.
[6]王俊红.山东省猪源致病性沙门氏菌的分离鉴定与耐药性分析[D].山东泰安:山东农业大学,2008.
[7]马孟根,王红宁,余 勇,等.猪源致病性沙门氏菌耐药基因的分析[J].畜牧兽医学报,2006,37(1):65-70.
[8]张 玮,魏建忠,詹松鹤,等.规模猪场健康猪沙门氏菌带菌情况调查[J].中国人兽共患病学报,2010,26(8):888-890.
[9]张 琦,付明哲,陈晓霖.猪鼠伤寒沙门氏菌的分离与鉴定[J].中国畜牧兽医文摘,2011,27(4):34-35.
[10]Varga C,Rajie A,Me Fall M E,et al.Comparison of antimicrobial resistance in generic Escherichia coli and Salmonella spp.cultured from identical fecal samples in finishing swine[J].Can J Vet Res,2008,72(2):181-187.
[11]Lee K E,Jung J H,Jung B Y,et al.Characterization of nalidixic acid-resistant and fluoroquinolone-reduced susceptible Salmonella Typhimuriumin swine[J].J Food Prot,2011,74(4):610-615.
[12]Gómez-Laguna J,Hernández M,Creus E,et al.Prevalence and antimicrobial susceptibility of Salmonella infections in free-range pigs[J].Vet J,2011,190(1):176-178.
[13]Caleja C,de Toro M.Antimicrobial resistance and class I integrons in Salmonella enterica isolates from wild boars and Bísaro pigs[J].Int Microbiol,2011,14(1):19-24.
[14]周宗清,邹 勇,敖仁华.八株猪霍乱沙门氏菌的分离鉴定及豚鼠免疫模型的建立[J].猪业科学,2008(12):67-70.
[15]刘俊伟,张海棠,张志鹏,等.规模化猪场猪霍乱沙门氏菌的分离鉴定与药敏试验[J].河南农业科学,2011,40(4):146-148.
[16]Haley C A,Dargatz D A,Bush E J,et al.Salmonella prevalence and antimicrobial susceptibility from the National Animal Health Monitoring System Swine 2000 and 2006 studies[J].J Food Prot,2012,75(3):428-436.
