山羊痘病毒AV41株在3种原代细胞上的培养特性比较
2012-09-26孙翠平王文秀苗立中沈志强
唐 娜,孙翠平,王文秀,张 倩,苗立中,管 宇,沈志强*
(1.山东省滨州畜牧兽医研究院兽医生物技术重点实验室,山东滨州256600;2.山东绿都生物科技有限公司,山东滨州256600)
山羊痘(Goatpox)、绵羊痘 (Sheeppox)和牛结节性皮肤病(Lumpy skin disease)是分别由羊痘病毒属(Capripoxvirus)的3种病毒引起的山羊、绵羊和牛的痘病,自20世纪50年代开始流行,期间虽然得到一定的控制,但仍然持续流行于非洲、中东和亚洲的多个国家和地区[1-2],近几年,随着全球气候变化以及动物、动物产品贸易方式的改变,这3种痘病的流行更加猖獗,是危害经济动物最严重的痘病[3]。研究表明,感染山羊和绵羊的病毒株具有一定的宿主特异性,山羊痘病毒往往引起山羊发病,绵羊痘病毒也只感染绵羊,但这种情况并不绝对,有些毒株对山羊和绵羊均可致病[4]。与其他痘病毒相似,动物抵抗过这3种羊痘病毒感染后可以获得长期的、高水平的抗感染免疫,而且,目前所有报道的羊痘病毒株均具有抗原同源性,动物感染过其中一株病毒后,即可对其他所有毒株产生免疫应答,因此人们可以采用一株毒株研制疫苗,用于预防3种羊痘病毒病[5]。
目前,国内外应用最广泛的羊痘病毒疫苗仍然以减毒活疫苗、灭活苗为主[6]。我国研发的山羊痘细胞弱毒AV41株作为一种细胞弱毒,具有较好的免疫原性,被广泛应用于山羊痘与绵羊痘的预防[7]。研究表明,山羊痘病毒在羔羊睾丸细胞上增殖效果最好,其此是羔羊肾细胞,在犊牛睾丸细胞、犊牛肾细胞等细胞中的增殖效果不明显,可能与各细胞系对病毒敏感性有关[8]。目前,国内进行山羊痘细胞弱毒AV41株生产的常用细胞是绵羊睾丸细胞,通常采用4月龄以内雄性绵羊制备而成[9],由于制备细胞需要新鲜组织、组织中细胞数量少、羔羊成本较高,以及动物福利等多方面因素,山羊痘疫苗的产量受到很大限制。为扩大生产用细胞范围,降低成本,本实验室分别制备绵羊睾丸细胞、绵羊肾细胞、犊牛睾丸细胞,对山羊痘病毒AV41株在3种细胞上的生长特性进行比较研究。
1 材料与方法
1.1 材料
1.1.1 毒株 山羊痘细胞弱毒AV41株购自中国兽医药品监察所,由山东绿都生物科技有限公司保存。
1.1.2 试验用动物 雄性绵羊,1月龄~4月龄健康雄性绵羊,经检测未感染山羊痘病毒和牛病毒性腹泻病毒。雄性犊牛,出生3日以内、未吃初乳的健康雄性犊牛,经检测未感染牛病毒性腹泻病毒。安检山羊,来源于山东滨州地区非疫区和非免疫群的12月龄~24月龄健康山羊。
1.2 方法
1.2.1 原代细胞制备 30日龄~60日龄健康绵羊3只,无菌采取睾丸组织和肾脏,按照常规方法去除脂肪和包膜,剪碎,洗涤,消化和分散细胞,制备成原代绵羊睾丸细胞和绵羊肾细胞,用DMEM培养基和100 mL/L犊牛血清作生长液,细胞计数后按照每瓶5×106个细胞的量分装到T75细胞培养瓶中,37℃培养,观察其生长情况。无菌采取3只健康新生犊牛睾丸组织,同上方法制备犊牛睾丸细胞。
1.2.2 细胞最大传代次数比较 以上3种原代细胞长满单层后,分别按照常规方法进行消化、传代,连续传代10代~20代,观察各代次细胞生长情况。
1.2.3 山羊痘病毒接种培养观察 选择生长良好的绵羊睾丸细胞、绵羊肾细胞、犊牛睾丸细胞单层,分别按照细胞培养液的1%接种山羊痘病毒毒种,吸附1 h后弃去毒液,加入细胞维持液,37℃培养观察。待细胞病变75%以上时,收获病毒液,冻融后再次分别接种对应细胞,连续传代5代。记录细胞病变时间、病变形态等生长特性,收集各代次培养物进行病毒TCID50测定。
1.2.4 TCID50测定 制备铺有适宜密度的原代绵羊睾丸细胞的96孔细胞培养板,同时将不同细胞培养的山羊痘病毒按照1∶10-1,1∶10-2,……,1∶10-7的梯度做倍比稀释,分别等体积接种到各细胞板中,培养观察5 d,记录细胞病变情况。按照Reed-muench公式计算病毒TCID50浓度。
1.2.5 特异性检验 根据GenBank上已发表的山羊痘P32基因序列(登录号:HM572329)参考Chu Y等[10]设计引物,送上海生工生物工程技术服务有限公司合成。采用SDS-蛋白酶K法分别抽提第5代病毒细胞培养物的DNA。PCR反应体系:10×Taq Reaction buffer(含 MgCl2)2.5 μL,d NTP(10 mmol/L)2 μL,上游、下游引物 Pl、P2(10 pmol/μL)各1μL,DNA模板2μL,Taq DNA聚合酶(2.5 U/μL)0.5μL,灭菌双蒸水16μL;反应条件:95℃5 min;94℃40 s,55℃40 s,72℃40 s,33个循环;72℃10 min。PCR产物于12 g/L琼脂糖凝胶电泳并观察。
1.2.6 安全性检验 参考文献[9]进行安全性检验,选取1岁~2岁健康山羊9只,分成3组,每组3只,分别胸腹部皮内注射由绵羊睾丸细胞、绵羊肾细胞、牛睾丸继代细胞生产的山羊痘病毒(稀释成每1.0 mL含4×103.5TCID50),每只2点,每点0.5 mL,观察15日,记录局部痘肿反应情况,以及体温、精神、食欲等是否出现异常状态。
2 结果
2.1 3种原代细胞的制备与生长特性
分别无菌采取绵羊羔睾丸、绵羊羔肾脏、犊牛睾丸组织,制备成原代绵羊睾丸细胞、绵羊肾细胞、犊牛睾丸细胞,通过细胞计数计算每份组织3种细胞的平均细胞数量分别为1.10×108±0.55×108、2.5×109±0.19×109、4.9×108±0.40×108个。原代绵羊睾丸细胞在4 d~5 d能够长成单层,随着传代次数增加,细胞体积逐渐变大,细胞分裂能力下降,生长速度减缓。传代至第6代~7代后,绵羊睾丸细胞已经无法在7 d内长满单层。犊牛睾丸细胞生长形态与绵羊睾丸细胞相似,绵羊羔肾细胞生长速度较快,并且可以连续传代10代~15代。
2.2 山羊痘病毒AV41株在3种细胞上的生长特性比较
山羊痘病毒AV41株在3种细胞上均能造成细胞病变,但在病变时间、病变形态等特征上差异明显。山羊痘病毒在接种绵羊睾丸细胞后3 d~4 d出现病变,病变细胞发生圆缩,聚集,最后成团脱落至培养液中[11](图1A)。接种绵羊肾细胞后平均4 d发生病变,细胞先变细变长,细胞间隙增大,然后细胞开始发生圆缩,聚集,最后脱落,病变持续时间较长(图1C)。接种犊牛睾丸细胞后病变产生较慢,平均5.5 d发生病变,细胞病变形态与绵羊睾丸细胞相似,病变持续时间稍长(图1E)。AV41株在3种细胞上连续传代5代,分别接种铺有绵羊睾丸细胞96孔培养板进行TCID50测定,各代次的TCID50结果均较为稳定,分别平均为10-6.125、10-5.5、10-5.875/mL。
2.3 GPV特异性鉴定
采用PCR方法鉴定各细胞传代5代后的细胞培养液,电泳结果见图2。各细胞样品在495 bp左右均出现了GPV特异性条带,阴性对照样品未出现条带。
2.4 安全性检验结果
接种后3 d,各组山羊相继出现痘肿反应,5 d~6 d时达到最大(直径1.5 cm~3.5 cm),呈微红色或无色,此后开始逐渐消退,整个观察期间,各组山羊精神良好,食欲正常,体温无明显波动。
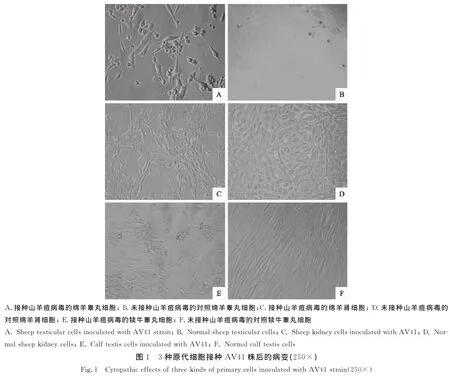
3 讨论
绵羊羔睾丸细胞是我国兽药典规定的山羊痘活疫苗生产用细胞。但是在实际生产中,羔羊睾丸供应量小、采集较为困难,所需羔羊月龄小、组织细胞量小,操作程序复杂、操作时间长,以及其他方面因素,往往给疫苗生产带来细胞得率不高、批间差异大、容易发生污染等问题,生产成本高、风险大、产量不确定。
本文通过试验比较分析了3种原代细胞的培养及山羊痘病毒AV41株的增殖效果,从结果可见,AV41株在绵羊羔睾丸细胞的生长效果最好,但是1月龄~4月龄的绵羊羔生长速度不一,个体差异较大,其睾丸组织含细胞量差异较大,有的细胞量甚至仅接近1只9日龄健康鸡胚。而羔羊肾脏体积较大,细胞含量较多(试验中为睾丸组织的10倍以上),因此,尽管AV41株在羔羊肾细胞上的效价是在绵羊羔睾丸细胞上的1/4,羔羊肾细胞作为山羊痘病毒疫苗生产细胞仍然具有一定的优势[12]。如果进一步培养驯化适宜羔羊肾细胞的克隆疫苗株,将有效地改善目前的疫苗生产现状。AV41株在犊牛睾丸细胞上的增殖效价居于羔羊睾丸细胞和肾细胞之间,考虑到使用异源动物细胞制备疫苗可以一定程度上防止种毒返强,并有效避免使用同源动物造成其他疾病的传播,在具备健康雄性犊牛资源的地区,可以尝试采用犊牛睾丸细胞进行疫苗生产。
但是,考虑到弱毒疫苗存在毒力返强的风险,生产操作中涉及布氏杆菌病等生物安全问题、以及动物福利等因素,未来人们仍需要努力寻找可以替代原代细胞的疫苗生产用细胞[13],加快山羊痘灭活疫苗的研制与应用步伐。
本试验3种原代细胞制备的山羊痘疫苗免疫效力是否有差异尚待今后进一步试验。
[1]Beard P M,Sugar S,Bazarragchaa E,et al.A description of two outbreaks of capripoxvirus disease in Mongolia[J].Vet Microbiol,2010,142(3-4):427-431.
[2]Bhanuprakash V,Moorthy A R,Krishnappa G,et al.An epidemiological study of sheep pox infection in Karnataka State,India[J].Rev Sci Tech,2005,24(3):909-920.
[3]Babiuk S,Bowden T R,Boyle D B,et al.Capripoxviruses:an emerging worldwide threat to sheep,goats and cattle[J].Transbound Emerg Dis,2008,55(7):263-272.
[4]Yan X M,Chu Y F,Wu G H,et al.An outbreak of sheep pox associated with goat poxvirus in Gansu province of China[J].Vet Microbiol,2012,156(3-4):425-428.
[5]Kitching R P.Historical perspective:the pathogenesis of sheep pox infection (1959-2012)and the contribution of Walter Plowright[J].J Comp Pathol,2012,146(2-3):95-96.
[6]Bhanuprakash V,Hosamani M,Singh R K.Prospects of control and eradication of capripox from the Indian subcontinent:a perspective[J].Antiviral Res,2011,91(3):225-232.
[7]王绍华,江焕贤.山羊痘弱毒疫苗的研究[J].中国农业科学,1985,15(6):77-82,98.
[8]Davies F G.Characteristics of a virus causing a pox disease in sheep and goats in Kenya,with observation on the epidemiology and control[J].J Hyg Camb,1976,76:163-171.
[9]中国兽药典委员会.中华人民共和国兽药典三部(2010年版)[M],北京:中国农业出版社,2010:61-62.
[10]Chu Y,Yan X,Gao P,et al.Molecular detection of a mixed infection of Goatpox virus,Orf virus,and Mycoplasma capricolum subsp.capripneumoniae in goats[J].J Vet Diagn Invest,2011,23(4):786-789.
[11]李有文,魏 风,郭志儒,等.山羊痘病毒培养及其细胞病变观察研究[J].安徽农业科学,2009,37(3):1102-1104.
[12]Katiyar M C,Soman J P,郑 征.山羊痘病毒在山羊肾细胞培养中适应性的研究[J].动物医学进展,1988,9(3):32-35.
[13]Hosamani M,Nandi S,Mondal B,et al.A Vero cell-attenuated Goatpox virus provides protection against virulent virus challenge[J].Acta Virol,2004,48(1):15-21.
