地黄低聚糖对人脂肪组织来源干细胞旁分泌作用的影响
2012-09-13裴志勇赵玉生高伟尹巧香
裴志勇,赵玉生,高伟,尹巧香
(1.北京军区总医院干部病房一科,北京100700;2.解放军总医院老年心血管病研究所;3.空军总医院干部病房心内科)
·基础研究·
地黄低聚糖对人脂肪组织来源干细胞旁分泌作用的影响
裴志勇1,赵玉生2,高伟2,尹巧香3
(1.北京军区总医院干部病房一科,北京100700;2.解放军总医院老年心血管病研究所;3.空军总医院干部病房心内科)
目的 探讨地黄低聚糖(RGOs)对分离、培养的人脂肪组织来源干细胞(hASCs)旁分泌作用的影响。方法 酶消化法及贴壁法从人腹部脂肪组织中分离、培养hASCs。流式细胞仪检测hASCs表面抗原CD29、CD31、CD44、CD45、CD90、CD105、HLA-DR的表达。hASCs经RGOs(0.1 g/L)预处理12 h并继续干预,ELISA法观察不同时间点hASCs培养上清液中血管内皮生长因子(VEGF),肝细胞生长因子(HGF),胰岛素样生长因子-1(IGF-1),碱性成纤维细胞生长因子(bFGF),基质细胞衍生因子-lα(SDF-lα)浓度的变化。结果
hASCs表面抗原CD29、CD44、CD90、CD105表达呈阳性,CD31、CD45、HLA-DR表达呈阴性。与对照组相比,RGOs可以促进体外培养的hASCs分泌VEGF、HGF、IGF-1、SDF-1α(P<0.05),而对于bFGF的分泌无明显影响。结论 RGOs可以增强体外培养的hASCs的旁分泌作用。
地黄;间质干细胞;脂肪组织;胞间信号肽类和蛋白质类
近年来,随着人们对间充质干细胞的深入研究,发现其旁分泌功能在组织修复过程中发挥了重要作用[1]。学者们已尝试运用基因修饰、体外预处理等策略来加强间充质干细胞的旁分泌作用,修复损伤组织,并且取得了一定效果[2-3]。脂肪组织来源干细胞(ASCs)具有间充质干细胞类似的生物学特性,可以分泌多种生物活性因子。地黄低聚糖(RGOs)是地黄的主要成分之一,具有补血、降血糖、抗肿瘤、增强免疫等药理活性,而关于RGOs对ASCs旁分泌作用影响的研究鲜有报道。本研究旨在观察RGOS对人ASCs(hASCs)旁分泌作用的影响。
1 材料与方法
1.1 材料 L-DMED培养基、特级胎牛血清(FBS)、Ⅳ型胶原酶、胰蛋白酶均购自Gibco公司,DispaseⅡ中性蛋白酶购自 Sigma公司,小鼠抗CD31、CD90单克隆抗体均购自BD PharmingenTM公司,小鼠抗CD29、CD45、CD105、HLA-DR单克隆抗体、大鼠抗CD44单克隆抗体均购自Abcam公司,人血管内皮生长因子(VEGF),肝细胞生长因子(HGF),胰岛素样生长因子-1(IGF-1),碱性成纤维细胞生长因子(bFGF),基质细胞衍生因子-lα(SDF-lα)ELISA试剂盒均购自武汉博士德生物工程有限公司,人bFGF ELISA试剂盒购自深圳欣博盛生物科技有限公司。RGOs以生地黄为原料加工后经军事医学科学院毒物药物研究所提纯,高效液相色谱法检测RGOs提纯物中水苏糖含量为31.15%。主要设备有:二氧化碳孵箱(美国Thermo scientific公司),倒置相差显微镜(日本Olympus BX51),普通光学显微镜(德国Leica DM IL),流式细胞仪(美国BD FACS Calibur),酶标仪(上海Multiscan MK3)。
1.2 方法
1.2.1 hASCs的分离及培养 实验所用的脂肪组织来源于整形外科腹部吸脂术后废弃的脂肪组织液,加入适量消化液(L-DMEM+0.1%Ⅳ型胶原酶+0.1%DispaseⅡ中性蛋白酶+0.1%胰蛋白酶),置于37℃孵箱振荡消化40~60 min;加入等量含10%FBS的L-DMEM培养基终止消化,100目、200目筛网过滤,600 g离心6 min;弃上清,加入含10% FBS的L-DMEM培养基重悬细胞,移入培养皿,置于37℃、5%CO2孵箱中培养。24 h后首次换液,去除悬浮细胞,随后每2~3天换液1次。1周左右细胞融合80%~90%,加入0.25%胰蛋白酶+0.04% EDTA溶液消化、传代。
1.2.2 hASCs的分子表型鉴定 取第4代细胞,0.25%胰蛋白酶+0.04%EDTA溶液消化后PBS重悬细胞并计数,细胞密度调至1×106/ml;取8只EP管,分别加入0.5 ml细胞悬液,1000转/min,离心5 min,PBS清洗2遍;0.5 ml PBS再次重悬细胞,加入以下抗体:CD29-FITC、CD31-PE、CD44-FITC、CD45(一抗)、CD90-FITC、CD105-FITC、HLA-DRFITC,对照加入20 μl PBS,混匀后4℃冰箱静置30 min;1900 r/min,,离心8 min,弃上清;CD45 EP管中的细胞再次用0.5 ml PBS重悬,加入二抗(FITC),混匀后4℃冰箱静置30 min,1900 r/min,离心8 min,弃上清;各管均加入2%多聚甲醛0.5 ml,4℃固定30 min。流式细胞仪进行阳性细胞计数,每次分析获取2×104个细胞,Cell Quest软件进行数据分析。实验重复3次。
1.2.3 实验分组及hASCs培养上清液的留取 取第4代hASCs,以3×105细胞/皿的密度接种于6个50 cm2培养皿中,随机分为两组:对照组(n=3)、RGOs组(n=3)。待细胞融合70%~80%时,RGOs组培养基中加入RGOs溶液,终浓度为0.1 g/L。12 h后两组同时更换培养基,其中对照组更换为无血清L-DMEM培养基,RGOs组更换为含RGOs (0.1 g/L)的无血清L-DMEM培养基。分别于换液后1 h、3 h、6 h、12 h、24 h、48 h时间点吸取细胞上清液,离心后分装,-70℃保存。每次取上清液后补充同种培养基,保持各皿细胞培养基终体积相同。48 h时间点取上清液后消化各皿细胞并计数。
1.2.4 ELISA法测定hASCs培养上清液中生长因子浓度 按试剂盒说明书操作步骤测定hASCs培养上清液中各生长因子的浓度。标准品及样品均采用双份检测,酶标仪测定各孔波长450 nm吸光度(OD450)。将TMB(四甲基联苯胺)空白显色孔设为对照,所有标准品及样品的OD值减去TMB空白显色孔的OD值,应用Curve Expert 1.3软件绘制各生长因子标准品曲线,根据标准曲线计算各样品浓度。
2 结果
2.1 hASCs表面抗原表达 第4代hASCs表面抗原表达率如下:CD29(98.87±0.31)%,CD44 (99.78±0.16)%,CD90(98.04±0.19)%,CD105 (99.31±0.48)%,CD31(1.15±0.14)%,CD45 (1.25±0.05)%,HLA-DR(0.98±0.07)%。提示第4代hASCs表面抗原CD29、CD44、CD90、CD105的表达呈阳性,而CD31、CD45、HLA-DR的表达呈阴性(图1)。
2.2 RGOs对hASCs生长因子分泌的影响
2.2.1 VEGF、IGF-1 与对照组比较,RGOs组VEGF、IGF-1浓度从3 h开始明显升高(P<0.05,P<0.01);6 h、12 h、24 h、48 h各时间点以及48 h细胞数(1×106)校正(48 hr)的VEGF、IGF-1浓度均明显高于对照组(均P<0.01),见表1,2。
2.2.2 HGF、SDF-1α 与对照组比较,RGOs组HGF及 SDF-1α浓度从6 h开始明显升高(P<0.05,P<0.01),12h、24h、48h各时间点以及48hr的HGF及SDF-1α浓度均明显高于对照组(均P<0.01),见表3,4。
2.2.3 bFGF RGOs组各时间点bFGF浓度与对照组比较均差异无统计学意义(P>0.05)。
表1 不同时间点hASCs培养上清液VEGF浓度(±s,ng/L)

表1 不同时间点hASCs培养上清液VEGF浓度(±s,ng/L)
注:与对照组比较,aP<0.05,bP<0.01
1 h 3 h 6 h 12 h 24 h 48 h 48 hr对照组 3 0 0.87±1.4 8.87±4.93 17.80±2.67 35.57±6.16组别 培养皿数(个) 89.07±13.42 80.73±16.74 RGOs组 3 0.47±0.82 6.6±3.2a22.23±5.91b40.67±4.32b78.80±12.01b412.90±33.67b343.80±41.56b
表2 不同时间点hASCs培养上清液IGF-1浓度(±s,ng/L)

表2 不同时间点hASCs培养上清液IGF-1浓度(±s,ng/L)
注:与对照组比较,aP<0.01
1 h 3 h 6 h 12 h 24 h 48 h 48 hr对照组 3 25.77±17.93 44.90±8.69 98.93±13.15 220.27±19.09 284.87±21.74 1053.83±51.77 949.53±1组别 培养皿数(个) 05.2 RGOs组 3 43.63±20.07 122.83±21.87a186.23±58.22a365.17±49.62a747.13±73.51a1606.63±71.73a1374.13±22.54a
表3 不同时间点hASCs培养上清液HGF浓度(±s,ng/L)
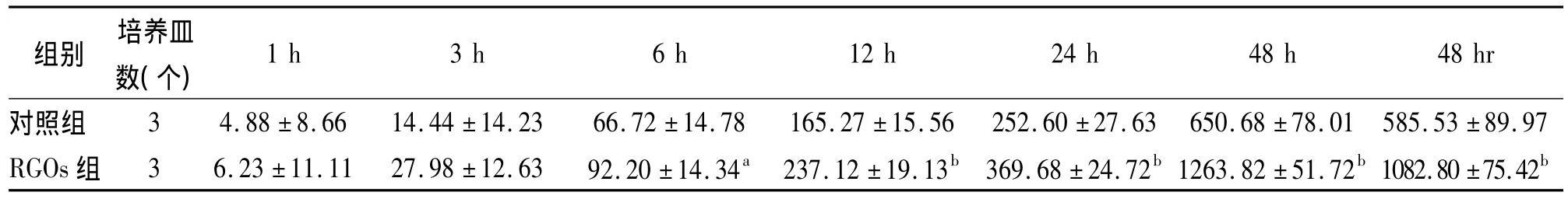
表3 不同时间点hASCs培养上清液HGF浓度(±s,ng/L)
与对照组比较,aP<0.05,bP<0.01
1 h 3 h 6 h 12 h 24 h 48 h 48 hr对照组 3 4.88±8.66 14.44±14.23 66.72±14.78 165.27±15.56 252.60±27.63 650.68±78.01 585.53±89.组别 培养皿数(个) 97 RGOs组 3 6.23±11.11 27.98±12.63 92.20±14.34a237.12±19.13b369.68±24.72b1263.82±51.72b1082.80±75.42b
表4 不同时间点hASCs培养上清液SDF-1α浓度(n=6,±s,ng/L)

表4 不同时间点hASCs培养上清液SDF-1α浓度(n=6,±s,ng/L)
注:与对照组比较,aP<0.01
1 h 3 h 6 h 12 h 24 h 48 h 48 hr对照组 3 0 20.92±16.00 92.21±22.15 116.43±44.20 198组别 培养皿数(个).25±26.41 687.67±31.36 618.40±47.71 RGOs组 3 5.23±6.11 51.03±33.02 163.73±50.47a344.55±37.39a425.55±70.50a1135.98±55.63a975.00±99.45a
表5 不同时间点hASCs培养上清液bFGF浓度(n=6,±s,ng/L)

表5 不同时间点hASCs培养上清液bFGF浓度(n=6,±s,ng/L)
1 h 3 h 6 h 12 h 24 h 48 h 48 hr对照组 3 2.55±4.40 10.72±8.21 10.12±9.56 15.31±5.3组别 培养皿数(个) 5 22.12±7.13 20.42±7.13 18.75±8.29 RGOs组 3 2.90±3.44 5.96±4.82 9.27±8.85 15.48±8.62 18.21±9.90 22.97±9.21 19.52±2.78
3 讨论
近年来,许多研究针对干细胞修复损伤组织的机制进行了探讨,但其确切机制仍不十分清楚。既往认为,干细胞主要通过分化成靶组织细胞或与靶组织细胞融合发挥作用。但干细胞分化,特别是定向分化取决于周围环境,迄今为止,干细胞在体内是否可以分化为靶组织细胞仍被质疑[4-5]。多项研究表明,干细胞植入缺血组织后并未分化成相应的靶组织细胞,但却通过促进新生血管生成、抗凋亡、抗炎和促进增殖等效应,明显改善缺血后心脏、肢体、肾脏和肝脏等器官功能。现已证实,ASCs能表达、合成、分泌生长因子、细胞因子、调节肽等多种生物活性因子,而且不同来源的ASCs所产生的生物活性因子谱相似,这些生物活性因子可以调节细胞的分化、增殖、迁移、存活、凋亡、代谢、营养、免疫和组织器官功能[6]。提示干细胞具有强大的旁分泌作用,这不仅直接影响植入干细胞自身的存活和分化,而且还可以调节组织内其他细胞的功能,后者是干细胞移植发挥治疗效应的重要机制之一。因此有学者提出ASCs可能主要通过旁分泌功能发挥治疗作用。
最近研究表明,干细胞表达、分泌生物活性因子受所处微环境、生长因子、激素等多种因素调节[7]。提示合理干预干细胞的旁分泌作用可能会更有效促进干细胞修复损伤组织。然而,目前大量实验数据亦显示,ASCs分泌各类生物活性因子的量极少,基本上是pg级水平。因此,其通过旁分泌发挥组织修复作用的潜力在一定程度上受到受限,故寻求有效的方法(药物或基因技术)提高ASCs的旁分泌作用成为干细胞研究的新热点。
体外研究证实,RGOs具有促进动物骨髓干细胞、骨骼肌成肌细胞及 hASCs增殖、分化的功能[8-11],但关于RGOs对ASCs旁分泌作用影响的研究鲜有报道。本研究从人腹部吸脂术后废弃的脂肪组织中分离、培养了hASCs,流式细胞仪鉴定显示,第4代hASCs表面抗原CD29、CD44、CD90、CD105的表达呈阳性,而CD31、CD45、HLA-DR的表达呈阴性。初步证实本实验分离、培养的hASCs具有间充质干细胞的表型。在此基础上,我们探讨了RGOs对体外培养的hASCs旁分泌作用的影响。结果显示,体外培养的hASCs在RGOs(0.1 g/L)预处理12 h后,其分泌VEGF、HGF、IGF-1、SDF-1α的作用明显加强,并且该促分泌作用具有一定时间依赖性,但RGOs预处理对bFGF分泌无明显的影响。提示RGOs可以促进hASCs的旁分泌作用,增加部分生长因子的分泌。这对RGOs用于干细胞治疗以及探讨其作用机制提供了实验理论依据。造成以上“选择性”促旁分泌作用的机制尚不明确。另有研究对RGOs的促旁分泌作用也进行了探讨,发现在(0.1~0.4)g/L浓度范围内,RGOs不但促进hASCs的增殖,而且促进hASCs分泌VEGF,但经细胞数校正后,该促分泌作用与对照组间无明显差异,该研究认为RGOs的促分泌是促增殖效应的间接表现[11]。但该研究测定的样本是含有小牛血清的培养基,小牛血清中一般均含有多种细胞活性因子,可能含有与所测生长因子相同的成分,故不能准确反应hASCs实际的旁分泌作用;另外,该研究仅观察了hASCs培养3 d时的VEGF水平,没有观察RGOs促分泌的时效性。而本研究提取的是无血清细胞培养上清液,排除了血清对生长因子测定结果的影响;另外,本研究观察了RGOs预处理12 h后不同时间点(1 h、3 h、6 h、12 h、24 h、48 h)细胞培养上清液中生长因子的水平,系统观察了RGOs作用的时效性;同时,由于无血清培养,RGOs作用时间短,RGOs促增殖效应并不明显;另外本研究还对48 h时间点的生长因子水平进行了细胞数校正。以上策略能够较准确反映RGOs实际的促旁分泌作用。
由于本实验是体外研究,在体情况下RGOs能否同样促进ASCs分泌多种生物活性因子,从而促进损伤组织的修复与再生值得进一步研究。
(本文图1见封三)
[1] Gnecchi M,Zhang Z,Ni A,et al.Paracrine mechanisms in adult stem cell signaling and therapy[J].Circ Res,2008,103(10):1204-1219.
[2] Li W,Ma N,Ong LL,et al.Bcl-2 engineered MSCs inhibited apoptosis and improved heart function[J].Stem Cells,2007,25(8):2118-2127.
[3] Tang YL,Zhu W,Cheng M,et al.Hypoxic preconditioning enhances the benefit of cardiac progenitor cell therapy for treatment of myocardial infarction by inducing CXCR4 expression[J].Circ Res,2009,104(10):1209-1216.
[4] Murry CE,Soonpa MH,Reineeke H,et al.Haematopoietic stem cells do not trandifferentiate into cardiac myocytes in myocardial infarcts[J].Nature,2004,428(6983):664-668.
[5] Balsam LB,Wagers AJ,Christensen JL,et al.Haematopoietic stem cells adopt mature haematopoietic fates in ischemic myocardium[J].Nature,2004,428(6983):668-673.
[6] Takahashi M,Li TS,Suzuki R,et al.Cytokines produced by bone marrow cells can contribute to functional improvement of the infarcted heart byprotecting cardiomyocytes from ischemic injury[J].Am J Physiol Heart Circ Physiol,2006,291(2):H886-H893.
[7] Crisostomo PR,Wang M,Herring CM,et al.Gender differences in injury induced mesenchymal stem cell apoptosis and VEGF,TNF,IL-6 expression:role of the 55kDa TNF receptor(TNFRl)[J].J Mol Cell Cardiol,2007,42(1):142-149.
[8] 尹明,王士雯,高磊,等.不同浓度地黄低聚糖对离体培养成年大鼠骨骼肌成肌细胞增殖的影响[J].中国中西医结合急救杂志,2008,15(4):195-197.
[9] 王玉红,陈光辉,张琰琴,等.地黄低聚糖对脂肪间充质干细胞增殖的影响[J].解放军药学学报,2008,24 (1):19-22.
[10]王新华,王士雯,李泱,等.地黄低聚糖诱导骨髓间充质干细胞向心肌样细胞分化的实验研究[J].解放军医学杂志,2009,34(4):412-414.
[11]王玉红,陈光辉,王舒,等.地黄低聚糖对人脂肪组织源性间充质干细胞分泌血管内皮细胞生长因子的影响[J].心脏杂志,2009,21(3):332-335.
Effect of rehmannia glutinosa oligosaccharides on paracrine action in human adipose tissue-derived stem cells
PEI Zhi-Yong*,ZHAO Yu-Sheng,GAO Wei,YIN Qiao-xiang(*Department of Geriatric Cardiology,Beijing Military General Hospital,Beijing 100700,China)
ObjectiveTo isolate and culture human adipose tissue-derived stem cells(hASCs)in vitro and investigate the effect of Rehmannia glutinosa oligosaccharides(RGOs)on its paracrine action.Methods The isolation and culture of hASCs was conducted by enzyme digestion and adherent from adipose tissue from abdomen.The surface antigens(CD29,CD31,CD44,CD45,CD90,CD105 and HLA-DR)of hASCs were examined by flow cytometry.The levels of vascular endothelial growth factor(VEGF),hepatocyte growth factor(HGF),insulin-like growth factor-1(IGF-1),basic fibroblast growth factor(bFGF)and stromal cell derived factor-lα(SDF-lα)in the hASCs supernatant were determined by enzyme-linked immunosorbent assay(ELISA)after RGOs(0.1 g/L)pretreating for 12 hours.Results The hASCs were identified by positive expression of CD29,CD44,CD90 and CD105,and negative expression of CD31,CD45 and HLA-DR.Campared with control group,the secretion of VEGF,HGF,IGF-1 and SDF-1α in RGOs group was increased significantly(P<0.05),but the secretion of bFGF did not increase significantly.Conclusion RGOs could enhance the paracrine action in cultured hASCs in vitro.
Rehmannia glutinosa;Mesenchymal stem cell;Adipose tissue;Intercellular signaling peptides and proteins
R969
A
10.3969/J.issn.1672-6790.2012.04.020
2011-11-12)
国家高科技研究发展计划(2006AA02A105)
裴志勇,副主任医师,E-mail:peizy6618222@sina.com
