20(S)-人参皂苷Rg3对结肠癌干细胞增殖及凋亡的影响
2012-09-11蒋依纹吉林大学药学院吉林长春130021
韩 博 蒋依纹 张 晨 周 悦 王 毅 (吉林大学药学院,吉林 长春 130021)
肿瘤干细胞是实体肿瘤组织内具有自我更新能力的细胞亚群,能够分化为多种细胞系而引起肿瘤的形成〔1〕。研究证明,结肠癌的复发是由具有显著增殖能力但数量稀少的肿瘤干细胞引起的。研究表明,人参皂苷Rg3对乳腺癌、肺癌、胃癌、肝癌及宫颈腺癌等多种肿瘤细胞具有抑制作用〔2~4〕。但现有研究主要集中于人参皂苷Rg3的R型,对于其同型异构体S型〔Rg3(S)〕的研究,特别是其对肿瘤干细胞作用的研究甚少。本实验拟选用人结肠癌细胞株HCT-116作为研究对象,观察Rg3(S)对结肠癌干细胞增殖及凋亡的影响,为Rg3(S)的抗结肠癌作用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 培养细胞 人结肠癌细胞株HCT-116购于中科院上海细胞库,在含10%胎牛血清的McCoy'S 5A培养液中,置于5%CO2、37℃培养箱中培养。
1.1.2 主要试剂 标准胎牛血清、McCoy'S 5A、DMEM/F12培养基、0.25%胰蛋白酶、B27(50×)(Gibco公司);免疫磁珠试剂盒、表面细胞生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)(Sigma公司);Biotin-上皮特异性黏附分子(EpCAM)单抗及Biotin-CD44单抗(eBioscience);胆囊收缩素8肽(CCK-8)(日本同仁);乙二胺四乙酸(EDTA)、二甲基亚砜(DMSO)(上海生工);半胱氨酸蛋白酶(Caspase)-9及Caspase-3分光光度检测试剂盒(南京凯基生物);Rg3(S)(吉林大学)。
1.2 方法
1.2.1 EpCAMhighCD44+HCT-116结肠癌干细胞的筛选 以EpCAM及CD44作为结肠癌干细胞筛选标记,利用Biotin标记抗体和免疫磁珠法筛选EpCAMhighCD44+结肠癌干细胞,筛选得到的EpCAMhighCD44+HCT-116细胞培养于含100 U/ml青霉素、100 U/ml 链霉素、2 μg/ml EGF、2 μg/ml bFGF、B27 的DMEM/F12无血清培养基中,37℃,5%CO2条件下培养,待结肠癌干细胞的微球生长至100个细胞时,传代,每3~5 d换液1次。
1.2.2 诱导分化实验 收集对数生长期EpCAMhighCD44+HCT-116细胞,重悬于含10%胎牛血清的DMEM/F12培养基中,于37℃、5%CO2条件下培养;观察 EpCAMhighCD44+HCT-116细胞的形态变化。
1.2.3 细胞生长曲线的测定 取对数生长期的结肠癌HCT-116细胞及EpCAMhighCD44+HCT-116细胞,接种于96孔板,每孔 500 个细胞,分别于 6、8、12、16、20、24、28、32、36、48、72、96 h后,利用CCK-8试剂盒检测OD450 nm,绘制生长曲线。
1.2.4 Rg3(S)对EpCAMhighCD44+HCT-116细胞的时效/量效关系确定 取对数生长期的EpCAMhighCD44+HCT-116细胞,以5 000/孔的密度接种于96孔板,培养24 h后加药。每组设3个复孔,分别加入终浓度为 80、160、320、640、1 280、2 560、5 120 μg/ml人参皂苷Rg3(S)(实验组);不加药物的细胞为对照组。分别于孵育 3、6、9、12、24、48、72 h 后以 CCK-8 测定OD450 nm。细胞抑制率=实验组OD值/(对照组OD值-实验组OD)×100%。
1.2.5 Rg3(S)对EpCAMhighCD44+HCT-116细胞增殖的抑制作用 取对数生长期的 EpCAMhighCD44+HCT-116细胞,以5 000/孔的密度接种于96孔板,培养24 h后,分别加入终浓度为 160、320、640 μg/ml的 Rg3(S);30 μg/ml丝裂霉素(阳性对照);不加药物的细胞为阴性对照。药物作用48 h后,以CCK-8法测其OD450 nm,检测Rg3(S)对其增殖的抑制作用;细胞抑制率按公式计算,细胞抑制率=实验组OD值/(对照组OD值-实验组OD)×100%。
1.2.6 Caspase-9及Caspase-3的检测 取对数生长期的Ep-CAMhighCD44+HCT-116细胞,以1×105/孔的密度接种于6孔板,培养48 h 后,分别加入终浓度为 160、320、640 μg/ml的 Rg3(S);30 μg/ml丝裂霉素(阳性对照);不加药物的细胞为阴性对照组。药物作用48 h后,收集细胞,按试剂盒说明提取蛋白,分光光度计测定OD405 nm。Caspase酶活性以OD诱导剂/OD阴性对照比值表示。
1.3 统计学方法 应用SPSS17.0统计软件进行分析,数据资料以表示,组间均数的比较采用t检验。
2 结果
2.1 EpCAMhighCD44+HCT-116细胞的形态 经过无血清培养5~6 d后,可观察到小的微球形成,每个球形体由10~20个细胞聚集而成。随培养时间延长,可见球形体直径增大,大小不一,折光性较强,悬浮于培养基中;将EpCAMhighCD44+HCT-116细胞培养于含10%胎牛血清的DMEM/F12培养基后,原来悬浮生长的细胞逐渐贴壁生长。见图1,图2。
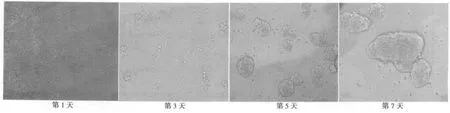
图1 EpCAMhighCD44+HCT-116细胞的无血清培养(×200)
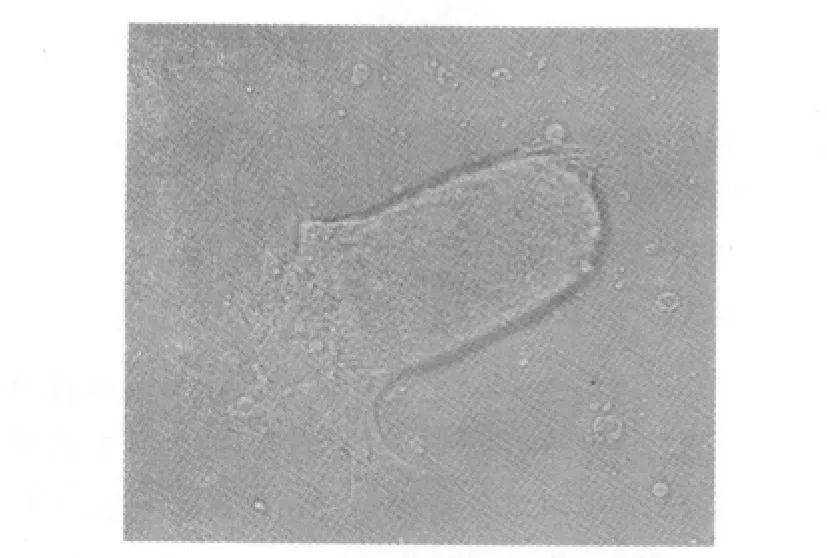
图2 EpCAMhighCD44+HCT-116细胞的诱导分化(×200)
2.2 细胞增殖 EpCAMhighCD44+细胞的体外增殖速度略高于肿瘤细胞HCT-116,进入平台期后二者增殖速度达到一致。见图3。
2.3 Rg3(S)对EpCAMhighCD44+HCT-116细胞增殖的影响不同浓度的Rg3(S)对结肠癌干细胞EpCAMhighCD44+HCT-116的增殖均具有一定的抑制作用,其中Rg3(S)浓度为640 μg/ml、作用时间为48 h时,对细胞增殖的抑制率最高;48 h之后抑制作用达到平台期。见图4。
2.4 Rg3(S)对 EpCAMhighCD44+HCT-116细胞 Caspase-9及Caspase-3酶活性的影响 随 Rg3(S)浓度增高,EpCAMhighCD44+HCT-116细胞中的Caspase-9和Caspase-3的酶活性也增强,并且经 640 μg/ml Rg3(S)作用后,EpCAMhighCD44+HCT-116细胞中的Caspase-3活性显著高于阳性药物丝裂霉素组(P<0.05)。提示Rg3(S)具有较强的促进EpCAMhighCD44+HCT-116细胞凋亡的作用。见表1。

图3 生长曲线
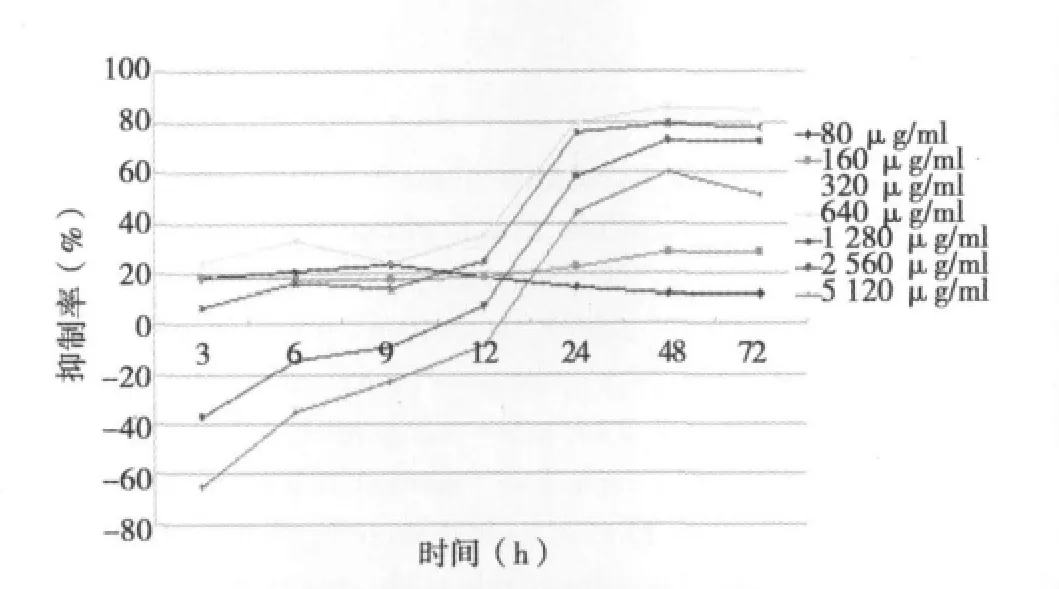
图4 Rg3(S)对EpCAMhighCD44+HCT-116细胞增殖的影响
表1Rg3(S)对EpCAMhighCD44+HCT-116细胞凋亡酶活性的影响()

表1Rg3(S)对EpCAMhighCD44+HCT-116细胞凋亡酶活性的影响()
与丝裂霉素组比较:1)P<0.05
8.05±0.39 320 3.66±0.20 5.92±0.83 160 1.32±0.15 1.53±0.12丝裂霉素Caspase-3 Caspase-9 Rg3(S) 640 7.11±0.781)组别 剂量(μg/ml)30 1.78±0.16 6.92±0.58
3 讨论
人参皂苷可以抑制肿瘤细胞生长,诱导肿瘤细胞凋亡,对化疗有促进疗效的作用〔5〕;动物实验也显示人参皂苷可以抑制小鼠体内肝癌的生长和癌细胞增殖〔6〕。
本研究以细胞表面抗体EpCAM及CD44作为标记,免疫磁珠法筛选结肠癌细胞HCT-116无血清条件下培养,3~7 d后可见明显结肠癌干细胞微球,并且第2代结肠癌干细胞仍具有成球能力;在含血清的培养条件下进行诱导分化实验,结肠癌干细胞在第3天呈贴壁状态,提示其开始分化为结肠癌细胞;Rg3(S)作用24 h后细胞增殖明显受到抑制,48 h时达最大抑制率,当Rg3(S)浓度为640 μg/ml时,抑制率最高。
Caspase家族在介导细胞凋亡的过程中起着非常重要的作用;Caspase-9是级联酶的上游分子,可被线粒体向细胞质释放的细胞色素C激活。激活的Caspase-9可引起下游级联酶的活性,如Caspase-3〔7〕。Caspase-9在正常状态下以酶原的形式存在于胞质中,没有活性;但在细胞发生凋亡阶段时则被激活。
Caspase-3是细胞凋亡蛋白级联反应的必经之路,活化的Caspase-3可活化其他Caspases和多种胞质内和核内成分,因此通过检测Caspase-3活性可了解细胞凋亡情况。本实验观察到Rg3(S)作用后,Caspase-9及Caspase-3的活性显著增强,提示细胞发生凋亡〔8〕。
综上所述,Rg3(S)可激活Caspase-9、Caspase-3途径,抑制人结肠癌干细胞的增殖,促进细胞凋亡。然而,目前对Rg3(S)致凋亡机制的研究尚未完善。本研究为今后进一步探索Rg3(S)对结肠癌干细胞的作用机制奠定了基础。
1 Yeunga TM,Gandhi SC,Wilding JL,et al.Cancer stem cells from colorectal cancer-derived cell lines〔J〕.Proc Natl Acad Sci,2010;107(8):3722-7.
2 Zhang Q,Kang X,Zhao W.Antiangiogenic effect of low-dose cyclophosphamide combined with ginsenoside Rg3 on Lewis lung carcinoma〔J〕.Biochem Biophys Res Commun,2006;342(3):824-8.
3 Kim HS,Lee EH,Ko SR,et al.Effects of ginsenosides Rg3 and Rh2 on the proliferation of prostate cancer cells〔J〕.Arch Pharm Res,2004;27(4):429-35.
4 易 成,黄晓兵,侯 梅.化疗联合人参皂苷Rg3治疗肺癌的实验研究〔J〕.中国中西医结合杂志,2005;25(1):58-9.
5 安 宁,朱 文.人参皂苷Rg3抗肿瘤作用机制研究进展〔J〕.现代肿瘤医学,2008;16(4):648-52.
6 袁国荣,叶再元.人参皂苷Rg3联合紫杉醇抗胃癌转移的作用及机制研究〔J〕.中华中医药学刊,2011;29(3):625-8.
7 田 甜,王小毅,李 佳,等.REGgamma基因对乳腺癌细胞MCF-7增殖和凋亡的影响〔J〕.中国肿瘤临床,2008;35(20):1196-9.
8 高 飞,郭 文,王继德.Smac/DIABLO过表达对人结肠癌细胞凋亡的影响〔J〕.胃肠病学,2007;12(11):676-80.
