DOG1蛋白在胃肠道间质瘤诊断中的价值研究
2012-09-06祝燕军钱立勇黄燕凤
祝燕军,钱立勇,黄燕凤
胃肠道间质瘤 (GISTs)是最常见的胃肠道间叶源性肿瘤,起源于胃肠道卡哈尔间质细胞 (ICC)或向ICC分化的原始间充质细胞,遗传学上存在原癌基因蛋白质c-kit或血小板衍生生长因子受体 α(PDGFRα)基因激活突变,表现为CD117蛋白免疫表型阳性。随着GISTs靶向治疗的研究进展,GISTs患者的预后已显著提高,其诊断除肿依据瘤生长部位、组织学形态等特征外,主要依赖于免疫组化CD117蛋白和CD34蛋白阳性表达。DOG1基因是最新应用基因表达谱技术发现的一种高度表达于GISTs的基因,在GISTs中的表达率为90% ~95%[1],是一种较敏感、特异的标志物。本研究通过对67例GISTs患者及39例非GISTs患者间叶源性肿瘤标本进行免疫组化检测,比较GISTs患者DOG1蛋白和CD117蛋白的表达情况,旨在探讨DOG1蛋白在GISTs诊断中的价值。
1 资料与方法
1.1 一般资料 选择岱山县第一人民医院和舟山医院2007年1月—2011年12月收治的GISTs患者67例为病例组,其中男35例,女32例;年龄25~84岁,中位年龄56岁;肿瘤直径1.5~25.0 cm,中位直径8.5 cm;肿瘤部位:胃34例,小肠21例,大肠7例,胃肠道外5例;镜下组织学类型:梭形细胞型53例,上皮样细胞型8例,混合型6例。参考美国国立卫生研究院 (NIH)制定的GISTs危险度分级 (2008年)对患者进行分级:极低危险度9例,低危险度18例,中危险度24例,高危险度16例。选择同期岱山县第一人民医院和舟山医院非GISTs患者39例为对照组,其中男21例,女18例;年龄27~81例,中位年龄51岁;平滑肌瘤25例,神经鞘瘤6例,纤维瘤8例。两组患者临床资料完整,诊断明确,均为原发性肿瘤并经手术切除。
1.2 方法 收集两组患者肿瘤标本,用10%甲醛溶液固定,常规脱水、石蜡包埋,4 μm厚切片,HE染色,光学显微镜观察。免疫组化采用SP法检测GISTs患者DOG1蛋白和CD117蛋白的表达,DOG1蛋白和CD117蛋白试剂盒均购自北京中杉金桥生物技术有限公司,实验步骤按试剂盒说明书进行。
1.3 结果判定标准 显微镜下观察阳性细胞数量并分类:阳性细胞数量<5%为阴性 (-);阳性细胞数量5% ~24%为弱阳性 (+),呈棕色颗粒;阳性细胞数量25%~50%为中度阳性 (++),呈褐色颗粒;阳性细胞数量>50%为强阳性 (+++),呈深褐色颗粒。
1.4 统计学方法 应用SPSS 13.0软件进行统计学分析,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组DOG1蛋白表达情况 对照组中3例患者DOG1蛋白呈弱阳性表达,阳性表达率为7.69%(3/39),其中2例为平滑肌瘤,1例为纤维瘤。病例组中64例患者DOG1蛋白呈阳性表达,阳性表达率为95.52% (64/67),其中弱阳性1例,中度阳性3例,强阳性60例。两组DOG1蛋白阳性表达率比较,差异有统计学意义 (χ2=82.0029,P<0.01)。
2.2 GISTs组织病理学特征 极低和低危险度GISTs患者以梭形细胞为主,瘤细胞较为稀疏,与平滑肌瘤细胞极为相似。梭形细胞呈束状、编织状或旋涡状排列,部分呈栅栏状排列,瘤细胞呈细长梭形,边界不清,胞质丰富、淡染,细胞核呈杆状,两端钝圆或长梭形,可见核端空泡 (见图1A)。中危险度GISTs患者也以梭形细胞为主,可见上皮样细胞,异型性不明显,但细胞密度较低危险度者明显增加,局部可见坏死。上皮样细胞呈圆形、卵圆形或多边形,胞质丰富,大部分边界清楚,细胞核呈圆形、卵圆形或多边形,核仁明显,部分胞质空泡化呈印戒样细胞 (见图1B)。高危险度GISTs患者瘤细胞丰富多形,上皮样细胞较多见,细胞密集,胞质少而淡红染或无红染,核大畸形,核分裂像多见,可见大片坏死、出血及黏膜浸润现象。
2.3 GISTs患者DOG1蛋白和CD117蛋白表达情况 DOG1蛋白和CD117蛋白主要在细胞质表达,少量表达于细胞膜,均呈弥漫性分布 (见图1C、1D)。GISTs患者DOG1蛋白阳性表达率 (95.52%)高于CD117蛋白阳性表达率 (92.54%,62/67),但差异无统计学意义 (χ2=0.5317,P>0.05);在CD117蛋白表达阴性的5例患者中,DOG1蛋白均呈阳性表达。不同性别、年龄、肿瘤部位、肿瘤直径、组织学类型及危险度的GISTs患者DOG1蛋白及CD117蛋白阳性表达率比较,差异均无统计学意义 (P>0.05,见表1)。

表1 GISTs患者DOG1蛋白和CD117蛋白阳性表达率与临床病理特征的关系〔n(%)〕Table 1 Relationship between the positive expression rates of DOG1 and CD117 and clinic opathologic features in GISTs patients
3 讨论
GISTs的发病率为 (1~2)/10万,占全部胃肠道肿瘤的1% ~4%[2-3],最常发生于胃 (60% ~70%),其次为小肠(20% ~30%)、结直肠 (5%)、食管 (<5%),偶见于胃肠道外,如网膜、肠系膜等。本病发病高峰年龄为55~65岁,男稍多于女或男女相等[4]。近年研究认为原癌基因蛋白质ckit或PDGFRα突变是其主要发病机制。本组患者资料显示,GISTs病变部位依次为胃、小肠、大肠、胃肠道外;男女比例为1.09∶1;中位年龄为56岁,与文献报道基本一致。
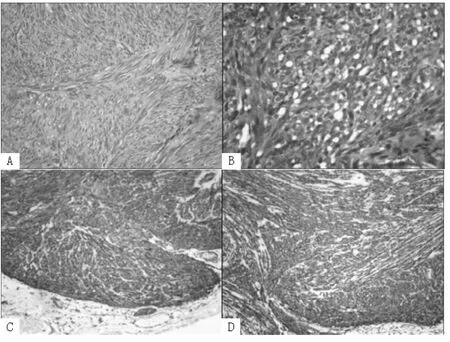
图1 GISTs组织病理学特征及CD117和DOG1的表达Figure 1 Histopathological features of GISTs and Immunohistochemical expression of DOG1 and CD117
CD117蛋白是较可靠的诊断GISTs的免疫标记物,但仍有5%的GISTs患者CD117蛋白表达阴性。有文献报道,精原细胞瘤、肥大细胞瘤、肌纤维母细胞瘤、恶性黑色素瘤等均可表达CD117蛋白,且部分肿瘤与GISTs组织学形态相似,增加了GISTs鉴别诊断的难度,单纯依靠CD117蛋白诊断容易造成漏诊和误诊。DOG1基因在GISTs中表达率为90% ~95%,在其他类型肉瘤中呈低表达,是一种特异性标记物[5],其定位于人染色体11q13上的CCND1-EMS1位点,含26个外显子,也被称为 ORAOV2、TMEM16A、FLJ10261 和 ANO1[6]。对DOG1基因DNA序列进行分析发现,其有8个穿膜的功能区,虽尚未知其功能,但由于跨膜区域的数量较多而被认为是一种钙调控的氯离子通道蛋白[7]。
DOG1蛋白选择性高表达于GISTs,对上皮样胃间质瘤、PDGFRα突变间质瘤、胃肠外间质瘤、转移性间质瘤及儿童间质瘤均有良好的灵敏度及特异度[8],且其表达不依赖于原癌基因蛋白质 c-kit或 PDGFRα突变。Miettinen等[1]研究了1 168例不同部位、病理亚型的GISTs患者和672例其他肿瘤患者及正常人群DOG1蛋白的表达,发现GISTs患者DOG1蛋白和CD117蛋白的总体敏感性几乎相同 (94.4%vs 94.7%)。胃梭形细胞型GISTs患者的两个标记物均为阳性,而DOG1蛋白在上皮细胞型GISTs(包括PDGFRα突变GISTs)患者的灵敏度较好。Liegl等[9]采用免疫组化方法分析了74例GISTs患者的病理组织,结果表明DOG1蛋白在36%的原癌基因蛋白质c-kit阴性患者中呈阳性表达,是一种较CD117蛋白更敏感的免疫组化标记物。本研究结果显示,GISTs患者DOG1蛋白和CD117蛋白阳性表达率分别为95.52%和92.54%,但差异无显著性,说明两者诊断GISTs时具有较为一致的敏感性;而在CD117蛋白阴性的5例患者中,DOG1蛋白均呈阳性表达,说明DOG1蛋白诊断CD117蛋白阴性的GISTs具有一定的优势。DOG1蛋白与CD117蛋白有较好的互补性,联合应用可显著提高GISTs的诊断率,减少漏诊率和误诊率。本研究同时发现,DOG1蛋白在GISTs患者中的阳性表达率明显高于非GISTs患者,表明DOG1蛋白在GISTs的鉴别诊断中有较大的应用价值。
甄丽影等[10]通过检测GISTs患者的DOG1蛋白表达,分析了DOG1蛋白与GISTs的相关性,结果显示,GISTs患者DOG1蛋白的阳性表达率为96.1%,不同性别、年龄、部位及危险度间DOG1蛋白阳性表达率无明显差异。Espinosa等[11]研究发现,DOG1蛋白在GISTs患者中的表达与基因突变类型、突变位置、肿瘤大小、肿瘤危险度及患者年龄均无相关性。本研究结果与上述文献报道的结果基本一致。DOG1蛋白同CD117蛋白一样,可以作为诊断GISTs较敏感和特异的可靠标记物,但其在GISTs恶性程度和分化程度判断中的价值有待于进一步研究。
目前GISTs诊断除了结合超声内镜检查、肿瘤解剖学位置、组织形态等特征外,主要依赖于免疫组化CD117蛋白(阳性率90% ~95%)和CD34蛋白 (阳性率70%)的阳性表达。对于CD117蛋白阴性而组织学形态可疑的GISTs患者,2009年GISTs诊断与治疗中国专家共识推荐结合DOG1蛋白和Nestin、PDGFRα进行诊断,应用分子生物学手段检测原癌基因蛋白质c-kit和PDGFRα基因的突变情况来辅助诊断[12]。
总之,DOG1蛋白是一种新的较敏感和特异的GISTs标记物,在胃肠道间叶源性肿瘤的诊断及鉴别诊断中具有一定应用价值,与CD117蛋白联合应用可起到有效的互补作用,提高GISTs的诊断率,且检测方法简便易行,值得临床推广应用。但目前关于DOG1蛋白在 GISTs诊断中的研究较少,其在GISTs发生发展过程中的作用机制有待于进一步研究,针对其靶点的分子靶向药物的研究有可能在GISTs的治疗中有较大的临床应用前景。
1 Miettinen M,Wang ZF,Lasota J,et al.DOG1 antibody in the differential diagnosis of gastrointestinal stromal tumors:a study of 1840 cases[J].Am J Surg Pathol,2009,33(9):1401 -1408.
2 Corless CL,Heinrieh MC.Molecular pathobiology of gastrointestinal stromal sarcomas[J].Annu Rev Pathol,2008,3:557 -586.
3 Rossi CR,Mocellin S,Mencarelli R,et al.Gastrointestinal stromal tumors:from a surgical to a molecular approach [J].Int J Cancer,2003,107(2):171-176.
4 Hornick JL,Fletcher CD.Immunohistochemical staining for KIT(CD117)in soft tissue sarcomas is very limited in distribution [J].Am J Clin pathol,2002,117:188 -193.
5 West RB,Corless CL,Chen X,et al.The novel marker,DOG1,is expressed ubiquitously in gastrointestinal stromal tumors irrespective of KIT or PDGFRα mutation status[J].Am J Pathol,2004,165(1):107-113.
6 Katoh M,Katoh M.FLJ10261 gene,located within the CCND1-EMS1 locus on human chromosome 11q13,encodes the eight-transmembrane protein homologous to C12orf3,C11orf25 and FLJ34272 gene products[J].Int J Oncol,2003,22(6):1375 -1381.
7 Carles A,Millon R,Cromer A,et al.Head and neck squamous cell carcinoma transcriptome analysis by comprehensive validated differential display[J].Oncogene,2006,25(12):1821 -1831.
8 Lee CH,Liang CW,Espinosa I,et al.The utility of discovered on gastrointestinal stromal tumor 1(DOG1)antibody in surgical pathology-the GIST of it[J].Adv Anat Pathol,2010,17(3):222-232.
9 Liegl B,Hornick JL,Corless CL,et al.Monoclonal antibody DOG1 shows higher sensitivity than KIT in the diagnosis of gastrointestinal stromal tumors,including unusual subtypes [J].AM J Surg Pathol,2009,33(3):437-446.
10 甄丽影,李岩,徐灿.DOG1蛋白在胃肠道间质瘤中的表达及相关性分析 [J].中华消化杂志,2010,30(9):585-587.
11 Espinosa I,Lee CH,Kim MK,et al.A novel monoclonal antibody against DOG1 is a sensitive and specific marker for gastrointestinal stromal tumors[J].Am J Surg Pathol,2008,32(2):210 -218.
12 胃肠道间质瘤中国专家组.胃肠道间质瘤诊断与治疗中国专家共识[J].中华胃肠外科杂志,2009,12(5):536-539.
