降钙素基因相关肽对人支气管上皮细胞E-钙粘素表达的影响*
2012-08-30白洪波刘永平段佳熙孙国瑛管茶香
白洪波,刘永平,段佳熙,周 勇,孙国瑛,管茶香△
(1.中南大学湘雅医学院生理学系,长沙 410008;2.广州医学院生理学教研室,广州 510182;3.湖南中医药大学生理学教研室,长沙 410208)
气道上皮是机体抵抗气源性外部刺激的屏障。气道上皮的损伤修复与气道疾病的发生发展密切相关,在维持气道稳态中起重要作用。E-钙粘素(E-cadherin,E-cd)是表达于上皮细胞的重要粘附分子,主要通过同型分子参与介导特定器官或组织同型细胞间的粘附,维持气道上皮细胞的极性和完整性[1]。降钙素基因相关肽(calcitonin gene-related peptide,CGRP)是肺内含量丰富的神经肽,具有促进支气管上皮细胞增殖、收缩气道平滑肌、增加血管通透性和促进黏液分泌等多种效应[2-4]。但CGRP是否通过影响气道上皮细胞E-cd的表达进而参与气道损伤后的修复尚未见报道。本研究旨在观察CGRP对人支气管上皮细胞(human bronchial epithelial cells,HBECs)E-cd表达的影响,并探讨其信号转导途径。
1 材料与方法
1.1 材料
永生化人支气管上皮细胞(16HBE14o-细胞株)由美国加州大学旧金山分校Gruenert教授惠赠。DMEM/高糖培养基为Gibco公司产品,胎牛血清、青/链霉素均为国产;DEPC为BBI公司产品,逆转录试剂盒、Taq DNA聚合酶和dNTP购自MBI公司,Trizol为Invitrogen Life technologies公司产品、E-cd引物为Takara(大连宝生物)公司产品,DNA Marker为鼎国公司产品。鼠抗人E-cd单克隆抗体和通用型二抗(生物素标记羊抗兔/大鼠/小鼠/豚鼠IgG)为北京中杉公司产品,DAB显色试剂盒购自武汉博士德公司。
1.2 HBECs培养及实验分组
将细胞接种至含10%胎牛血清的DMEM/高糖培养基(含青/链霉素各 100 U/ml),置于37℃、5%CO2和饱和湿度的CO2培养箱中培养。将HBECs按以下分组:(1)CGRP预处理量效研究 正常对照组、O3组、CGRP处理组及CGRP预处理+O3组(CGRP浓度分别为10-10mol/L、10-9mol/L、10-8mol/L和10-7mol/L);(2)CGRP信号途径研究正常对照组、CGRP处理组、CGRP+H-89处理组、CGRP+H-7处理组及CGRP+W-7处理组。CGRP浓度为10-8mol/L,H-89、H-7和W-7的终浓度均为10-5mol/L。CGRP预处理2 h后,需进行O3应激的细胞置于含1.5×10-6的O3箱中应激2 h,再放回CO2培养箱继续培养至实验设计的时间点进行指标检测。
1.3 免疫细胞化学染色检测E-cd蛋白的表达
处理后的细胞经95%乙醇固定15 min,正常羊血清封闭20 min,抗E-cd单克隆抗体4℃孵育过夜;通用型生物素标记羊二抗于37℃孵育30 min,辣根过氧化物酶标记链卵蛋白(S-A/HRP)37℃孵育30 min,DAB显色。阴性对照为缓冲液取代一抗。将细胞盖片,在光镜下观察,结果判断:E-cd阳性显示为明亮的棕黄色颗粒。取相同倍数(×400)拍摄图像。将拍摄的照片用Image-Pro Plus 5.0图像分析系统先进行背景灰度校正,然后统计分析E-cd阳性产物的平均灰度值(系统灰度校正过程中,设置0为纯黑、255为纯白)。
1.4 RT-PCR检测E-cd mRNA含量
1.4.1 细胞总RNA的提取及逆转录 按试剂盒说明,先提取细胞总RNA,再在20 μ l反应体系中加入总 RNA 1 μ g,25 mmol/L MgCl24 μ l,10×逆转录缓冲液2 μ l,RNA 酶抑制剂 0.5 μ l,AMV 逆转录酶 15 U,Oligo(dT)Primer 0.5 μ g。反应条件为 :65℃ 5 min,42℃60 min,99℃5 min。逆转录产物置-20℃保存。
1.4.2 PCR扩增 E-cd引物序列设计如下:上游:5'-TCC CAT CAG CTG CCC AGA AA-3',下游:5'-TGA CTC CTG TGT TCC TGT TA-3',扩增产物大小502 bp。内对照为3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),上游:5'-TGA TGA CAT CAA GAA GGT GGT GAA G-3',下游:5'-TCC TTG GAG GCC ATG TGG GCC AT-3',扩增产物大小240 bp。PCR反应条件为:95℃5 min预变性,94℃30 s,58℃30 s,72℃30 s,30个循环后72℃5 min。反应体系为 20 μ l:10 ×PCR 缓冲液 2 μ l,25 mmol/L MgCl21.2 μ l,10 μ mol/L 上 、下游引物各 1 μ l,10 mmol/L dNTP 0.4 μ l,Taq DNA 聚合酶 0.4 U。经PCR扩增后产物置4℃保存。
1.4.3 产物分析 取10 μ l扩增产物于 2%琼脂糖凝胶(含溴化乙锭 0.5 μ g/μ l)电泳(100 V,25 min)。电泳后将凝胶置于紫外线灯下,根据DNA Marker判断产物,用NIH ImageJ V1.31软件进行分析,测定面积灰度,以光密度代表其表达量。
1.5 统计学处理
2 结果
2.1 CGRP对正常HBECs E-cd表达的影响
免疫组化染色平均灰度分析显示,CGRP作用于HBECs 28 h后,棕黄色E-cd阳性产物围绕HBECs膜呈均匀线状分布,胞浆内少量表达,HBECs膜上E-cd阳性产物随CGRP浓度升高而增多,与对照组相比差异显著(P<0.05,图 1A,表 1),而胞浆内E-cd阳性产物量不随CGRP浓度变化(P>0.05,图1A,表1);RT-PCR实验结果显示,CGRP各处理组的HBECs E-cd mRNA相对表达量较对照组均明显增加(P<0.05,图 1B,表 2)。

Fig.1 Effect of CGRP on the expression of E-cd in normal HBECs(n=5)
2.2 CGRP对O3应激后HBECs E-cd表达的影响
免疫组化染色平均灰度分析显示:与对照组相比,CGRP呈剂量依赖性上调O3应激后的HBECs E-cd表达(P<0.05,图 2A,表 1);胞浆内E-cd阳性产物在各浓度CGRP均无明显改变(P>0.05,图2A,表1)。RT-PCR检测HBECs E-cd mRNA相对表达量与O3应激对照组相比,O3+CGRP处理各组HBECs E-cd mRNA相对表达量均增加(P<0.05,图2B,表2)。
Tab.1 Average grave value of E-cd in unstimulated and O3-stressHBECs(±s,n=20)
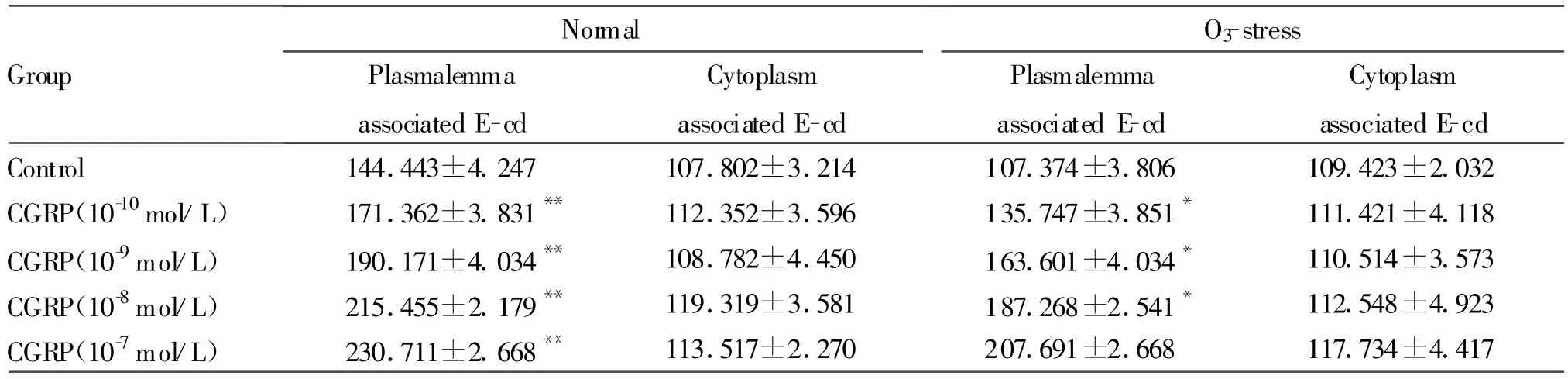
Tab.1 Average grave value of E-cd in unstimulated and O3-stressHBECs(±s,n=20)
*P<0.05,**P<0.01 vs control group(plasmalemma)
Normal O3-stress Group Plasmalemma associated E-cd Cytoplasm associated E-cd Plasmalemma associated E-cd Cytoplasm associated E-cd Control 144.443±4.247 107.802±3.214 107.374±3.806 109.423±2.032 CGRP(10-10mol/L) 171.362±3.831** 112.352±3.596 135.747±3.851* 111.421±4.118 CGRP(10-9mol/L) 190.171±4.034** 108.782±4.450 163.601±4.034* 110.514±3.573 CGRP(10-8mol/L) 215.455±2.179** 119.319±3.581 187.268±2.541* 112.548±4.923 CGRP(10-7mol/L) 230.711±2.668** 113.517±2.270 207.691±2.668 117.734±4.417
Tab.2 Relative richness of E-cd mR NA in HBECs(±s,n=20)
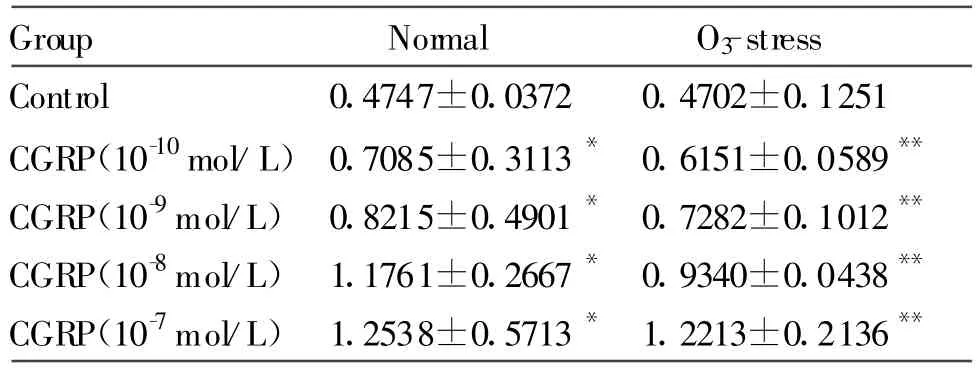
Tab.2 Relative richness of E-cd mR NA in HBECs(±s,n=20)
*P<0.05,**P<0.01 vs control group
Group Normal O3-stress Control 0.4747±0.0372 0.4702±0.1251 CGRP(10-10mol/L)0.7085±0.3113* 0.6151±0.0589**CGRP(10-9mol/L)0.8215±0.4901* 0.7282±0.1012**CGRP(10-8mol/L)1.1761±0.2667* 0.9340±0.0438**CGRP(10-7mol/L)1.2538±0.5713* 1.2213±0.2136**
2.3 H-89、H-7和W-7对HBECs E-cd表达的影响
免疫组化染色平均灰度分析显示,与CGRP处理组相比,CGRP+H-89处理组、CGRP+H-7处理组和CGRP+W-7处理组HBECs膜上E-cd阳性产物均减少(P<0.05,图 3A、3B)。RT-PCR结果表明:H-89、H-7和W-7预处理后,E-cd mRNA表达均明显下降(P<0.05,图3C、3D)。

Fig.2 Effect of CGRP on the expression of E-cd in O3-challenged HBECs(n=5)
3 讨论
哮喘等气道疾病常伴有不同程度支气管上皮细胞结构完整性的破坏和功能受损,后者被认为是哮喘发生的关键环节之一[5]。E-cd主要表达于上皮细胞表面,介导细胞间的“同源性细胞粘附”。E-cd的分子结构由细胞外区、跨膜区和细胞内区组成,其胞浆内段与连环素结合形成复合体,并锚定于肌动蛋白细胞骨架上,使相邻细胞形成稳定连接,参与气道上皮细胞层的形成和维持[1,6]。当细胞受到有害因素刺激,细胞膜上的E-cd/连环素复合体发生酪氨酸磷酸化,E-cd移入胞浆,将导致气道上皮脱落[6]。本实验观察到,正常HBECs中E-cd有较高表达,提示E-cd参与维持正常气道上皮的完整性。

Fig.3 Effect of H-89,H-7 and W-7 on E-cd expression in HBECs(n=5)
气道上皮层含有多种肺内神经肽,能与支气管上皮细胞的受体结合发挥作用。本实验观察到,CGRP能增加正常 HBECs胞膜 E-cd的表达,对HBECs细胞膜的稳定、防止气道受到外来毒害侵袭、维持气道稳态具有积极意义。我室前期研究表明[7],O3应激后HBECs膜上E-cd的表达减少,胞浆内E-cd表达增加;应激32 h后,HBECs膜上E-cd表达才逐渐增加、胞浆内E-cd表达则减少,直至恢复到应激前的水平。本实验在CGRP预处理后给予O3应激,结果显示CGRP可剂量依赖性地增加HBECs胞膜E-cd的表达,提示CGRP能够加速O3应激后HBECs中E-cd表达的动态变化过程,缩短E-cd表达恢复正常的时间。表明CGRP能加速损伤细胞的修复,有利于气道上皮局部稳态的恢复和维持。
蛋白激酶A(protein kinase A,PKA)、蛋白激酶C(protein kinase C,PKC)、钙调蛋白(calmodulin,CaM)是细胞内信号转导的重要环节。CGRP能通过PKA、PKC和CaM途径调控多种细胞的功能[8,9]。本文观察到PKA阻断剂(H-89)、PKC阻断剂(H-7)和CaM阻断剂(W-7)可从蛋白和基因水平部分逆转CGRP对HBECs E-cd表达的上调作用。提示CGRP上调E-cd表达的细胞内信号途径与PKA、PKC和CaM途径有关。有关CGRP与E-cd的关系及其在呼吸系统疾病中的作用值得进一步研究。
[1] Tian X,LiuZ,Niu B,et al.E-cadherin/β-catenin complex and the epithelial barrier[J].J Biomed Biotechnol,2011,2011:567305.
[2]Guan C X,Zhang M,Qin X Q,et al.Vasoactive intestinal peptide enhances wound healing and proliferation of human bronchial epithelial cells[J].Peptides,2006,27(12):3107-3114.
[3]Rochlitzer S,Veres T Z,Kühne K,et al.The neuropeptide calcitonin gene-related peptide affects allergic airway inflammationby modulating dendritic cell function[J].Clin Exp Allergy,2011,41(1):1609-1621.
[4]Bonner K,Kariyawasam H H,Ali F R,et al.Expression of functional receptor activity modifying protein 1 by airway epithelial cells with dysregulation in asthma[J].J Allergy Clin Immunol,2010,126(6):1277-1283.
[5]Oslund K L,Hyde D M,Putney L F,et al.Activation of calcitonin gene-related peptide receptor during ozone inhalation contributes to airway epithelial injury and repair[J].Toxicol Pathol,2009,37(6):805-813.
[6]NawijnM C,Hackett T L,Postma D S,et al.E-cadherin:gatekeeper of airway mucosa and allergic sensitization[J].Trends Immunol,2011,32(6):248-255.
[7]白洪波,管茶香,刘永平,等.臭氧应激对人支气管上皮细胞上皮钙粘素表达的影响[J].中国临床药理学与治疗学,2006,11(9):999-1002.
[8]Pin S S,Bahr BA.Protein kinase C is a common component of CGRP receptor desensitization induced by distinct agonists[J].EurJ Pharmacol,2008,587(1-3):8-15.
[9]付红敏,李 利,王亚军,等.降钙素基因相关肽对高氧暴露下肺泡Ⅱ型上皮细胞增殖及蛋白激酶Cα信号途径的调控作用[J].中国危重病急救医学,2010,22(5):263-266.
